Esittely
Biologisesti aktiivisten molekyylien helppo ja tehokas synteesi on yksi orgaanisen kemian ja lääkekemian päätavoitteista. Viime vuosina monikomponenttireaktioista on tullut yksi tärkeistä välineistä syntetisoitaessa rakenteellisesti monimuotoisia kemiallisia kirjastoja lääkeaineen kaltaisia polyfunktionaalisia orgaanisia molekyylejä . Lisäksi monikomponenttiset reaktiot ovat monilta osin yksinkertaisempia ja tehokkaampia kuin perinteiset kemialliset reaktiot. MCR:t mahdollistavat monimutkaisten orgaanisten molekyylien kombinatoristen kirjastojen rakentamisen tehokkaaseen johtavan rakenteen tunnistamiseen ja optimointiin lääkkeiden löytämisessä .
Jatkona meneillään olevalle tutkimustyöllemme nanomateriaalien mikroaaltoavusteisesta synteesistä olemme havainneet, että nanokiteiset metallioksidit ovat kiinnittäneet huomattavaa huomiota synteettisten ja lääkekemistien keskuudessa niiden korkean katalyyttisen aktiivisuuden ja uudelleenkäytettävyyden vuoksi . Sinkkioksidi on edullinen, kosteusvakaa, uudelleenkäytettävä, kaupallisesti saatavilla oleva ja myrkytön, liukenematon sekä polaarisiin että ei-polaarisiin liuottimiin. Laaja valikoima orgaanisia reaktioita, joihin kuuluvat Beckmannin uudelleenjärjestelyt , N-bentsylaatio , asylaatio , oksiimien dehydraatio , epoksidien nukleofiiliset renkaan avautumisreaktiot , syklisen urean synteesi , amiinien N-formylaatio . Erityisesti kiteinen nano-ZnO-oksidi osoittaa parempaa katalyyttistä aktiivisuutta verrattuna niiden bulkkikokoisiin vastineisiin .
Viime vuosina on kiinnitetty paljon huomiota dihydropyridiiniyhdisteiden synteesiin niiden valtavan käytön vuoksi eri tutkimusaloilla, mukaan lukien biologinen tiede ja lääkekemia . Monet DHP-yhdisteet ovat jo kaupallisia tuotteita, kuten amlodipiini, felodipiini, isradipiini, lakidipiini, nikardipiini, nitrendipiini, nifedipiini ja nimodipiini B, joista nitrendipiinillä ja nemadipiini B:llä on voimakas kalsiumkanavia salpaava vaikutus (kuva 1), ja ne ovat nousseet yhdeksi tärkeimmistä lääkeryhmistä sydän- ja verisuonitautien hoidossa . Lisäksi dihydropyridiinijohdannaisilla on monenlaisia biologisia vaikutuksia, kuten geroprotektiivisia, hepatoprotektiivisia, ateroskleroottisia, kasvainten vastaisia ja diabeteksen vastaisia vaikutuksia . Laajat tutkimukset ovat paljastaneet, että dihydropyridiiniyksiköitä sisältävillä yhdisteillä on erilaisia lääkinnällisiä toimintoja, kuten neuroprotektiivinen, verihiutaleiden aggregaatiota estävä, aivojen iskeemistä estävä vaikutus Alzheimerin taudin hoidossa ja kasvainten hoidossa käytettävät kemosensitisaattorit. Lääkeresistenssin modifioijina , antioksidantteina ja lääkkeenä virtsankarkailuinkontinenssin hoitoon .
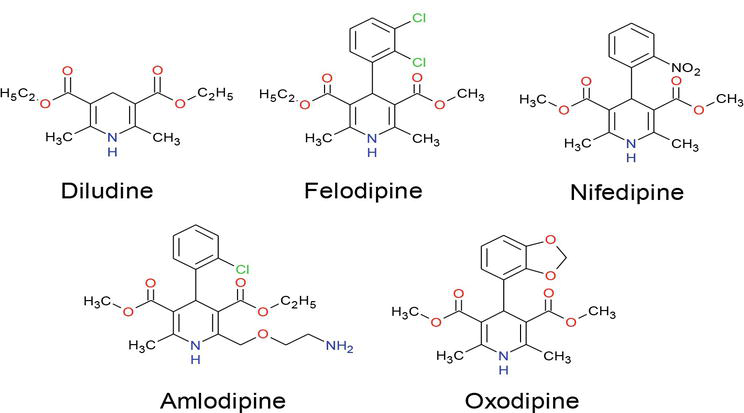
Kuvio 1.
1,4-DHP-osia sisältävät lääkkeet.
Tämän biologisten ominaisuuksien mallintamiseksi ja ymmärtämiseksi sekä 1,4-DHP-yhdisteisiin perustuvien uusien kemoterapeuttisten aineiden kehittämiseksi on panostettu merkittävästi tehokkaiden synteesimenetelmien luomiseen. Yleensä 1,4-DHP-yhdisteet syntetisoitiin Hantzsch-menetelmällä , johon kuuluu aldehydin, β-ketoesterin ja ammoniakin syklokondensaatio joko etikkahapossa tai refluksissa alkoholeissa pitkien reaktioaikojen ajan, mikä tyypillisesti johtaa alhaisiin saantoihin . Muita menetelmiä ovat mikroaaltojen , korkeiden lämpötilojen käyttö takaisinvirtauksessa , orgaaniset katalyytit ja metallitriflaatit .
Nykyaikana DNA on tärkeä lääkekohde, ja se säätelee monia biokemiallisia prosesseja, jotka tapahtuvat solujärjestelmässä. Pienten molekyylien vuorovaikutuksia DNA:n kanssa tutkitaan edelleen intensiivisesti ja laajalti niiden käyttökelpoisuuden vuoksi solun replikaation ja transkriptionaalisen säätelyn koettimina ja niiden potentiaalin vuoksi lääkkeinä . Erityisesti yhdisteiden suunnittelulla, joka perustuu niiden kykyyn pilkkoa DNA:ta, on suuri merkitys paitsi ensisijaiselta biologiselta kannalta myös fotodynaamisen terapeuttisen lähestymistavan kannalta tehokkaiden lääkkeiden kehittämiseksi . 1,4-dihydropyridiinijohdannaiset ovat herättäneet kemistien huomion niiden monipuolisten biologisten sovellusten vuoksi. Tämän yhdisteluokan biologinen merkitys pakotti meidät laajentamaan tätä sarjaa työskentelemällä 1,4-dihydropyridiinijohdannaisten synteesin ja DNA:n valohajoamistutkimusten parissa. Tässä tiedonannossa on raportoitu 1,4-dihydropyridiinijohdannaisten synteesi ja niiden DNA:n valonsirontatutkimukset ja molekyylidockaus.
Kirjallisuudessa tunnetaan useita menetelmiä 1,4-dihydropyridiinijohdannaisten synteesiin. Jatkona nanomateriaalien kemiaa koskevalle ohjelmallemme ilmoitamme tässä tehokkaan mikroaaltomenetelmän kiteisten ZnO-NP:iden synteesiin. Tässä työssä käytetty ZnO syntetisoitiin muunnetun menetelmän mukaisesti. Valmistettu kiteinen ZnO-nanohiukkanen karakterisoitiin käyttämällä jauhe-XRD:tä, SEM:ää ja EDX:ää (kuva 2). Synteettinen lähestymistapamme alkoi 1 ekvivalentin bentsaldehydin 1a kondensoinnilla 2 ekvivalentin etyyliasetoasetaatin 2a ja 2 ekvivalentin NH4OAc 3a kanssa ZnO-Nps:n läsnä ollessa, mikä johti Hantzschin 1,4-dihydropyridiinin 4a muodostumiseen (kuva 3). Reaktio saatiin päätökseen 5 minuutissa mikroaaltosäteilytyksessä, ja tuote eristettiin tavanomaisella menetelmällä 90 prosentin saannolla ja erittäin puhtaana. Samanlaisissa olosuhteissa erilaiset substituoidut aromaattiset aldehydit, jotka kantoivat joko elektronia luovuttavia tai -vieviä substituentteja, reagoivat 1,3-diketonien kanssa muodostaen 1,4-DHP:tä hyvällä tai erinomaisella saannolla, ja tuloksista on yhteenveto taulukossa 1.
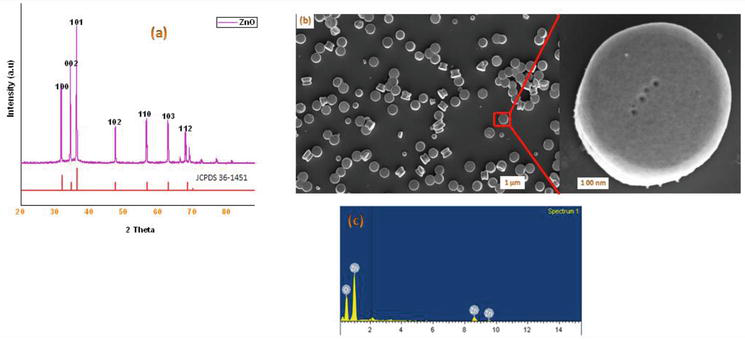
Kuva 2.
(a) Mikroaaltomenetelmällä saatujen ZnO-nanohiukkasten jauhe-XRD; (b) ZnO-NP:iden SEM-kuvat; (c) Mikroaaltomenetelmällä saatujen ZnO-nanohiukkasten EDX-analyysispektri.
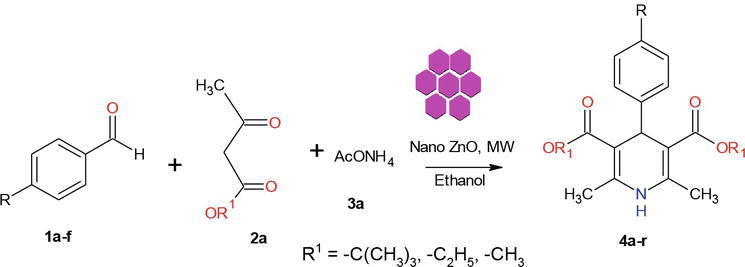
Kuvio 3.
1,4-dihydropyridiinien synteesi.
| Entrya | R | R1 | Products | Entrya | Sato (%)b | |
|---|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 | |
| 2 | 4-MeO-C6H5 | t-Bu | 4b | 2 | 95 | |
| 3 | 4-OH-C6H5 | t-Bu | 4c | 3 | 95 | |
| 4 | 4-F-C6H5 | t-Bu | 4d | 4 | 4 | 95 |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 | |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 | |
| 7 | C6H5 | Et | 4 g | 7 | 90 | |
| 8 | 4-MeO-C6H5 | Et | 4 h | 8 | 95 | |
| 9 | 4-OH-C6H5 | Et | 4i | 9 | 9 | 92 |
| 10 | 4-F-C6H5 | Et | 4j | 10 | 92 | |
| 11 | 4-Cl-C6H5 | Et | 4 k | 11 | 90 | |
| 12 | 4-NO2-C6H5 | Et | 4 l | 12 | 90 | |
| 13 | C6H5 | Me | 4 m | 13 | 90 | |
| 14 | 4-MeO-C6H5 | Me | 4n | 14 | 87 | |
| 15 | 4-OH-C6H5 | Me | 4o | 15 | 90 | |
| 16 | 4-H-OH5 | 4-F-C6H5 | Me | 4p | 16 | 90 |
| 17 | 4-Cl-C6H5 | Me | 4q | 17 | 90 | |
| 18 | 4-NO2- | 4-NO2-C6H5 | Me | 4r | 18 | 90 |
Taulukko 1.
1,4-dihydropyridiinien synteesi.
aKaikki tuotteet karakterisoitiin 1H-NMR- ja 13C-NMR-tutkimuksin ja niitä verrattiin kirjallisuuden mps:iin. bIsoleerattujen tuotteiden saannot
Mikroaaltosäteilytyksellä avustettu prosessi minimoi usein sivutuotteiden muodostumisen minimille ja vaatii paljon vähemmän aikaa kuin termiset menetelmät. Tärkeimmät edut, joita saavutetaan suorittamalla reaktiot kontrolloiduissa olosuhteissa suljetuissa astioissa, ovat huomattavat nopeusparannukset ja suuremmat tuotetuotokset, jotka voidaan usein saavuttaa. Jatkona nanomateriaalien mikroaaltosynteesiä koskeville tutkimuksillemme olemme siksi pyrkineet kehittämään nopean, mikroaalto-avusteisen protokollan 1,4-DHP:n synteesiä varten käyttäen kiteistä ZnO-nanokatalyyttiä (kuva 3).
1,4-DHP-johdannaisten DNA:n pilkkoutumista tutkittiin agaroosigeelielektroforeesilla. Kun ympyränmuotoiselle plasmidi-DNA:lle tehtiin elektroforeesi, havaittiin suhteellisen nopea siirtyminen ehjälle superkierteiselle DNA:lle (tyyppi I). Jos toisessa säikeessä tapahtuu pilkkoutumista (nikkelöityminen), superkierretty DNA relaksoituu muodostaen hitaammin liikkuvan avoimen pyöreän muodon (tyyppi II). Jos molemmat säikeet pilkkoutuvat, syntyy lineaarinen muoto (tyyppi III), joka liikkuu tyypin I ja II välillä. Tyypin I (superkierretty) muuntumista tyypiksi II (niksautunut pyöreä) havaittiin eri pitoisuuksilla 1,4-DHP:tä ja säteilytettiin 2 tuntia 1:9 DMSO:ssa/trisbufferissa (20 μM, pH- 7,2) 365 nm:ssä. DNA:n pilkkoutumista ei havaittu kontrollissa, jossa 1,4-DHP:tä ei ollut (kaista 1) (kuva 4). Näiden 1,4-DHP:n pitoisuuden kasvaessa pUC 19:n I-tyypin DNA:n määrä väheni vähitellen, kun taas II-tyypin määrä kasvoi (kuva 4).
40 μM:n pitoisuudessa yhdiste (4c) voi edistää vain 30 %:n DNA:n muuntumista I-tyypistä II:ksi (kuva 5). Pitoisuudessa 80 μM yhdiste (4c) voi lähes edistää noin 80 % DNA:n muuntumista tyypistä I tyypiksi II (kuva 5). Testiyhdisteiden pilkkomispotentiaalia arvioitiin vertaamalla kontrolli- ja testiyhdisteissä esiintyviä kaistoja 80 μM:n pitoisuudella. Muilla johdannaisilla oli kuitenkin paljon alhaisempi pilkkomistehokkuus pUC 19 -DNA:lle. Jopa 80 μM:n pitoisuudella se voi edistää vain 40 %:n DNA:n muuntumista tyypin I:stä II:ksi (kuva 5).
Mutta korkeammissa pitoisuuksissa, noin 130 μM:n kohdalla, yhdisteet saostuvat, eikä DNA:ssa ole hetkeä. Kuva (kuva 6) osoittaa selvästi, että yhdisteet (4b, 4c, 4d, 4e, 4f ja 4 g) osoittavat pUC19-dna:n DNA:n pilkkoutumista 80 μM:n pitoisuudessa. Tulokset osoittivat, että yhdisteet, joissa on -OCH3 ja -OH fenyylirenkaan -para-asennossa (C-6), pilkkovat DNA:ta kokonaan, muut yhdisteet pilkkovat DNA:ta lähes kokonaan. Kaiken kaikkiaan se osoittaa, että alkoksiryhmät ovat erittäin reaktiivisia radikaaleja, jotka abstrahoivat vetyatomeja tehokkaasti 2-deoksiriboosin C-4′:stä. On mielenkiintoista huomata, että hydroksyyliryhmän on raportoitu aiheuttavan happiradikaalien välittämiä DNA-vaurioita valosäteilyn läsnä ollessa.
1,4-DHP:n rakenne-aktiivisuussuhdetutkimukset DNA:n valosirrotustutkimusten osalta osoittavat, että muutokset substituutiokaaviossa C-3-, C-4- ja C-5-asemissa muuttavat 1,4-DHP:n rengasta. Osiris Property Explorer on yksi tällainen tietoon perustuva aktiivisuuden ennustustyökalu, joka ennustaa uusien yhdisteiden lääkeaineen todennäköisyyttä, lääkeainepistemäärää ja ei-toivottuja ominaisuuksia, kuten mutageenisia, kasvaimia aiheuttavia, ärsyttäviä ja lisääntymisvaikutuksia, saatavilla olevien lääkkeiden ja muiden kuin lääkkeiden kemiallisten fragmenttitietojen perusteella, kuten on raportoitu (taulukko 2). Havaittiin, että yhdisteet, joiden alifaattiset ryhmät, kuten -CH3, -COOCH3, -COOC2H5 ja -COOC(CH3)3, olivat kiinnittyneet 1,4-DHP:n C-2:een ja C-3:een, osoittivat hyvää aktiivisuutta. Muut johdannaiset, joilla on elektronia luovuttava substituentti, kuten hydroksi- ja metoksiryhmä fenyylirenkaassa (C-6), lisäävät DNA:n valonsironta-aktiivisuutta. Metoksiryhmän happiatomin yksinäinen elektronipari delokalisoituu bentseenirenkaan π-avaruuteen, mikä lisää aktiivisuutta. Vastaavasti elektronia vetävät substituentit, kuten 1,4-DHP:n 4-fluorifenyyli ja 4-kloorifenyyli, vähentävät aktiivisuutta. Nämä tulokset osoittavat, että 1,4-DHP:n rakenteen alkoksisubstituentti ja pyridiinirenkaan typpi ovat vastuussa DNA:n pilkkomisesta.
Havaittujen spektroskooppisten tulosten järkeistämiseksi ja interkalaatiomuodon ymmärtämiseksi 1,4-DHP (4a-r) telakoitiin peräkkäin d(CGCGAATTCGCG)2-dodekameerin (PDB ID: 1BNA) sekvenssin d(CGCGAATTCGCG)2-dodekameerin DNA-dupleksin sisälle ennustamaan valittua sitoumuspaikkaa sekä ligandin ensisijaista orientaatiota DNA:n pienen uran sisällä. Kaikki syntetisoidut 1,4-DHP-johdannaiset piirrettiin ChemSketch-ohjelmalla ja rakenteet tallennettiin .mol-muodossa. Sen jälkeen .mol-muotoa käytettiin Hyperchem-7-ohjelmassa niiden fragmenttien säätämiseksi, minkä jälkeen ligandien kokonaisenergian minimointi suoritettiin niin, että ne voivat saavuttaa vakaan konformaation, ja tiedosto tallennettiin .pdb-muotoon.
B-DNA:n proteiinien 3D-rakenne saatiin RCSB PDB:stä (tietoportaali biologisiin makromolekyylirakenteisiin). Vesimolekyylit poistettiin tiedostosta ja proteiini protonoitiin 3D:ssä polaaristen vetyjen lisäämiseksi. Sitoutumistasku tunnistettiin site finder -ohjelmalla, ja vastaavat jäännökset valittiin. Telakointiparametrit asetettiin oletusarvoihin ja pisteytysalgoritmiin, ja telakointiajoissa säilytettiin 30 konformaatiota ligandia kohti. Telakoidut proteiinirakenteet tallennettiin .pdb-muotoon, ja ligandin konformaatiot tutkittiin yksi kerrallaan. Kompleksit, joilla oli parhaat konformaatiot, valittiin suurimman pistemäärän, pienimmän sitoutumisenergian ja pienimpien RMSD-arvojen perusteella .
Syntetisoidut orgaaniset yhdisteet suorittavat biologisen aktiivisuutensa tehokkaammin sitoutumalla vastaavaan proteiiniin tai DNA:han niiden spesifiseen sitoutumiskohtaan. Ligandien kanssa vuorovaikutuksessa olevien jäännösten tunnistaminen on välttämätön askel kohti rationaalista lääkesuunnittelua, molekyylireitin ymmärtämistä ja proteiinin mekanistista toimintaa.
Molekulaarinen telakointi suoritettiin jäykän reseptoriproteiinin ja joustavien ligandien välillä. Taulukossa 3 esitetään yksityiskohtaiset telakointitulokset, mukaan lukien proteiini-ligandi-kompleksien RMSD- ja sidosenergia-arvot. Ligandit (4b, 4c, 4 h, 4i, 4n ja 4o) sitoutuvat voimakkaasti B-DNA:han, kuten niiden minimisidosenergia-arvoista voidaan päätellä, jotka ovat vastaavasti -13,8, -12,9 ja -12,3 kcal/mol (kuva 7).
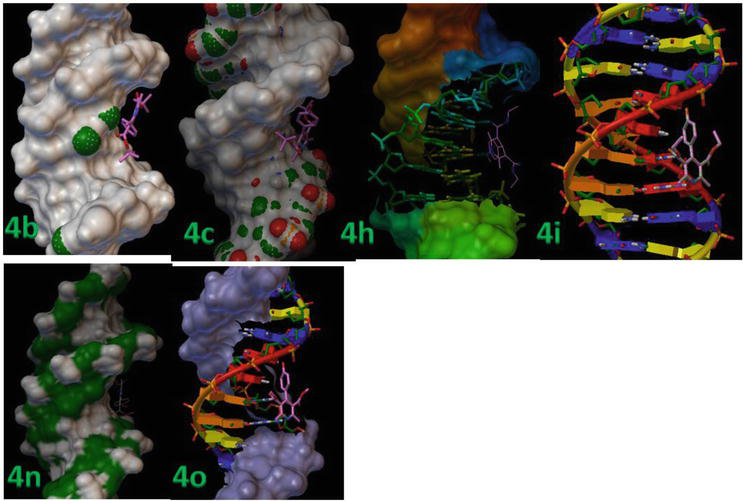
Kuva 7.
1,4-DHP telakoitiin peräkkäin DNA-dupleksin sekvenssin d(CGCGAATTCGCG)2 dodekameerin (PDB ID: 1BNA) sisälle.
Kuvassa 8 on esitetty aktiivisen paikan sijainti DNA:n spiraalirakenteessa, ja siitä käy myös ilmi, että kaikki telakoidut ligandit ryhmittyivät taskun sisään. Kuvassa 8 on esitetty 4c:n ja 4d:n vetysidosvuorovaikutus DNA:n spiraalirakenteen sisällä sijaitsevan aktiivisen alueen keskeisten jäännösten kanssa. Tässä mallissa näkyy selvästi, että yhdiste 4c muodosti vetysidoksen tymiinin -OH:n ja N1:n välille, jotka ovat DT7 ja DT19 ja joiden sidospituudet ovat 2,02 ja 2,05 Ǻ. Lisäksi muut 1,4-DHP:n johdannaiset muodostivat vähemmän H-sidosvuorovaikutuksia DNA:n kanssa johtuen van der Waalsin vuorovaikutuksiin osallistuvan aromaattisen renkaan suuntautumisesta (Wireframe-malli) ja DNA:n sitoutumiskohtien litteistä hydrofobisista alueista (taulukko 3). Nämä tulokset osoittivat, että 1,4-DHP:n ja B-DNA:n in silico -molekyylidockaustutkimukset viittasivat siihen, että 1,4-DHP:llä on potentiaalia häiritä hydrofobisia ja H-sidosvuorovaikutuksia, mikä vaikuttaa B-DNA:n kiinnittymisen vakauteen, ja se voi olla tehokas syöpäsolulinjoissa.
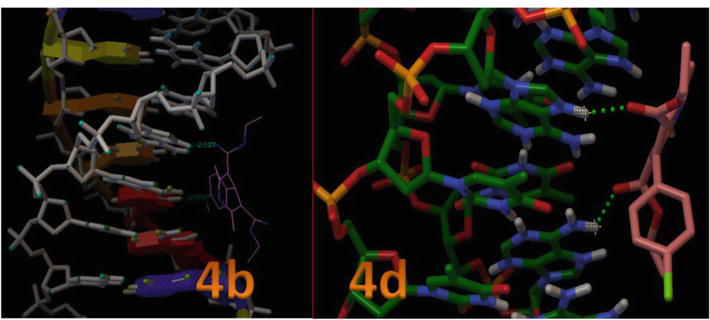
Kuva 8.
1,4-DHP:n vuorovaikutus DNA-dupleksin kanssa, jonka sekvenssi on d(CGCGAATTCGCG)2-dodekameeri (PDB ID: 1BNA).