Bevezetés
A szerves és gyógyszerkémia egyik fő célkitűzése a biológiai aktív molekulák könnyű és hatékony szintézise. Az utóbbi években a többkomponensű reakciók váltak az egyik fontos eszközzé a szerkezetileg változatos kémiai könyvtárak, gyógyszerszerű polifunkciós szerves molekulák szintézisében . Ezenkívül az MCR-ek több szempontból is előnyösek a hagyományos kémiai reakciókkal szemben az egyszerűség és a szintetikus hatékonyság tekintetében. Az MCR lehetővé teszi komplex szerves molekulák kombinatorikus könyvtárainak létrehozását a hatékony vezetőszerkezet-azonosítás és optimalizálás érdekében a gyógyszerkutatásban .
A nanoanyagok mikrohullámmal támogatott szintézisével kapcsolatos folyamatban lévő kutatásaink folytatásaként megállapítottuk, hogy a nanokristályos fém-oxidok nagy katalitikus aktivitásuk és újrafelhasználhatóságuk miatt jelentős figyelmet keltettek a szintetikus és gyógyszerkémikusok körében . A cink-oxid olcsó, nedvességálló, újrafelhasználható, kereskedelmi forgalomban kapható, nem mérgező, poláris és nem poláris oldószerekben egyaránt oldhatatlan. A szerves reakciók széles skálája, amelyek közé tartoznak a Beckmann átrendeződések , N-benzilálás , acilálás , oximok dehidratálása , epoxidok nukleofil gyűrűnyitási reakciói , ciklikus karbamid szintézise , aminok N-formilálása . Különösen a kristályos nano-ZnO-oxid jobb katalitikus aktivitást mutat az ömlesztett méretű társaikhoz képest .
Az utóbbi években nagy figyelem irányult a dihidropiridin vegyületek szintézisére, mivel óriási az alkalmazásuk a különböző kutatási területeken, beleértve a biológiai tudományokat és a gyógyszerkémiát . Számos DHP már kereskedelmi termék, mint például: amlodipin, felodipin, izradipin, lacidipin, nikardipin, nitrendipin, nifedipin és nimodipin B, amelyek közül a nitrendipin és a nemadipin B erős kalciumcsatorna blokkoló hatású (1. ábra), és a szív- és érrendszeri betegségek kezelésének egyik legfontosabb gyógyszerosztályává váltak . Ezenkívül a dihidropiridin-származékok számos biológiai aktivitással rendelkeznek, mint például geroprotektív, hepatoprotektív, anti-atheroszklerotikus, tumorellenes és antidiabetikus aktivitással . Széles körű vizsgálatok feltárták, hogy a dihidropiridin egységet tartalmazó vegyületek különböző gyógyászati funkciókat mutatnak, mint például neuroprotektáns, vérlemezke-aggregáció elleni aktivitás, agyi iszkémiát gátló aktivitás az Alzheimer-kór kezelésében, kemoszenzibilizátor a tumorterápiában. Gyógyszerrezisztencia módosítók , antioxidánsok és a vizeletürítési inkontinencia kezelésére szolgáló gyógyszer .
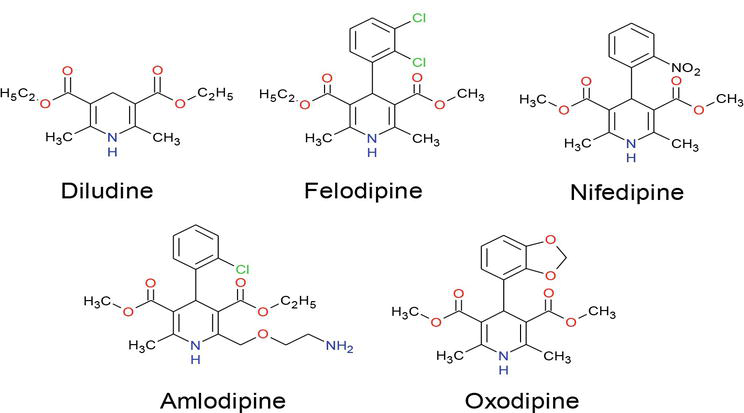
1. ábra
1,4-DHP részeket tartalmazó gyógyszerek.
Ezek a biológiai tulajdonságok modellezése és megértése, valamint az 1,4-DHP vegyületeken alapuló új kemoterápiás szerek kifejlesztése érdekében jelentős erőfeszítéseket tettek a szintézisük hatékony módszereinek kidolgozására. Az 1,4-DHP-ket általában Hantzsch-módszerrel szintetizálták, amely magában foglalja egy aldehid, egy β-ketoészter és ammónia ciklokondenzációját ecetsavban vagy alkoholokban reflux alatt, hosszú reakcióidő alatt, ami általában alacsony hozamot eredményez. Más módszerek közé tartozik a mikrohullámok , a magas hőmérsékletű reflux , a szerves katalizátorok és a fémtriflatok használata .
A DNS fontos gyógyszercélpont, és számos biokémiai folyamatot szabályoz, amelyek a sejtrendszerben zajlanak. A DNS-sel való kismolekulás kölcsönhatásokat továbbra is intenzíven és széles körben tanulmányozzák a sejtreplikáció és a transzkripciós szabályozás szondáiként való hasznosságuk és a gyógyszerként való potenciáljuk miatt . Különösen a vegyületek DNS-hasító képességükön alapuló tervezése nemcsak elsődleges biológiai szempontból, hanem a fotodinamikus terápiás megközelítés szempontjából is nagy jelentőséggel bír a hatásos gyógyszerek kifejlesztése szempontjából . Az 1,4-dihidropiridin-származékok sokféle biológiai alkalmazásuk miatt felkeltették a kémikusok figyelmét . A vegyületek ezen osztályának biológiai jelentősége arra ösztönzött bennünket, hogy bővítsük ezt a sorozatot az 1,4-dihidropiridin-származékok szintézisével és DNS-fotokleavage vizsgálatával. Ebben a közleményben 1,4-dihidropiridin-származékok szintéziséről, valamint DNS-fotómegkötési vizsgálataikról és molekuláris dokkolásukról számoltunk be.
Az irodalomban számos módszer ismert az 1,4-dihidropiridin-származékok szintézisére. A nanoanyagok kémiájával foglalkozó programunk folytatásaként az alábbiakban egy hatékony mikrohullámú módszert mutatunk be kristályos ZnO-NP-k szintézisére. Az ebben a munkában használt ZnO-t egy módosított módszer szerint szintetizáltuk. Az előállított kristályos ZnO-nanorészecskéket por XRD, SEM, EDX segítségével jellemeztük (2. ábra). Szintetikus megközelítésünk 1 ekvivalens benzaldehid 1a 2 ekvivalens etil-acetoacetáttal 2a és 2 ekvivalens NH4OAc 3a kondenzációjával kezdődött ZnO-Nps jelenlétében, ami a Hantzsch 1,4-dihidropiridin 4a képződését eredményezte (3. ábra). A reakció mikrohullámú besugárzás alatt 5 perc alatt befejeződött, és a terméket a szokásos feldolgozással izoláltuk, 90%-os hozammal és nagy tisztasággal. Hasonló körülmények között különböző szubsztituált aromás aldehidek, amelyek vagy elektrondonáló vagy -vonó szubsztituenseket hordoznak, 1,3-diketonokkal reagáltak 1,4-DHP-t képezve jó vagy kiváló hozammal, és az eredményeket az 1. táblázatban foglaltuk össze.
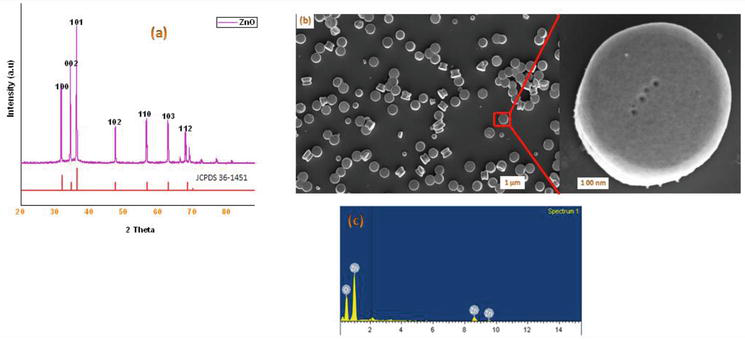
2. ábra.
(a) A mikrohullámú módszerrel kapott ZnO nanorészecskék por XRD-je; (b) a ZnO-NP-k SEM képei; (c) a mikrohullámú módszerrel kapott ZnO nanorészecskék EDX analízis spektruma.
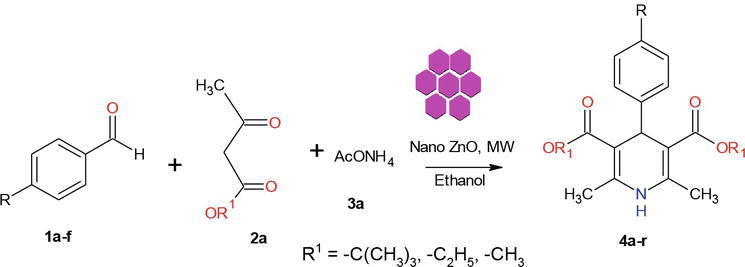
3. ábra.
1,4-dihidropiridinek szintézise.
| Bemenet | R | R1 | Termékek | Termékek | Entrya | Hozam (%)b |
|---|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 | |
| 2 | 4-MeO- | 1 | 90 | |||
| 2 | 4-MeO-C6H5 | t-Bu | 4b | 2 | 95 | |
| 3 | 4-OH-C6H5 | t-Bu | 4c | 3 | 95 | |
| 4 | 4-F-C6H5 | t-Bu | 4d | 4 | 95 | |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 | |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 | |
| 7 | C6H5 | Et | 4 g | 7 | 90 | |
| 8 | 4-MeO-C6H5 | Et | 4 h | 8 | 95 | |
| 9 | 4-OH-C6H5 | Et | 4i | 9 | 92 | |
| 10 | 4-F-C6H5 | Et | 4j | 10 | 92 | |
| 11 | 4-Cl-C6H5 | Et | 4 k | 11 | 90 | |
| 12 | 4-NO2-C6H5 | Et | 4 l | 12 | 90 | |
| 13 | C6H5 | Me | 4 m | 13 | 90 | |
| 14 | 4-MeO-C6H5 | Me | 4n | 14 | 87 | |
| 15 | 4-OH-C6H5 | Me | 4o | 15 | 90 | |
| 16 | 4-F-C6H5 | Me | 4p | 16 | 90 | |
| 17 | 4-Cl-C6H5 | Me | 4q | 17 | 90 | |
| 18 | 4-NO2- | 4NO2-C6H5 | Me | 4r | 18 | 90 |
1. táblázat.
1,4-dihidropiridinek szintézise.
aMinden terméket 1H NMR és 13C NMR vizsgálatokkal jellemeztünk és összehasonlítottuk az irodalmi mps-ekkel. bAz izolált termékek hozama
A mikrohullámú besugárzással segített eljárás nagyon gyakran minimalizálja a melléktermékek képződését és sokkal kevesebb időt igényel, mint a termikus módszerek. A reakciók zárt edényekben, ellenőrzött körülmények között történő végrehajtásának fő előnye a jelentős sebességnövekedés és a gyakran elérhető nagyobb termékhozam. Ezért a nanoanyagok mikrohullámú szintézisével kapcsolatos vizsgálataink folytatásaként , kísérletet tettünk egy gyors, mikrohullámmal támogatott protokoll kidolgozására az 1,4-DHP-k szintézisére kristályos ZnO-nano katalizátor felhasználásával (3. ábra).
Az 1,4-DHP származékok DNS hasadását agaróz gélelektroforézissel vizsgáltuk. Amikor cirkuláris plazmid DNS-t elektroforézisnek vetettek alá, viszonylag gyors migrációt figyeltek meg az ép szupertekercselt DNS (I. típus) esetében. Ha az egyik szálon hasadás következik be (nicking), a szupertekercselt DNS relaxál, és egy lassabban mozgó, nyitott, cirkuláris formát hoz létre (II. típus). Ha mindkét szál hasad, akkor egy lineáris forma (III. típus) keletkezik, amely az I. és a II. típus között vándorol. Az I. típusú (szupertekercselt) II. típusúvá (bevágott kör alakú) átalakulását 1,4-DHP különböző koncentrációjával és 2 órás besugárzással, 1:9 DMSO/trisbuffer (20 μM, pH- 7,2) arányban, 365 nm-en figyeltük meg. A kontroll esetében, amelyben nem volt 1,4-DHP (1. sáv), nem figyeltünk meg DNS-hasadást (4. ábra). Ezen 1,4-DHP koncentrációjának növekedésével a pUC 19 DNS I-es típusának mennyisége fokozatosan csökkent, míg a II-es típus növekedett (4. ábra).
40 μM koncentrációban a (4c) vegyület csak 30%-ban képes elősegíteni a DNS I-es típusból II-es típusba történő átalakulását (5. ábra). 80 μM koncentrációban a (4c) vegyület majdnem 80%-ban képes elősegíteni a DNS I-es típusból II-es típusba történő átalakulását (5. ábra). A vizsgált vegyületek hasítási potenciálját a kontroll és a vizsgált vegyületek 80 μM koncentrációban megjelenő sávjainak összehasonlításával értékeltük. A többi származék azonban sokkal alacsonyabb hasítási hatékonyságot mutat a pUC 19 DNS esetében. Még 80 μM koncentrációban is csak 40%-ban képesek elősegíteni a DNS I-es típusból II-es típusba történő átalakulását (5. ábra).
De magasabb, 130 μM körüli koncentrációban a vegyületek kicsapódnak, és nincs pillanat a DNS-ben. A képen (6. ábra) jól látható, hogy a vegyületek (4b, 4c, 4d, 4e, 4f és 4 g) 80 μM koncentrációban a pUC19 DNS DNS hasítását mutatják. Az eredmények azt mutatták, hogy a fenilgyűrű -para pozíciójában (C-6) -OCH3 és -OH-t tartalmazó vegyületek teljesen hasították a DNS-t, a többi vegyület csaknem teljes DNS-hasadást mutatott. Összességében ez azt jelzi, hogy az alkoxi csoportok erősen reaktív gyökök, amelyek hatékonyan vonnak el hidrogénatomokat a 2-deoxiribóz C-4′-jénél. Érdekes megjegyezni, hogy a hidroxilcsoport a jelentések szerint oxigéngyök által közvetített DNS-károsodást idéz elő fotósugárzás jelenlétében.
Az 1,4-DHP-k szerkezet-hatáskapcsolati vizsgálatai a DNS fotoklézeres vizsgálatai tekintetében azt mutatják, hogy a C-3, C-4 és C-5 pozíciókban lévő szubsztitúciós mintázat változásai megváltoztatják az 1,4-DHP gyűrűt. Az Osiris Property Explorer egy ilyen tudásalapú aktivitás-előrejelző eszköz, amely a rendelkezésre álló gyógyszerek és nem gyógyszerek kémiai fragmentum adatai alapján előre jelzi az új vegyületek hatóanyag-valószínűségét, hatóanyag-pontszámát és nemkívánatos tulajdonságait, például mutagén, tumorogén, irritáló és reproduktív hatását (2. táblázat) . Megfigyelték, hogy az 1,4-DHP C-2- és C-3-csoportjához kötött alifás csoportokkal, mint például -CH3, -COOCH3, -COOC2H5 és -COOC(CH3)3, rendelkező vegyületek jó aktivitást mutattak. Más származékok, amelyek a fenilgyűrűn (C-6) elektron-donáló szubsztituenssel, például hidroxi- és metoxicsoporttal rendelkeznek, növelik a DNS-fotoklebontó aktivitást. A metoxicsoport oxigénatomján lévő magányos elektronpár delokalizálódik a benzolgyűrű π terébe, ezáltal növelve az aktivitást. Hasonlóképpen, az elektronelvonó szubsztituensek, mint például az 1,4-DHP 4-fluorfenil, 4-klórfenil, csökkentik az aktivitást. Ezek az eredmények azt jelzik, hogy az 1,4-DHP szerkezetében az alkoxiszubsztituens és a piridingyűrű nitrogénje felelős a DNS hasításáért.
A megfigyelt spektroszkópiai eredmények racionalizálása és az interkalációs modalitásra való további rálátás érdekében az 1,4-DHP-t (4a-r) egymás után dokkoltuk a d(CGCGAATTCGCG)2 dodekamer (PDB ID: 1BNA) szekvencia DNS-duplexében, hogy megjósoljuk a kiválasztott kötőhelyet és a ligandum preferált orientációját a DNS kis barázdájában. Az összes szintetizált 1,4-DHP-származékot a ChemSketch programban rajzoltuk meg, és a szerkezeteket .mol formátumban mentettük el. Ezt követően a .mol formátumot a Hyperchem-7-ben használtuk a fragmentumaik beállításához, majd a ligandumok teljes energiájának minimalizálása következett, hogy stabil konformációt érjenek el, és a fájlt .pdb formátumba mentettük.
A B-DNS fehérje 3D szerkezetét az RCSB PDB-ből (biológiai makromolekulaszerkezetek információs portálja) nyertük. A vízmolekulákat eltávolítottuk a fájlból, és a fehérjét 3D-ben protonáltuk, hogy poláris hidrogéneket adjunk hozzá. A kötőzsebet a site finder segítségével azonosítottuk, és kiválasztottuk a megfelelő maradékokat. A dokkolási paramétereket alapértelmezett értékekre és pontozási algoritmusra állítottuk be, a dokkolási futtatásokat ligandumonként 30 konformációra tartottuk meg. A dokkolt fehérjeszerkezeteket .pdb formátumba mentettük, és a ligandumok konformációit egyenként vizsgáltuk. A legjobb konformációkkal rendelkező komplexeket a legmagasabb pontszám, a legalacsonyabb kötési energia és a minimális RMSD értékek alapján választottuk ki .
A szintetizált szerves vegyületek biológiai aktivitásukat hatékonyabban fejtik ki azáltal, hogy a megfelelő fehérjéhez vagy DNS-hez kötődnek a specifikus kötőhelyükön. A ligandumokkal kölcsönhatásba lépő maradékok azonosítása szükséges lépés a racionális gyógyszertervezés, a molekuláris útvonal megértése és a fehérje mechanisztikus hatásának megértése felé.
Molekuláris dokkolást végeztünk a merev receptorfehérje és a rugalmas ligandumok között. A 3. táblázat mutatja a dokkolási eredmények részleteit, beleértve a fehérje-ligandum komplexek RMSD és kötési energia értékeit. A ligandumok (4b, 4c, 4 h, 4i, 4n és 4o) erősen kötődnek a B-DNS-hez, amint arra a minimális kötési energia értékeikből következtetni lehet, amelyek -13,8, -12,9 és -12,3 kcal/mol értékek (7. ábra).
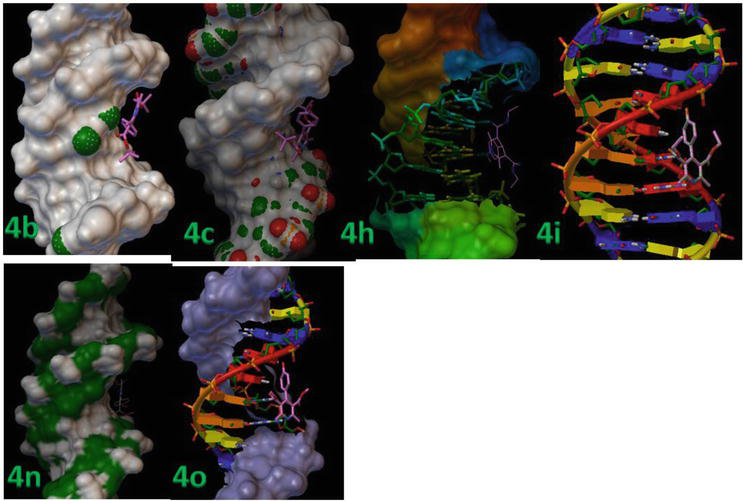
7. ábra.
Az 1,4-DHP-t egymás után dokkoltuk a d(CGCGAATTCGCG)2 dodekamer (PDB ID: 1BNA) szekvenciájú DNS-duplexben.
A 8. ábra mutatja az aktív hely helyzetét a DNS spirális szerkezetében, és az is látható, hogy minden dokkolt ligandum a zsebben csoportosult. A 8. ábra a 4c és 4d hidrogénkötéses kölcsönhatását mutatja a DNS spirális szerkezetében lévő aktív hely kulcsfontosságú maradványaival. Ebben a modellben világosan látható, hogy a 4c vegyület hidrogénkötést alakított ki a timin -OH és N1 vegyülete között, amelyek a DT7 és DT19 vegyületek, 2,02 és 2,05 Ǻ kötéshosszal. Ezenkívül az 1,4-DHP többi származéka kevesebb H-kötéses kölcsönhatást alakított ki a DNS-sel a van der Waals kölcsönhatásokban részt vevő aromás gyűrű orientációja (Wireframe modell) és a DNS kötőhelyeinek lapos hidrofób régiói miatt (3. táblázat). Ezek az eredmények az 1,4-DHP-k B-DNS-szel végzett in silico molekuláris dokkolási vizsgálatai azt mutatták, hogy az 1,4-DHP-k rendelkeznek a hidrofób és H-kötéses kölcsönhatások megzavarásának lehetőségével, ezáltal befolyásolva a B-DNS rögzítésének stabilitását, és hatékonyak lehetnek a rákos sejtvonalak esetében.
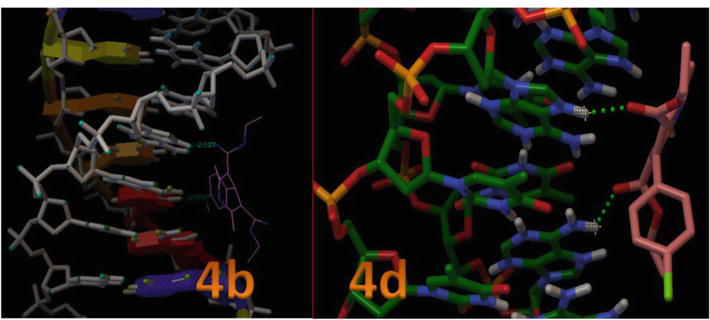
8. ábra.
Az 1,4-DHP kölcsönhatása a d(CGCGAATTCGCG)2 dodekamer szekvencia DNS-duplexével (PDB ID: 1BNA).