Generieke naam: goudnatriumthiomalaat
Doseringsvorm: injectie
Medisch beoordeeld door Drugs.com. Laatst bijgewerkt op 23 maart 2020.
- Bijwerkingen
- Dosering
- Professioneel
- Interacties
- Zwangerschap
- Meer
Disclaimer: Dit geneesmiddel is door de FDA niet veilig en effectief bevonden, en deze etikettering is niet goedgekeurd door de FDA. Voor meer informatie over niet-goedgekeurde geneesmiddelen, klik hier.
Rx only
Chirurgen die van plan zijn goudnatriumthiomalaat te gebruiken, dienen zich grondig op de hoogte te stellen van de toxiciteit en de voordelen ervan. De mogelijkheid van toxische reacties moet altijd aan de patiënt worden uitgelegd alvorens de therapie te beginnen. De patiënten zouden moeten worden gewaarschuwd om om het even welke symptomen onmiddellijk te melden die op giftigheid wijzen. Vóór elke injectie van Goudnatriumthiomalaat dient de arts de resultaten van het laboratoriumwerk te bekijken en de patiënt te zien om de aan- of afwezigheid van bijwerkingen vast te stellen, aangezien sommige bijwerkingen ernstig of zelfs dodelijk kunnen zijn.
- Beschrijving
- CLINISCHE FARMACOLOGIE
- INDICATIES EN GEBRUIK
- CONTRAINDICATIES
- WAARSCHUWINGEN
- VOORZORGSMAATREGELEN :
- Algemeen
- Carcinogeniciteit
- zwangerschap
- Zogende moeders
- Bijwerkingen
- BEHEER VAN BIJWERKENDE REACTIES
- DOSAGE EN ADMINISTRATIE
- Jeugdreumatoïde artritis
- HOW SUPPLIED
- Meer over Myochrysine (goudnatriumthiomalaat)
- Gerelateerde behandelingsgidsen
Beschrijving
Myochrysine® Goudnatriumthiomalaat is een steriele waterige oplossing. Het bevat 0,5 procent BENZYL alcohol toegevoegd als conserveermiddel. De pH van het product is 5,8 t ot 6,5.
Goudnatriumthiomalaat is een mengsel van de mono- en di-natriumzouten van goudthiomaalzuur. De structuurformule is:
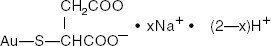
mercaptobutaandizuur, mono- (1+) natriumzout
Het molecuulgewicht voor C4H3AuNa2O4S (het dinatriumzout) is 390,07 en voor C4H4AuNaO4S (het mononatriumzout) is 368. Het molecuulgewicht voor C4H3AuNa2O4S (het dinatriumzout) is 390,07.09.
Goudnatriumthiomalaat wordt geleverd als een oplossing voor intramusculaire injectie die 50 mg goudnatriumthiomalaat per ml bevat.
CLINISCHE FARMACOLOGIE
Het werkingsmechanisme van goudnatriumthiomalaat is onbekend. De belangrijkste werking lijkt een onderdrukkend effect te zijn op de synovitis van actieve reumatoïde ziekte.
INDICATIES EN GEBRUIK
Goudnatriumthiomalaat is geïndiceerd bij de behandeling van geselecteerde gevallen van actieve reumatoïde artritis – zowel van het volwassen als van het juveniele type. Het grootste voordeel treedt op in het vroege actieve stadium. In de late stadia van de ziekte, wanneer kraakbeen- en botschade zijn opgetreden, kan goud alleen de voortgang van reumatoïde artritis controleren en verdere structurele schade aan de gewrichten voorkomen. Het kan geen schade herstellen die door eerder actieve ziekte wordt veroorzaakt.
Goudnatriumthiomalaat zou slechts als één deel van een volledig therapieprogramma moeten worden gebruikt; alleen is het geen volledige behandeling.
CONTRAINDICATIES
Hypergevoeligheid voor om het even welk bestanddeel van dit product.
Erge toxiciteit als gevolg van vroegere blootstelling aan goud of andere zware metalen.
Erge verzwakking.
Systemische lupus erythematosus.
WAARSCHUWINGEN
Voordat met de behandeling wordt begonnen, moet het hemoglobinegehalte, het aantal erytrocyten, het aantal witte bloedcellen, het differentieel en het aantal bloedplaatjes van de patiënt worden bepaald, en moet urineonderzoek worden verricht om als basisreferentie te dienen. De urine moet vóór elke injectie worden geanalyseerd op proteïne en sedimentveranderingen. Volledige bloedtellingen, inclusief bepaling van de bloedplaatjes, moeten worden verricht vóór elke tweede injectie gedurende de behandeling. Het voorkomen van purpura of ecchymosen op om het even welk ogenblik vereist altijd een bloedplaatjestelling.
Gevaarsignalen van mogelijke goudtoxiciteit omvatten: snelle daling van hemoglobine, leukopenie onder 4000 WBC/mm3, eosinofilie boven 5%, daling van bloedplaatjes onder 100.000/mm3, albuminurie, hematurie, pruritus, huideruptie, stomatitis, of aanhoudende diarree. Er dienen geen bijkomende injecties met goudnatriumthiomalaat te worden gegeven tenzij verder onderzoek aantoont dat deze afwijkingen worden veroorzaakt door andere aandoeningen dan goudtoxiciteit.
VOORZORGSMAATREGELEN :
Algemeen
Goudzouten dienen niet gelijktijdig met penicillamine te worden gebruikt.
De veiligheid van gelijktijdige toediening met cytotoxische geneesmiddelen is niet vastgesteld.
Voorzichtigheid is geboden bij het gebruik van Goudnatriumthiomalaat bij patiënten met de volgende aandoeningen:
- een voorgeschiedenis van bloeddyscrasieën zoals granulocytopenie of anemie veroorzaakt door geneesmiddelengevoeligheid,
- allergie of overgevoeligheid voor geneesmiddelen,
- huiduitslag,
- eerdere nier- of leverziekte,
- gemerkte hypertensie,
- gecompromitteerde cerebrale of cardiovasculaire circulatie.
Diabetes mellitus of congestief hartfalen moeten onder controle zijn voordat de goudtherapie wordt ingesteld.
Carcinogeniciteit
Renale adenomen zijn gerapporteerd in langetermijn toxiciteitsstudies met ratten die goudnatriumthiomalaat kregen toegediend in hoge doses (2 mg/kg per week gedurende 45 weken, gevolgd door 6mg/kg per dag gedurende 47 weken), ongeveer 2 tot 42 maal de gebruikelijke menselijke dosis. Deze adenomen zijn histologisch vergelijkbaar met die welke bij ratten ontstaan door chronische toediening van experimentele goudverbindingen en andere zware metalen, zoals lood. Er zijn geen meldingen van nieradenomen bij de mens in verband met het gebruik van goudnatriumthiomalaat.
zwangerschap
Zwangerschapscategorie C.
Van goudnatriumthiomalaat is aangetoond dat het teratogeen is tijdens de organogenetische periode bij ratten en konijnen wanneer het in doses van respectievelijk 140 en 175 maal de gebruikelijke menselijke dosis wordt toegediend. Hydrocefalie en microftalmie waren de misvormingen die bij ratten werden waargenomen toen Gouden Natriumthiomalaat subcutaan werd toegediend in een dosis van 25 mg/kg/dag van dag 6 tot dag 15 van de dracht. Bij konijnen werden misvormingen aan de ledematen en gastroschisis waargenomen wanneer goudnatriumthiomalaat subcutaan werd toegediend in doses van 20-45 mg/kg/dag van dag 6 tot dag 18 van de dracht.
Er zijn geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Goudnatriumthiomalaat mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel voor de moeder het potentiële risico voor de foetus rechtvaardigt.
Zogende moeders
De aanwezigheid van goud is aangetoond in de melk van zogende moeders. Bovendien is goud aangetroffen in het serum en de rode bloedcellen van een zogende zuigeling. Gezien bovenstaande bevindingen en vanwege de mogelijkheid van ernstige bijwerkingen bij zogende zuigelingen als gevolg van goudnatriumthiomalaat, dient een beslissing te worden genomen over het staken van de borstvoeding of over het staken van het geneesmiddel, rekening houdend met het belang van het geneesmiddel voor de moeder. Ook moet rekening worden gehouden met de langzame uitscheiding en persistentie van goud in de moeder, zelfs na het staken van de therapie.
Bijwerkingen
Een verscheidenheid aan bijwerkingen kan zich tijdens de beginfase (wekelijkse injecties) van de therapie of tijdens de onderhoudsbehandeling ontwikkelen. Bijwerkingen worden het vaakst waargenomen wanneer de cumulatieve dosis van het toegediende goudnatriumthiomalaat tussen 400 en 800 mg bedraagt. Zeer zelden treden complicaties op dagen tot maanden na het staken van de behandeling.
Cutane reacties: Dermatitis is de meest voorkomende reactie. Om het even welke eruptie, vooral als pruritic, die zich tijdens behandeling met Gouden Natriumthiomalate ontwikkelt zou als een reactie op goud moeten worden beschouwd tot het tegendeel wordt bewezen. Pruritus bestaat vaak voordat dermatitis zich manifesteert, en moet daarom worden beschouwd als een waarschuwingssignaal van een op handen zijnde cutane reactie. De ernstigste vorm van huidreactie is gegeneraliseerde exfoliatieve dermatitis die kan leiden tot alopecia en het afvallen van de nagels. Gold dermatitis kan verergeren door blootstelling aan zonlicht of er kan een actinische huiduitslag ontstaan.
Slijmvliesreacties: Stomatitis is de tweede meest voorkomende bijwerking. Ondiepe zweren op de mondslijmvliezen, op de tongranden, op het gehemelte of in de keelholte kunnen optreden als de enige bijwerking, of samen met dermatitis. Soms ontwikkelt zich diffuse glossitis of gingivitis. Een metaalsmaak kan aan deze orale slijmvliesreacties voorafgaan en moet als een waarschuwingssignaal worden beschouwd.
Conjunctivitis is een zeldzame reactie.
Renale reacties: Goud kan toxisch zijn voor de nieren en een nefrotisch syndroom of glomerulitis met hematurie veroorzaken. Deze nierreacties zijn gewoonlijk betrekkelijk mild en verdwijnen volledig als zij vroeg worden herkend en de behandeling wordt gestaakt. Zij kunnen echter ernstig en chronisch worden als de behandeling wordt voortgezet na het begin van de reactie. Daarom is het belangrijk om voor elke injectie een urineonderzoek uit te voeren en de behandeling onmiddellijk te staken als proteïnurie of hematurie ontstaat.
Hematologische reacties: Bloeddyscrasie als gevolg van goudtoxiciteit is zeldzaam, maar vanwege de mogelijke ernstige gevolgen moet er voortdurend op worden gelet en moet het vroegtijdig worden herkend door frequent bloedonderzoek gedurende de behandeling. Granulocytopenie; trombocytopenie, met of zonder purpura; hypoplastische en aplastische anemie; en eosinofilie zijn allemaal gerapporteerd. Deze hematologische aandoeningen kunnen afzonderlijk of in combinaties voorkomen.
Nitritoïde en allergische reacties: Er zijn reacties van het “nitritoïde type” gemeld die op anafylactoïde effecten kunnen lijken. Blozen, flauwvallen, duizeligheid en zweten worden het vaakst gemeld. Andere symptomen die kunnen optreden zijn: misselijkheid, braken, malaise, hoofdpijn en zwakte.
Extra ernstige, maar minder vaak voorkomende effecten zijn: anafylactische shock, syncope, bradycardie, verdikking van de tong, moeilijkheden bij slikken en ademhalen, en angioneurotisch oedeem. Deze effecten kunnen zich vrijwel onmiddellijk na de injectie voordoen of pas 10 minuten na de injectie. Zij kunnen op om het even welk ogenblik tijdens de cursus van therapie voorkomen en indien waargenomen, zou de behandeling met Gouden Natriumthiomalaat moeten worden stopgezet.
Diverse reacties: Gastro-intestinale reacties zijn gemeld, waaronder misselijkheid, braken, anorexie, buikkrampen en diarree. Ulceratieve enterocolitis, die ernstig of zelfs fataal kan zijn, is zelden gemeld.
Er zijn zeldzame meldingen geweest van reacties waarbij het oog betrokken was, zoals iritis, ulcera van het hoornvlies en goudafzettingen in oogweefsel. Perifere en centrale zenuwstelselcomplicaties zijn zelden gemeld. Perifere neuropathie, met of zonder, fasciculaties, sensorimotorische effecten (waaronder het syndroom van Guillain-Barré) en verhoogd eiwit in de ruggenmergvloeistof zijn gemeld. Complicaties van het centrale zenuwstelsel omvatten verwardheid, hallucinaties en toevallen. Meestal verdwenen deze tekenen en symptomen bij het staken van de goudtherapie.
Hepatitis, geelzucht, met of zonder cholestase, goudbronchitis, longschade gemanifesteerd door interstitiële pneumonitis en fibrose, gedeeltelijk of volledig haarverlies en koorts zijn ook gerapporteerd.
Soms komt artralgie voor gedurende een dag of twee na een injectie van Gouden Natriumthiomalaat; deze reactie verdwijnt gewoonlijk na de eerste paar injecties.
BEHEER VAN BIJWERKENDE REACTIES
Behandeling met Gouden Natriumthiomalaat zou onmiddellijk moeten worden stopgezet wanneer de toxische reacties voorkomen. Lichte complicaties zoals gelokaliseerde dermatitis, milde stomatitis, of lichte proteïnurie vereisen over het algemeen geen andere therapie en lossen spontaan op met opschorting van Gouden Natriumthiomalaat. Matig ernstige huid- en slijmvliesreacties hebben vaak baat bij lokale corticosteroïden, orale antihistaminica en verzachtende of verdovende lotions.
Als de stomatitis of dermatitis ernstig wordt of meer gegeneraliseerd is, kunnen systemische corticosteroïden (in het algemeen prednison 10 tot 40 mg per dag in verdeelde doses) symptomatische verlichting bieden.
Voor ernstige nier-, hematologische, pulmonale en enterocolitische complicaties worden hoge doses systemische corticosteroïden (prednison 40 tot 100 mg per dag in verdeelde doses) aanbevolen. De optimale duur van de behandeling met corticosteroïden varieert naar gelang van de reactie van de individuele patiënt. Bij ongewoon ernstige of progressieve bijwerkingen kan de behandeling vele maanden nodig zijn.
Bij patiënten bij wie de complicaties niet verbeteren met een behandeling met hoge doses corticosteroïden, of bij wie aanzienlijke steroïd-gerelateerde bijwerkingen optreden, kan een chelaatvormer worden gegeven om de uitscheiding van goud te verbeteren. Dimercaprol (BAL) is met succes gebruikt, maar de patiënten moeten zorgvuldig in het oog worden gehouden omdat het gebruik ervan gepaard kan gaan met talrijke ongewenste reacties. Corticosteroïden en een chelaatvormer kunnen gelijktijdig worden gebruikt.
Goudnatriumthiomalaat mag niet opnieuw worden toegediend na ernstige of idiosyncratische reacties.
Goudnatriumthiomalaat mag opnieuw worden toegediend na oplossing van milde reacties, met gebruikmaking van een verlaagd doseringsschema. Als een aanvankelijke testdosis van 5 mg Gouden Natriumthiomalaat goed wordt verdragen, kunnen progressief grotere doses (5 tot 10 mg verhogingen) met wekelijkse tot maandelijkse intervallen worden gegeven tot een dosis van 25 tot 50 mg wordt bereikt.
DOSAGE EN ADMINISTRATIE
Gouden Natriumthiomalaat zou slechts door intramusculaire injectie moeten worden toegediend, bij voorkeur intragluteaal. Het zou moeten worden gegeven terwijl de patiënt ligt. Hij zou liggend ongeveer 10 minuten na de injectie moeten blijven.
Therapeutische gevolgen van Gouden Natriumthiomalate komen langzaam voor. Vroege verbetering, vaak beperkt tot een vermindering van ochtendstijfheid, kan beginnen na zes tot acht weken behandeling, maar gunstige effecten kunnen pas worden waargenomen na maanden van therapie.
Parenterale geneesmiddelen moeten visueel worden geïnspecteerd op deeltjes en verkleuring voorafgaand aan de toediening. Niet gebruiken als het materiaal donkerder is geworden. De kleur mag niet meer dan lichtgeel zijn.
Voor volwassenen van gemiddelde grootte wordt het volgende doseringsschema voorgesteld:
Wekelijkse injecties:
1e injectie………………………………………………………………………………………….10 mg
2e injectie…………………………………………………………………………………………25 mg
3e en volgende injecties, 25 tot 50 mg totdat toxiciteit of aanzienlijke klinische verbetering optreedt, of, bij afwezigheid van een van beide, de cumulatieve dosis van goudnatriumthiomalaat één gram bereikt.
Goudnatriumthiomalaat wordt voortgezet totdat de cumulatieve dosis één gram bereikt, tenzij toxiciteit of aanzienlijke klinische verbetering optreedt. Indien aanzienlijke klinische verbetering optreedt voordat een cumulatieve dosis van één gram is toegediend, kan de dosis worden verlaagd of het interval tussen de injecties worden vergroot, zoals bij onderhoudstherapie. Onderhoudsdoses van 25 tot 50 mg om de week gedurende twee tot 20 weken worden aanbevolen. Als het klinische beloop stabiel blijft, kunnen injecties van 25 tot 50 mg om de drie weken en vervolgens om de vier weken voor onbepaalde tijd worden gegeven. Bij sommige patiënten kan een onderhoudsbehandeling met tussenpozen van één tot drie weken nodig zijn. Mocht de artritis tijdens de onderhoudstherapie verergeren, dan kunnen de wekelijkse injecties tijdelijk worden hervat totdat de ziekteactiviteit is onderdrukt.
Indien een patiënt tijdens de initiële therapie (cumulatieve dosis van één gram) geen verbetering vertoont, zijn er verschillende opties.
- de patiënt kan als niet reagerend worden beschouwd en het gebruik van goudnatriumthiomalaat wordt gestaakt.
- dezelfde dosis (25 tot 50 mg) goudnatriumthiomalaat kan gedurende ongeveer tien extra weken worden voortgezet.
- de dosis goudnatriumthiomalaat kan om de één tot vier weken worden verhoogd met stappen van 10 mg, tot een maximum van 100 mg per injectie.
Indien significante klinische verbetering optreedt bij gebruik van optie 2 of 3, moet het hierboven beschreven onderhoudsschema worden gestart. Als er geen significante verbetering optreedt of als toxiciteit optreedt, moet de behandeling met goudnatriumthiomalaat worden gestopt. Hoe hoger de individuele dosis van goudnatriumthiomalaat, hoe groter het risico op toxiciteit van het goud. De selectie van een van deze opties voor chrysotherapie moet worden gebaseerd op een aantal factoren, waaronder de ervaring van de arts met goudzouttherapie, het beloop van de aandoening van de patiënt, de keuze van alternatieve behandelingen, en de beschikbaarheid van de patiënt voor het vereiste nauwe toezicht.
Jeugdreumatoïde artritis
De pediatrische dosis van goudnatriumthiomalaat is evenredig met de dosis voor volwassenen op basis van gewicht. Na de initiële testdosis van 10 mg is de aanbevolen dosis voor kinderen één mg per kilo gram lichaamsgewicht, met een maximum van 50 mg voor een enkele injectie. Voor het overige gelden de hierboven gegeven richtlijnen voor toediening aan volwassenen ook voor kinderen.
Gelijktijdige geneesmiddelentherapie-Goudzouten dienen niet gelijktijdig met penicillamine te worden gebruikt.
De veiligheid van gelijktijdige toediening met cytotoxische geneesmiddelen is niet vastgesteld. Andere maatregelen, zoals salicylaten, andere niet-steroïde anti-inflammatoire geneesmiddelen, of systemische corticosteroïden, kunnen worden voortgezet wanneer met goudnatriumthiomalaat wordt begonnen. Nadat verbetering is opgetreden, kunnen de pijnstillende en ontstekingsremmende geneesmiddelen langzaam worden gestaakt als de symptomen dat toelaten.
HOW SUPPLIED
Myochrysine® Injection Goudnatriumthiomalaat is een lichtgele tot gele oplossing, afhankelijk van de potentie, die tegen licht moet worden beschermd. Het wordt als volgt geleverd:
NDC 17478-533-01 Gouden natriumthiomalaat , 50 mg per ml, 1 ml in 2 ml (gedeeltelijk gevulde) flacons in verpakkingen van 6.
NDC 17478-533-10 Gouden natriumthiomalaat, 50 mg per ml, flacons van 10 ml.
OPSLAG: Bewaren bij 20° tot 25°C (68° tot 77°F) . Beschermen tegen licht. Bewaar de verpakking in de doos totdat de inhoud is gebruikt.
Akorn
Gemaakt door: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Principal Display Panel Text for Container Label:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
10 ml Multiple dose Vial
Rx only Akorn logo
Mfg. door: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Principal Display Panel Text for Carton Label:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
Alleen voor intramusculaire injectie.
Niet intraveneus gebruiken.
10 ml Multiple
Dose Vial
Rx only

| Myochrysine gouden natriumthiomalaatinjectie |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiketteraar – Akorn, Inc. (062649876)
| Instelling | |||
| Naam | Adres | ID/FEI | Operaties |
| Akorn, Inc. | 155135783 | MANUFACTURE, ANALYSIS, PACK | |
Meer over Myochrysine (goudnatriumthiomalaat)
- Bijwerkingen
- Tijdens zwangerschap of borstvoeding
- Doseringsinformatie
- Gewrichtsinteracties
- 1 Overzicht
- Gedragsklasse: antireumatica
Gerelateerde behandelingsgidsen
- Rheumatoïde artritis
Medische disclaimer