Introduction
Prosta i wydajna synteza aktywnych biologicznie cząsteczek jest jednym z głównych celów chemii organicznej i medycznej. W ostatnich latach, reakcje wieloskładnikowe stały się jednym z ważnych narzędzi w syntezie zróżnicowanych strukturalnie bibliotek chemicznych leko-podobnych wielofunkcyjnych cząsteczek organicznych. Ponadto, MCR oferują przewagę prostoty i wydajności syntetycznej nad konwencjonalnymi reakcjami chemicznymi w kilku aspektach. MCR pozwalają na konstruowanie kombinatorycznych bibliotek złożonych cząsteczek organicznych dla efektywnej identyfikacji struktury wiodącej i optymalizacji w odkrywaniu leków.
W kontynuacji naszych bieżących prac badawczych nad syntezą nano materiałów wspomaganą mikrofalami odkryliśmy, że nanokrystaliczne tlenki metali przyciągnęły znaczną uwagę chemików syntetycznych i medycznych z powodu ich wysokiej aktywności katalitycznej i możliwości ponownego użycia. Tlenek cynku jest niedrogi, stabilny na wilgoć, wielokrotnego użytku, dostępny w handlu i jest nietoksyczny, nierozpuszczalny w polarnych, jak i niepolarnych rozpuszczalnikach. Szeroki zakres reakcji organicznych, które obejmują rearanżacje Beckmanna, N-benzylację, acylację, dehydratację oksymów, reakcje nukleofilowego otwarcia pierścienia epoksydów, syntezę cyklicznego mocznika, N-formylację amin. W szczególności krystaliczne nano-tlenek-ZnO wykazują lepszą aktywność katalityczną w porównaniu do ich luzem wielkości odpowiedników .
W ostatnich latach, wiele uwagi zostało skierowane na syntezę związków dihydropirydyny ze względu na ich ogromne zastosowanie w różnych dziedzinach badań, w tym nauki biologiczne i chemii medycznej. Wiele DHP jest już produktami komercyjnymi, takimi jak: amlodypina, felodypina, izradypina, lacydypina, nikardypina, nitrendypina, nifedypina i nimodypina B, z których nitrendypina i nemadypina B wykazują silne działanie blokujące kanały wapniowe (rysunek 1) i stały się jedną z najważniejszych klas leków w leczeniu chorób układu krążenia. Ponadto pochodne dihydropirydyny wykazują różnorodne działania biologiczne, takie jak: działanie geroprotekcyjne, hepatoprotekcyjne, przeciwmiażdżycowe, przeciwnowotworowe i przeciwcukrzycowe. Szeroko zakrojone badania ujawniły, że związki zawierające jednostki dihydropirydyny wykazują różne funkcje lecznicze, takie jak neuroprotekcja, aktywność antyagregacyjna płytek krwi, aktywność przeciw niedokrwienna mózgu w leczeniu choroby Alzheimera, chemosensybilizator w terapii nowotworów. Modyfikatory lekooporności , przeciwutleniacze i lek do leczenia nietrzymania moczu .
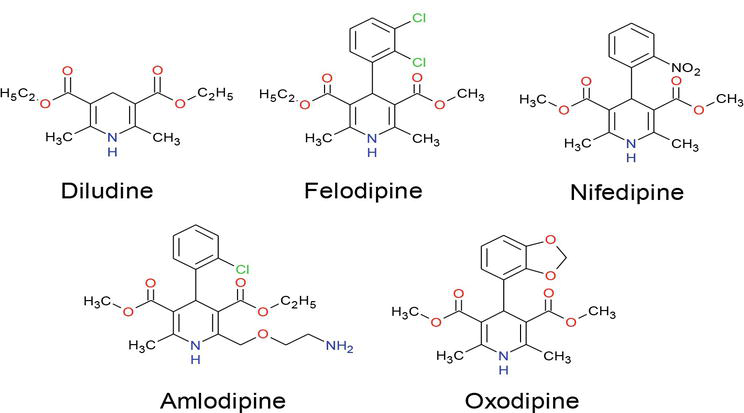
Rysunek 1.
Leki zawierające cząsteczki 1,4-DHP.
W celu zamodelowania i zrozumienia tych właściwości biologicznych oraz opracowania nowych środków chemioterapeutycznych opartych na związkach 1,4-DHP, podjęto znaczne wysiłki w celu ustalenia skutecznych metod ich syntezy. Generalnie, 1,4-DHP były syntetyzowane metodą Hantzscha, która obejmuje cyklokondensację aldehydu, β-ketoestru i amoniaku w kwasie octowym lub pod chłodnicą zwrotną w alkoholach przez długi czas reakcji, co zwykle prowadzi do niskiej wydajności. Inne metody obejmują stosowanie mikrofal, wysokich temperatur przy zwrotnym odpływie, organokatalizatorów i triflatów metali .
Ostatnio DNA jest ważnym celem leków i reguluje wiele procesów biochemicznych, które występują w systemie komórkowym. Interakcje małych cząsteczek z DNA są nadal intensywnie i szeroko badane pod kątem ich przydatności jako sond replikacji komórkowej i regulacji transkrypcji oraz pod kątem ich potencjału jako farmaceutyków. W szczególności, projektowanie związków w oparciu o ich zdolność do rozszczepiania DNA ma ogromne znaczenie nie tylko z pierwotnego biologicznego punktu widzenia, ale także w kontekście fotodynamicznego podejścia terapeutycznego w celu opracowania silnych leków. Pochodne 1,4-dihydropirydyny przyciągnęły uwagę chemików ze względu na ich różnorodne zastosowania biologiczne. Biologiczne znaczenie tej klasy związków skłoniło nas do rozszerzenia tej serii o syntezę i badania fotookleszczania DNA przez pochodne 1,4-dihydropirydyny. W niniejszym komunikacie opisano syntezę pochodnych 1,4-dihydropirydyny oraz badania ich fotookleavage’u DNA i dokowania molekularnego.
W literaturze znanych jest kilka metod syntezy pochodnych 1,4-dihydropirydyny. W ramach kontynuacji naszego programu dotyczącego chemii nanomateriałów, w niniejszej pracy przedstawiamy wydajną mikrofalową metodę syntezy krystalicznych ZnO-NPs. Użyty w tej pracy ZnO został zsyntetyzowany według zmodyfikowanej metody. Przygotowane krystaliczne nanocząstki ZnO zostały scharakteryzowane za pomocą proszkowego XRD, SEM, EDX (rysunek 2). Syntezę rozpoczęto od kondensacji 1 equiv. benzaldehydu 1a z 2 equiv. acetooctanu etylu 2a i 2 equiv. NH4OAc 3a w obecności ZnO-Nps, w wyniku czego powstała 1,4-dihydropirydyna Hantzscha 4a (Rysunek 3). Reakcja została zakończona w ciągu 5 min pod wpływem promieniowania mikrofalowego, a produkt został wyizolowany w typowy sposób, z wydajnością 90% i wysoką czystością. W podobnych warunkach różne podstawione aldehydy aromatyczne z podstawnikami elektronodonującymi lub odbierającymi elektrony reagowały z 1,3-diketonami tworząc 1,4-DHP z wydajnością dobrą do doskonałej, a wyniki zestawiono w Tabeli 1.
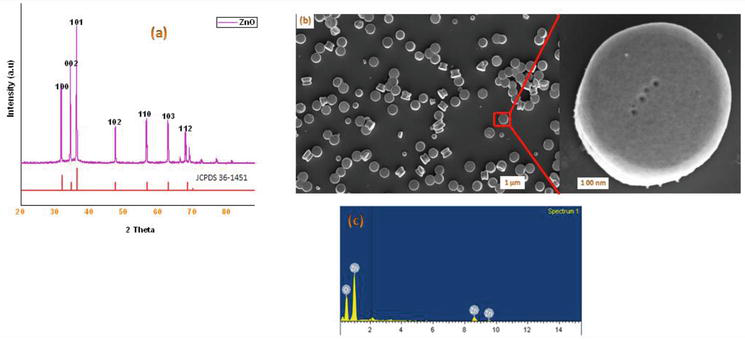
Rysunek 2.
(a) XRD proszku otrzymanych nanocząstek ZnO metodą mikrofalową; (b) obrazy SEM ZnO-NPs; (c) widmo analizy EDX otrzymanych nanocząstek ZnO metodą mikrofalową.
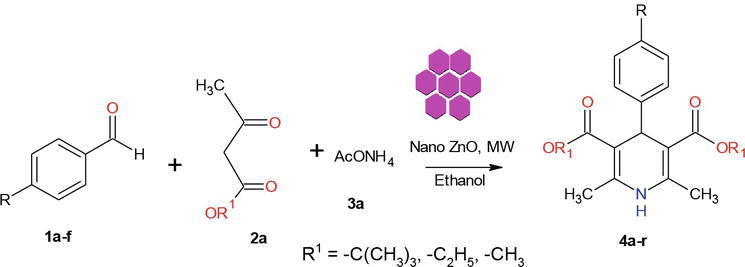
Rysunek 3.
Synteza 1,4-dihydropirydyn.
| Entrya | R | R1 | Produkty | Entrya | Plon (%)b |
|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 |
| 2 | 4-MeO-.C6H5 | t-Bu | 4b | 2 | 95 |
| 3 | 4-.OH-C6H5 | t-Bu | 4c | 3 | 95 |
| 4 | 4-F-.C6H5 | t-Bu | 4d | 4 | 95 |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 |
| 7 | C6H5 | Et | 4 g | 7 | 90 |
| 8 | 4-.MeO-C6H5 | Et | 4 h | 8 | 95 |
| 9 | 4-OH-.C6H5 | Et | 4i | 9 | 92 |
| 10 | 4-H-.F-C6H5 | Et | 4j | 10 | 92 |
| 11 | 4-Cl-C6H5 | Et | 4 k | 11 | 90 |
| 12 | 4-NO2-C6H5 | Et | 4 l | 12 | 90 |
| 13 | C6H5 | Me | 4 m | 13 | 90 |
| 14 | 4-MeO-C6H5 | Me | 4n | 14 | 87 |
| 15 | 4-OH-.C6H5 | Me | 4o | 15 | 90 |
| 16 | 4-H-.F-C6H5 | Me | 4p | 16 | 90 |
| 17 | 4-Cl-C6H5 | Me | 4q | 17 | 90 |
| 18 | 4-NO2-.C6H5 | Me | 4r | 18 | 90 |
Tabela 1.
Synteza 1,4-dihydropirydyn.
aWszystkie produkty scharakteryzowano za pomocą badań 1H NMR i 13C NMR i porównano z literaturowymi mps. bPlony wyizolowanych produktów
Proces wspomagany promieniowaniem mikrofalowym bardzo często minimalizuje powstawanie produktów ubocznych i wymaga znacznie krótszego czasu niż metody termiczne. Główną zaletą prowadzenia reakcji w kontrolowanych warunkach, w szczelnie zamkniętych naczyniach, jest znaczne zwiększenie szybkości reakcji oraz wyższe wydajności produktów, które często można uzyskać. Dlatego też, kontynuując nasze badania nad mikrofalową syntezą nanomateriałów, podjęliśmy próbę opracowania szybkiego, wspomaganego mikrofalami protokołu syntezy 1,4-DHPs z wykorzystaniem krystalicznego ZnO-nano-katalizatora (Rysunek 3).
Rozszczepianie DNA pochodnych 1,4-DHP badano metodą elektroforezy w żelu agarozowym. Gdy kolisty plazmidowy DNA poddawano elektroforezie, stosunkowo szybką migrację obserwowano dla nienaruszonego, superzwiniętego DNA (typ I). Jeśli rozszczepienie nastąpi na jednej nici (nicking), superzwinięty DNA rozluźni się, generując wolniej poruszającą się otwartą formę kolistą (typ II). Jeśli rozszczepieniu ulegną obie nici, powstanie forma liniowa (typ III), która migruje pomiędzy typem I i typem II. Konwersję typu I (supercoiled) do typu II (nicked circular) obserwowano przy różnym stężeniu 1,4-DHP i naświetlaniu przez 2 h, w 1:9 DMSO/trisbuffer (20 μM, pH- 7,2) przy długości fali 365 nm. Nie obserwowano rozszczepienia DNA w przypadku kontroli, w której 1,4-DHP był nieobecny (pas 1) (rysunek 4). Wraz ze wzrostem stężenia 1,4-DHP ilość DNA typu I w pUC 19 stopniowo malała, podczas gdy typ II wzrastał (Rysunek 4).
W stężeniu 40 μM związek (4c) może promować tylko 30% konwersji DNA z typu I do II (Rysunek 5). W stężeniu 80 μM, związek (4c) może prawie promować około 80% konwersji DNA z typu I do II (Rysunek 5). Potencjał rozszczepiający badanych związków oceniano porównując prążki pojawiające się w kontroli i związkach badanych w stężeniu 80 μM. Pozostałe pochodne wykazują jednak znacznie niższą wydajność rozszczepiania DNA pUC 19. Nawet w stężeniu 80 μM może promować tylko 40% konwersji DNA z typu I do II (Rysunek 5).
Ale w wyższych stężeniach około 130 μM, związki ulegają wytrąceniu i nie ma momentu w DNA. Obraz (Rysunek 6) wyraźnie wskazuje, że związki (4b, 4c, 4d, 4e, 4f i 4 g) wykazują rozszczepienie DNA pUC19 DNA w stężeniu 80 μM. Wyniki wskazują, że związki posiadające -OCH3 i -OH w pozycji -para pierścienia fenylowego (C-6) rozszczepiały DNA całkowicie, pozostałe związki wykazywały prawie całkowite rozszczepienie DNA. Ogólnie rzecz biorąc, wskazuje to, że grupy alkoksylowe są wysoce reaktywnymi rodnikami, które wydajnie abstrahują atomy wodoru przy C-4′ 2-deoksyrybozy. It is of interest to note that hydroxyl group has been reported to bring about oxygen radical mediated DNA damage in the presence of photoirradiation .
The structure-activity relationship studies of 1,4-DHPs with regard to DNA photocleavage studies shows that, the changes in the substitution pattern at C-3, C-4, and C-5 positions alter the 1,4-DHP ring. Osiris Property Explorer jest jednym z takich opartych na wiedzy narzędzi przewidywania aktywności, które przewiduje prawdopodobieństwo leku, wynik leku i niepożądane właściwości, takie jak mutagenne, nowotworowe, drażniące i reprodukcyjne działanie nowych związków w oparciu o dane fragmentów chemicznych dostępnych leków i nieleków, jak zgłoszono (Tabela 2) . Zaobserwowano, że związki posiadające grupy alifatyczne, takie jak -CH3, -COOCH3, -COOC2H5 i -COOC(CH3)3, przyłączone do C-2 i C-3 1,4-DHP wykazywały dobrą aktywność. Inne pochodne posiadające na pierścieniu fenylowym (C-6) podstawnik elektronodonorowy, np. grupę hydroksy- i metoksy, zwiększają aktywność fotookleszczania DNA. Samotna para elektronów na atomie tlenu grupy metoksylowej delokalizuje się do przestrzeni π pierścienia benzenowego, zwiększając w ten sposób aktywność. Podobnie, podstawniki odbierające elektrony, takie jak 4-fluorofenyl, 4-chloro-fenyl 1,4-DHP obniżają aktywność. Wyniki te wskazują, że za rozszczepianie DNA odpowiedzialne są podstawniki alkoksylowe oraz azot pierścienia pirydynowego w strukturze 1,4-DHP.
W celu zracjonalizowania zaobserwowanych wyników spektroskopowych oraz uzyskania lepszego wglądu w sposób interkalacji, 1,4-DHP (4a-r) zostały kolejno zadokowane w obrębie dupleksu DNA o sekwencji d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA) w celu przewidzenia wybranego miejsca wiązania wraz z preferowaną orientacją liganda wewnątrz drobnego rowka DNA. Wszystkie zsyntetyzowane pochodne 1,4-DHP zostały narysowane w programie ChemSketch, a struktury zapisane w formacie .mol. Następnie format .mol został użyty w programie Hyperchem-7, w celu dopasowania ich fragmentów, po czym nastąpiła całkowita minimalizacja energii ligandów, tak aby mogły one osiągnąć stabilną konformację, a plik został zapisany w formacie .pdb.
Białkowa struktura 3D B-DNA została uzyskana z RCSB PDB (portal informacyjny do biologicznych struktur wielkocząsteczkowych). Cząsteczki wody zostały usunięte z pliku, a białko zostało protonowane w 3D w celu dodania polarnych wodorów. Kieszeń wiążąca została zidentyfikowana przy użyciu programu site finder, a następnie wybrano odpowiednie reszty. Parametry dokowania zostały ustawione na wartości domyślne i algorytm scoringowy, a przebieg dokowania został zachowany do 30 konformacji na ligand. Dokowane struktury białkowe zapisywano w formacie .pdb, a następnie badano kolejno konformacje ligandów. Kompleksy z najlepszymi konformacjami zostały wybrane na podstawie najwyższego wyniku, najniższej energii wiązania i minimalnych wartości RMSD.
Zsyntetyzowane związki organiczne wykonują swoją aktywność biologiczną bardziej efektywnie poprzez wiązanie odpowiednich białek lub DNA w ich specyficznych miejscach wiążących. Identyfikacja oddziałujących reszt z ligandami jest niezbędnym krokiem w kierunku racjonalnego projektowania leków, zrozumienia szlaku molekularnego i mechanizmu działania białek.
Dokowanie molekularne przeprowadzono pomiędzy sztywnym białkiem receptorowym a elastycznymi ligandami. W tabeli 3 przedstawiono szczegółowe wyniki dokowania, w tym wartości RMSD i energii wiązania kompleksów białko-ligand. Ligandy (4b, 4c, 4 h, 4i, 4n i 4o) silnie wiążą się z B-DNA, o czym świadczą ich minimalne wartości energii wiązania, wynoszące odpowiednio -13,8, -12,9 i – 12,3 kcal/mol (Rysunek 7).
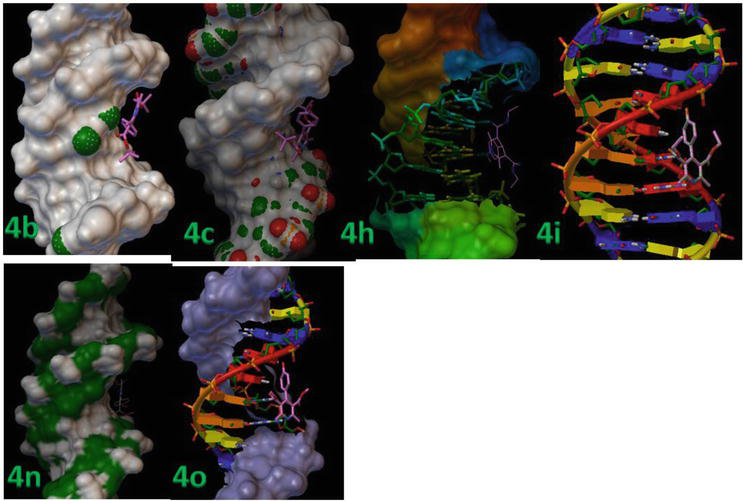
Rysunek 7.
1,4-DHP był sukcesywnie dokowany w obrębie dupleksu DNA o sekwencji d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA).
Rysunek 8 przedstawia położenie miejsca aktywnego w strukturze helikalnej DNA oraz pokazuje, że wszystkie dokowane ligandy grupują się wewnątrz kieszeni. Rysunek 8 przedstawia oddziaływanie wiązania wodorowego związków 4c i 4d z kluczowymi resztami w miejscu aktywnym wewnątrz struktury helikalnej DNA. W modelu tym wyraźnie widać, że związek 4c tworzył wiązanie wodorowe pomiędzy -OH i N1 tyminy, czyli DT7 i DT19 o długości wiązania odpowiednio 2,02 i 2,05 Ǻ. Ponadto, pozostałe pochodne 1,4-DHP tworzyły mniej oddziaływań wiązaniami H z DNA ze względu na orientację pierścienia aromatycznego zaangażowanego w oddziaływania van der Waalsa (model Wireframe) oraz płaskie hydrofobowe regiony miejsc wiążących DNA (Tabela 3). Wyniki te wykazały, że badania dockingu molekularnego in silico 1,4-DHPs z B-DNA sugerują, że 1,4-DHPs posiadają potencjał do zakłócania oddziaływań hydrofobowych i wiązań H, wpływając tym samym na stabilność wiązania B-DNA, i mogą być skuteczne w przypadku nowotworowych linii komórkowych.
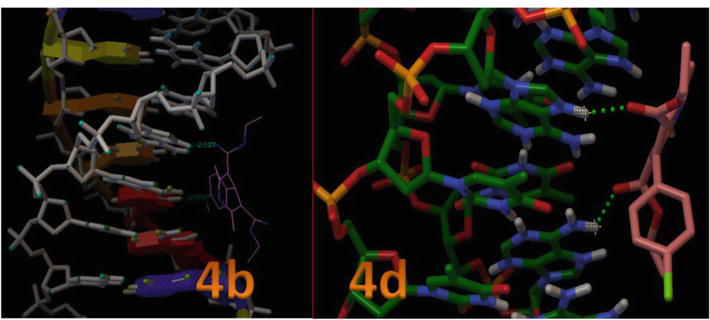
Rysunek 8.
Interakcja 1,4-DHP z dupleksem DNA o sekwencji d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA).
.