Nome genérico: thiomalato de sódio dourado
Forma de dosagem: injeção
Revisado medicamente por Drugs.com. Última atualização em 23 de março de 2020.
- Efeitos colaterais
- Dosagem
- Profissional
- Interações
- Pregnância
- >Mais
Disclaimer: Este medicamento não foi considerado seguro e eficaz pela FDA, e esta rotulagem não foi aprovada pela FDA. Para mais informações sobre drogas não aprovadas, clique aqui.
Rx apenas
Físicos que planejam usar Tiomalato de Sódio Dourado devem se familiarizar completamente com sua toxicidade e seus benefícios. A possibilidade de reacções tóxicas deve ser sempre explicada ao paciente antes de iniciar a terapia. Os pacientes devem ser avisados para relatar prontamente quaisquer sintomas que sugiram toxicidade. Antes de cada injeção de Tiomalato de Ouro Sódico, o médico deve rever os resultados do trabalho de laboratório, e ver o paciente para determinar a presença ou ausência de reações adversas, já que algumas delas podem ser graves ou mesmo fatais.
- DESCRIÇÃO
- FARMACOLOGIA CLÍNICA
- INDICAÇÕES E USO
- CONTRAINDICAÇÕES
- AVISO
- PRECAUÇÕES :
- Geral
- Carcinogenicidade
- Gravidez
- Mães amamentadoras
- Reações adversas
- Gerenciamento de reações adversas
- DOSAGEM E ADMINISTRAÇÃO
- Artrose Reumatóide Juvenil
- COMO FORNECIDO
- Mais sobre Myochrysine (tiomalato de sódio dourado)
- Guias de tratamento relacionadas
DESCRIÇÃO
Myochrysine® Gold Sodium Thiomalate é uma solução aquosa estéril. Contém 0,5% de álcool BENZYL adicionado como conservante. O pH do produto é de 5,8 t o 6,5,
Tiomalato de Sódio Dourado é uma mistura dos sais mono e di-sódico do ácido tiomálico dourado. A fórmula estrutural é:
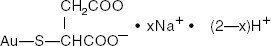
ácido mercaptobutanodióico, sal monogold (1 +) de sódio
O peso molecular de C4H3AuNa2O4S (o sal dissódico) é 390,07 e de C4H4AuNaO4S (o sal mono-sódico) é 368.09.
Tiomalato de Sódio Dourado é fornecido como uma solução para injeção intramuscular contendo 50 mg de Tiomalato de Sódio Dourado por mL.
FARMACOLOGIA CLÍNICA
O modo de ação do Tiomalato de Sódio Dourado é desconhecido. A ação predominante parece ser um efeito supressor na sinovite da doença reumatóide ativa.
INDICAÇÕES E USO
Tiomalato de Sódio Dourado é indicado no tratamento de casos selecionados de artrite reumatóide ativa – tanto do tipo adulto como juvenil. O maior benefício ocorre na fase ativa precoce. Em estágios tardios da doença, quando a cartilagem e danos ósseos ocorreram, o ouro só pode verificar a progressão da artrite reumatóide e prevenir danos estruturais adicionais nas articulações. Ele não pode reparar danos causados por doença anteriormente ativa.
Tiomalato de sódio dourado deve ser usado apenas como parte de um programa completo de terapia; sozinho não é um tratamento completo.
CONTRAINDICAÇÕES
Hipersensibilidade a qualquer componente deste produto.
Toxicidade severa resultante da exposição anterior ao ouro ou outros metais pesados.
Severe debilitação.
Lupus eritematoso sistêmico.
AVISO
Antes de iniciar o tratamento, deve-se determinar a hemoglobina, eritrócitos, glóbulos brancos, diferencial e contagem de plaquetas do paciente, devendo ser feita uma análise urinária para servir como referência básica. A urina deve ser analisada quanto a mudanças de proteínas e sedimentos antes de cada injeção. A contagem completa de glóbulos brancos, incluindo a estimativa de plaquetas, deve ser feita antes de cada segunda injecção ao longo do tratamento. A ocorrência de púrpura ou equimoses a qualquer momento sempre requer uma contagem de plaquetas.
Sinais de perigo de possível toxicidade em ouro incluem: redução rápida de hemoglobina, leucopenia abaixo de 4000 leucócitos/mm3, eosinofilia acima de 5%, diminuição de plaquetas abaixo de 100.000/mm3, albuminúria, hematúria, prurido, erupção cutânea, estomatite, ou diarréia persistente. Não devem ser dadas injeções adicionais de Tiomalato de Sódio Dourado a menos que estudos adicionais mostrem que estas anormalidades sejam causadas por outras condições que não a toxicidade do ouro.
PRECAUÇÕES :
Geral
Sais de ouro não devem ser usados concomitantemente com penicilamina.
A segurança da coadministração com drogas citotóxicas não foi estabelecida.
A prudência está indicada no uso de tiomalato de sódio dourado em pacientes com o seguinte:
- uma história de discrasias sanguíneas como granulocitopenia ou anemia causada por sensibilidade a drogas,
- alergia ou hipersensibilidade a medicamentos,
- erupção cutânea,
- doença hepática ou renal prévia,
- hipertensão marcada,
- circulação cerebral ou cardiovascular comprometida.
Diabetes mellitus ou insuficiência cardíaca congestiva devem estar sob controle antes que a terapia com ouro seja instituída,
Carcinogenicidade
Adenomas renais têm sido relatados em estudos de toxicidade a longo prazo de ratos que recebem tiomalato de sódio dourado em níveis de dose elevados (2 mg/kg semanalmente por 45 semanas, seguido de 6mg/kg diariamente por 47 semanas), aproximadamente 2 a 42 vezes a dose humana habitual. Estes adenomas são histologicamente similares aos produzidos em ratos pela administração crônica de compostos de ouro experimental e outros metais pesados, como o chumbo. Não foram recebidos relatos de adenomas renais no homem em associação com o uso de tiomalato de sódio dourado.
Gravidez
Gravidez Categoria C.
Tiomalato de sódio dourado demonstrou ser teratogênico durante o período organogênico em ratos e coelhos quando administrado em doses, respectivamente, de 140 e 175 vezes a dose humana habitual. Hidrocefalia e microftalmia foram as malformações observadas em ratos quando o tiomalato de sódio dourado foi administrado por via subcutânea na dose de 25 mg/kg/dia do 6º ao 15º dia de gestação. Em coelhos, as malformações de membros e a gastrosquise foram as malformações observadas quando o tiomalato de sódio ouro foi administrado subcutaneamente na dose de 20 – 45 mg/kg/dia do 6º ao 18º dia de gestação.
Não há estudos adequados e bem controlados em gestantes. O tiomalato de sódio dourado só deve ser usado durante a gravidez se o benefício potencial para a mãe justificar o risco potencial para o feto.
Mães amamentadoras
A presença de ouro tem sido demonstrada no leite das mães lactantes. Além disso, ouro foi encontrado no soro e nos glóbulos vermelhos de um bebê lactante. Em vista dos achados acima e devido ao potencial de sérias reações adversas em lactentes amamentando de Tiomalato de Sódio de Ouro, deve ser tomada a decisão de interromper a amamentação ou não, levando em consideração a importância do medicamento para a mãe. A lenta excreção e persistência do ouro na mãe, mesmo após a interrupção do tratamento, também deve ser lembrada.
Reações adversas
Uma variedade de reações adversas pode se desenvolver durante a fase inicial (injeções semanais) do tratamento ou durante o tratamento de manutenção. Reações adversas são observadas mais freqüentemente quando a dose cumulativa de tiomalato de sódio dourado administrado está entre 400 e 800 mg. Muito incomum, complicações ocorrem dias a meses após a interrupção do tratamento.
Reacções cutâneas: A dermatite é a reacção mais comum. Qualquer erupção, especialmente se pruriginosa, que se desenvolve durante o tratamento com Tiomalato de Sódio Dourado deve ser considerada uma reação ao ouro até prova em contrário. O prurido existe frequentemente antes da dermatite se tornar aparente, e portanto deve ser considerado um sinal de aviso de reação cutânea iminente. A forma mais grave de reação cutânea é a dermatite esfoliativa generalizada que pode levar à alopecia e descamação das unhas. A dermatite dourada pode ser agravada pela exposição à luz solar ou pode desenvolver uma erupção actínica.
Reacções de membrana mucosa: A estomatite é a segunda reacção adversa mais comum. Úlceras superficiais nas membranas vestibulares, nas bordas da língua e no palato ou na faringe podem ocorrer como única reação adversa, ou junto com dermatites. Por vezes desenvolve-se uma glossite difusa ou gengivite. Um sabor metálico pode preceder estas reacções da mucosa oral e deve ser considerado um sinal de aviso.
Conjuntivite é uma reacção rara.
Reacções renais: O ouro pode ser tóxico para o rim e produzir uma síndrome nefrótica ou glomerulite com hematúria. Essas reações renais são geralmente relativamente leves e diminuem completamente se reconhecidas precocemente e o tratamento é descontinuado. Elas podem ser graves e crônicas se o tratamento for continuado após o início da reação. Portanto, é importante realizar uma urinálise antes de cada injeção, e descontinuar o tratamento prontamente se desenvolver proteinúria ou hematúria.
Reações hematológicas: A discrasia sanguínea devido à toxicidade do ouro é rara, mas devido às potenciais consequências graves deve ser constantemente vigiada e reconhecida precocemente através de exames de sangue frequentes feitos durante todo o tratamento. Granulocitopenia; trombocitopenia, com ou sem púrpura; anemia hipoplásica e aplástica; e eosinofilia têm sido relatadas. Estas desordens hematológicas podem ocorrer separadamente ou em combinações.
Reações aitritoides e alérgicas: Reações do tipo “nitritoide” que podem assemelhar-se a efeitos anafilactóides foram relatadas. A ruborização, desmaios, tonturas e sudorese são os mais frequentemente relatados. Outros sintomas que podem ocorrer incluem: náuseas, vómitos, mal-estar, dores de cabeça e fraqueza.
Efeitos mais graves, mas menos comuns incluem: choque anafilático, síncope, bradicardia, espessamento da língua, dificuldade em engolir e respirar, e edema angioneurotico. Estes efeitos podem ocorrer quase imediatamente após a injeção ou tão tarde quanto 10 minutos após a injeção. Eles podem ocorrer a qualquer momento durante o curso da terapia e se observado, o tratamento com tiomalato de sódio dourado deve ser interrompido.
Reações diversas: Foram relatadas reacções gastrointestinais, incluindo náuseas, vómitos, anorexia, cãibras abdominais e diarreia. Enterocolite ulcerosa, que pode ser grave ou mesmo fatal, tem sido relatada raramente.
Existem relatos raros de reações envolvendo o olho, como irite, úlceras da córnea e depósitos de ouro nos tecidos oculares. Complicações periféricas e do sistema nervoso central têm sido relatadas raramente. Neuropatia periférica, com ou sem, fasciculações, efeitos sensorimotores (incluindo síndrome de Guillain-Barré) e proteína do líquido espinhal elevada têm sido relatados. As complicações do sistema nervoso central incluíram confusão, alucinações e convulsões. Geralmente estes sinais e sintomas foram eliminados com a interrupção da terapia com ouro.
Hepatite, icterícia, com ou sem colestase, bronquite dourada, lesão pulmonar manifestada por pneumonia intersticial e fibrose, queda parcial ou completa de cabelo e febre também foram relatados.
Artalgumas vezes ocorre artralgia durante um ou dois dias após uma injeção de tiomalato de sódio dourado; esta reação geralmente diminui após as primeiras injeções.
Gerenciamento de reações adversas
O tratamento com tiomalato de sódio dourado deve ser interrompido imediatamente quando ocorrem reações tóxicas. Pequenas complicações como dermatite localizada, estomatite leve ou proteinúria leve geralmente não requerem outra terapia e resolvem espontaneamente com suspensão de Tiomalato de Sódio Dourado. Reações moderadamente severas da pele e mucosa freqüentemente se beneficiam de corticosteróides tópicos, anti-histamínicos orais, e loções calmantes ou anestésicas.
Se a estomatite ou dermatite se tornar severa ou mais generalizada, corticosteróides sistêmicos (geralmente, prednisona 10 a 40 mg diários em doses divididas) podem fornecer alívio sintomático.
Para complicações renais, hematológicas, pulmonares e enterocolíticas graves, doses elevadas de corticosteróides sistêmicos (prednisona 40 a 100 mg diários em doses divididas) são recomendadas. A duração ótima do tratamento com corticosteroides varia com a resposta do paciente individual. A terapia pode ser necessária por muitos meses quando os efeitos adversos são excepcionalmente graves ou progressivos.
Em pacientes cujas complicações não melhoram com o tratamento com altas doses de corticosteróides, ou que desenvolvem reações adversas significativas relacionadas aos esteróides, um agente quelante pode ser administrado para melhorar a excreção de ouro. Dimercaprol (BAL) tem sido usado com sucesso, mas os pacientes devem ser monitorados cuidadosamente, uma vez que numerosas reações adversas podem estar presentes em seu uso. Corticosteróides e um agente quelante podem ser usados concomitantemente.
Tiomalato de Sódio Dourado não deve ser reinstituído após reações graves ou idiossincráticas.
Tiomalato de Sódio Dourado pode ser readministrado após a resolução de reações leves, usando um horário de dosagem reduzido. Se uma dose inicial de teste de 5 mg de tiomalato de sódio dourado for bem tolerada, doses progressivamente maiores (incrementos de 5 a 10 mg) podem ser administradas em intervalos semanais a mensais até atingir uma dose de 25 a 50 mg.
DOSAGEM E ADMINISTRAÇÃO
Tiomalato de sódio dourado deve ser administrado apenas por injeção intramuscular, de preferência intraglútea. Deve ser administrado com o paciente deitado. Ele deve permanecer em repouso por aproximadamente 10 minutos após a injeção.
Os efeitos terapêuticos do Tiomalato de Sódio Dourado ocorrem lentamente. A melhora precoce, muitas vezes limitada a uma redução da rigidez matinal, pode começar após seis a oito semanas de tratamento, mas os efeitos benéficos podem não ser observados até após meses de terapia.
Os medicamentos parentéricos devem ser inspecionados visualmente para a presença de partículas e descoloração antes da administração. Não usar se o material tiver escurecido. A cor não deve exceder o amarelo pálido.
Para o adulto de tamanho médio sugere-se a seguinte programação de dosagem:
Injeções semanais:
1ª injeção………………………………………………………………………………………….10 mg
2ª injeção………………………………………………………………………………………… 25 mg
3ª e subseqüentes injeções, 25 a 50 mg até que haja toxicidade ou melhora clínica importante, ou, na ausência de qualquer uma destas, a dose cumulativa de tiomalato de sódio dourado atinge um grama.
Tiomalato de sódio dourado é continuado até que a dose cumulativa atinja um grama, a menos que ocorra toxicidade ou melhora clínica importante. Se ocorrer uma melhora clínica significativa antes de uma dose cumulativa de um grama ter sido administrada, a dose pode ser diminuída ou o intervalo entre as injeções aumentado, como na terapia de manutenção. São recomendadas doses de manutenção de 25 a 50 mg a cada duas semanas durante duas a 20 semanas. Se a evolução clínica permanecer estável, podem ser administradas injeções de 25 a 50 mg a cada três e posteriormente a cada quarta semana, indefinidamente. Alguns pacientes podem necessitar de tratamento de manutenção em intervalos de uma a três semanas. Se a artrite exacerbar durante a terapia de manutenção, as injeções semanais podem ser retomadas temporariamente até que a atividade da doença seja suprimida.
Se um paciente não melhorar durante a terapia inicial (dose cumulativa de um grama), várias opções estão disponíveis.
- o paciente pode ser considerado como não responsivo e o tiomalato de sódio dourado é descontinuado.
- a mesma dose (25 a 50 mg) de tiomalato de sódio dourado pode ser continuada por aproximadamente dez semanas adicionais.
- a dose de tiomalato de sódio dourado pode ser aumentada em incrementos de 10 mg a cada uma a quatro semanas, não excedendo 100 mg em uma única injeção.
Se ocorrer melhora clínica significativa usando a opção 2 ou 3, o cronograma de manutenção descrito acima deve ser iniciado. Se não houver melhora significativa ou se ocorrer toxicidade, a terapia com tiomalato de sódio dourado deve ser interrompida. Quanto maior a dose individual de Tiomalato de Sódio Dourado, maior o risco de toxicidade do ouro. A seleção de uma dessas opções para crisoterapia deve ser baseada em uma série de fatores, incluindo a experiência do médico com a terapia com sal de ouro, o curso da condição do paciente, a escolha de tratamentos alternativos, e a disponibilidade do paciente para a supervisão próxima necessária.
Artrose Reumatóide Juvenil
A dose pediátrica de tiomalato de sódio ouro é proporcional à dose para adultos com base no peso. Após a dose inicial de teste de 10 mg, a dose recomendada para crianças é de 1 mg por quilo de peso corporal, não devendo exceder 50 mg para uma única injeção. Caso contrário, as orientações dadas acima para a administração a adultos também se aplicam a crianças.
Terapia com Drogas Concomitantes-Sais de ouro não devem ser usados concomitantemente com penicilamina.
A segurança da coadministração com drogas citotóxicas ainda não foi estabelecida. Outras medidas, tais como salicilatos, outros anti-inflamatórios não esteróides, ou corticosteróides sistêmicos, podem ser continuadas quando o tiomalato de sódio dourado for iniciado. Após o início da melhora, analgésicos e antiinflamatórios podem ser descontinuados lentamente, conforme os sintomas permitam.
COMO FORNECIDO
Mioochrysine® Injection Gold Sodium Thiomalate é uma solução amarela clara a amarela, dependendo da potência, que deve ser protegida da luz. É fornecido da seguinte forma:
NDC 17478-533-01 Thiomalato de Sódio Dourado , 50 mg por mL, 1 mL em 2 mL (parcialmente cheio) frascos em embalagens de 6.
NDC 17478-533-10 Thiomalato de Sódio Dourado , 50 mg por mL, frascos de 10 mL.
STORAGEM: Armazenar a 20° a 25°C (68° a 77°F) . Proteger da luz. Armazenar o recipiente em caixa até que o conteúdo tenha sido utilizado.
Akorn
Fabricado por: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Painel de exibição de texto para etiqueta de contentor:
>
NDC 17478-533-10
>
Mioochrysine
>
Tiomalato de Sódio Dourado
Injeção, USP
50 mg/mL
10 mL Frasco dose múltipla
>
Rx somente logotipo Akorn
>
Mfg. por: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08
>
 >
>Painel de exibição de texto para etiqueta de cartão:
NDC 17478-533-10
>
Myochrysine
>
Tiomalato de sódio dourado
Injeção, USP
50 mg/mL
>
Só para injeção intramuscular.
Não usar por via intravenosa.
10 mL Múltiplos
Frasco de dose
Apenas Rx

| Myochrysine Injeção de tiomalato de sódio dourado |
|||||||||||||||||||
|
|||||||||||||||||||
> > |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
| Informação de marketing |
Categoria de marketing |
Citação do Número de Aplicação ou Monografia |
Data de Início da Comercialização |
Data de Fim da Comercialização |
Não Aprovado droga outra |
| 04/22/2010 |
| |
||||||||||
Rotuladora – Akorn, Inc. (062649876)
| Estabelecimento | |||
| Nome | Endereço | ID/FEI | Operações |
| Akorn, Inc. | > | 155135783 | MANUFATURA, ANÁLISE, PACOTE |
>
Mais sobre Myochrysine (tiomalato de sódio dourado)
- Efeitos secundários
- Durante a gravidez ou amamentação
- Informações sobre a dosagem
- Interacções com o Dragão
- 1 Revisão
- Classe do Dragão: antirreumáticos
Guias de tratamento relacionadas
- Artrose Reumatóide
Relatação médica