Generischer Name: Gold-Natriumthiomalat
Dosierungsform: Injektion
Medically reviewed by Drugs.com. Zuletzt aktualisiert am 23. März 2020.
- Nebenwirkungen
- Dosierung
- Behandlung
- Interaktionen
- Schwangerschaft
- Mehr
Haftungsausschluss: Dieses Medikament wurde von der FDA nicht als sicher und wirksam befunden, und diese Kennzeichnung wurde nicht von der FDA genehmigt. Für weitere Informationen über nicht zugelassene Medikamente, klicken Sie hier.
Nur Rx
Ärzte, die den Einsatz von Goldnatriumthiomalat planen, sollten sich gründlich mit seiner Toxizität und seinem Nutzen vertraut machen. Die Möglichkeit von toxischen Reaktionen sollte dem Patienten vor Beginn der Therapie stets erklärt werden. Die Patienten sollten gewarnt werden, alle Symptome, die auf eine Toxizität hindeuten, unverzüglich zu melden. Vor jeder Injektion von Goldnatriumthiomalat sollte der Arzt die Ergebnisse der Laboruntersuchungen überprüfen und den Patienten aufsuchen, um das Vorhandensein oder Nichtvorhandensein von unerwünschten Reaktionen festzustellen, da einige davon schwerwiegend oder sogar tödlich sein können.
- BESCHREIBUNG
- KLINISCHE PHARMAKOLOGIE
- ANWENDUNGEN UND ANWENDUNG
- KONTRAINDIKATIONEN
- WARNHINWEISE
- VORSICHTSMASSNAHMEN:
- Allgemein
- Karzinogenität
- Schwangerschaft
- Stillende Mütter
- Nebenwirkungen
- Behandlung von unerwünschten Reaktionen
- DOSIERUNG UND ANWENDUNG
- Jugendliche rheumatoide Arthritis
- HINWEISE ZUR VERFÜGUNG
- Mehr über Myochrysin (Goldnatriumthiomalat)
- Related treatment guides
BESCHREIBUNG
Myochrysine® Goldnatriumthiomalat ist eine sterile wässrige Lösung. Sie enthält 0,5 Prozent BENZYL-Alkohol, der als Konservierungsmittel zugesetzt ist. Der pH-Wert des Produktes liegt bei 5,8 bis 6,5.
Goldnatriumthiomalat ist ein Gemisch aus den Mono- und Di-Natriumsalzen der Goldthiomalinsäure. Die Strukturformel lautet:
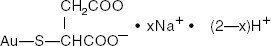
Mercaptobutandisäure, Monogold (1 +) Natriumsalz
Das Molekulargewicht für C4H3AuNa2O4S (das Dinatriumsalz) ist 390,07 und für C4H4AuNaO4S (das Mononatriumsalz) ist 368.09.
Goldnatriumthiomalat wird als Lösung zur intramuskulären Injektion geliefert, die 50 mg Goldnatriumthiomalat pro ml enthält.
KLINISCHE PHARMAKOLOGIE
Die Wirkungsweise von Goldnatriumthiomalat ist unbekannt. Die vorherrschende Wirkung scheint eine unterdrückende Wirkung auf die Synovitis aktiver rheumatischer Erkrankungen zu sein.
ANWENDUNGEN UND ANWENDUNG
Goldnatriumthiomalat ist zur Behandlung ausgewählter Fälle von aktiver rheumatischer Arthritis – sowohl bei Erwachsenen als auch bei Jugendlichen – angezeigt. Der größte Nutzen tritt im frühen aktiven Stadium auf. In späten Stadien der Krankheit, wenn Knorpel- und Knochenschäden aufgetreten sind, kann Gold lediglich das Fortschreiten der rheumatoiden Arthritis aufhalten und weitere strukturelle Schäden an den Gelenken verhindern. Es kann keine Schäden reparieren, die durch eine bereits aktive Erkrankung verursacht wurden.
Gold-Natriumthiomalat sollte nur als Teil eines vollständigen Therapieprogramms verwendet werden; allein ist es keine vollständige Behandlung.
KONTRAINDIKATIONEN
Überempfindlichkeit gegen einen Bestandteil dieses Produkts.
Schwere Toxizität, die aus einer früheren Exposition gegenüber Gold oder anderen Schwermetallen resultiert.
Schwere Entkräftung.
Systemischer Lupus erythematodes.
WARNHINWEISE
Vor Beginn der Behandlung sollten Hämoglobin-, Erythrozyten-, Leukozyten-, Differenzial- und Thrombozytenzahl des Patienten bestimmt und eine Urinuntersuchung durchgeführt werden, die als Basisreferenz dient. Vor jeder Injektion sollte der Urin auf Protein- und Sedimentveränderungen untersucht werden. Vor jeder zweiten Injektion während der Behandlung sollte ein vollständiges Blutbild einschließlich der Bestimmung der Blutplättchen durchgeführt werden. Das Auftreten von Purpura oder Ekchymosen zu irgendeinem Zeitpunkt erfordert immer eine Thrombozytenzählung.
Gefährliche Anzeichen für eine mögliche Goldtoxizität sind u. a.: schneller Abfall des Hämoglobins, Leukopenie unter 4000 WBC/mm3, Eosinophilie über 5 %, Abnahme der Thrombozyten unter 100.000/mm3, Albuminurie, Hämaturie, Pruritus, Hautausschlag, Stomatitis oder anhaltender Durchfall. Es sollten keine weiteren Injektionen von Goldnatriumthiomalat verabreicht werden, es sei denn, weitere Studien zeigen, dass diese Anomalien durch andere Bedingungen als Goldtoxizität verursacht werden.
VORSICHTSMASSNAHMEN:
Allgemein
Goldsalze sollten nicht gleichzeitig mit Penicillamin verwendet werden.
Die Sicherheit der gleichzeitigen Verabreichung mit zytotoxischen Arzneimitteln wurde nicht nachgewiesen.
Vorsicht ist geboten bei der Anwendung von Gold-Natriumthiomalat bei Patienten mit den folgenden Erkrankungen:
- Blutdyskrasien in der Vorgeschichte wie Granulozytopenie oder Anämie aufgrund von Arzneimittelüberempfindlichkeit,
- Allergie oder Überempfindlichkeit gegenüber Arzneimitteln,
- Hautausschlag,
- vorherige Nieren- oder Lebererkrankung,
- ausgeprägter Bluthochdruck,
- beeinträchtigter zerebraler oder kardiovaskulärer Kreislauf.
Diabetes mellitus oder kongestive Herzinsuffizienz sollten unter Kontrolle sein, bevor eine Goldtherapie eingeleitet wird.
Karzinogenität
Nierenadenome wurden in Langzeit-Toxizitätsstudien an Ratten berichtet, die Gold-Natriumthiomalat in hohen Dosen erhielten (2 mg/kg wöchentlich über 45 Wochen, gefolgt von 6mg/kg täglich über 47 Wochen), was etwa dem 2- bis 42-fachen der üblichen menschlichen Dosis entspricht. Diese Adenome ähneln histologisch denen, die bei Ratten durch chronische Verabreichung von experimentellen Goldverbindungen und anderen Schwermetallen wie Blei entstehen. Es liegen keine Berichte über Nierenadenome beim Menschen im Zusammenhang mit der Verwendung von Goldnatriumthiomalat vor.
Schwangerschaft
Schwangerschaftskategorie C.
Goldnatriumthiomalat hat sich während der organogenetischen Periode bei Ratten und Kaninchen als teratogen erwiesen, wenn es in Dosen verabreicht wurde, die dem 140- bzw. 175-fachen der üblichen Humandosis entsprechen. Hydrozephalie und Mikrophthalmie waren die Missbildungen, die bei Ratten beobachtet wurden, als Goldnatriumthiomalat in einer Dosis von 25 mg/kg/Tag vom 6. bis zum 15. Tag der Trächtigkeit subkutan verabreicht wurde. Bei Kaninchen wurden Missbildungen der Gliedmaßen und Gastroschisis beobachtet, wenn Goldnatriumthiomalat subkutan in einer Dosis von 20 – 45 mg/kg/Tag vom 6. bis zum 18. Tag der Trächtigkeit verabreicht wurde.
Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen. Gold-Natriumthiomalat sollte während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen für die Mutter das potentielle Risiko für den Fötus rechtfertigt.
Stillende Mütter
Das Vorhandensein von Gold ist in der Milch stillender Mütter nachgewiesen worden. Darüber hinaus wurde Gold im Serum und in den roten Blutkörperchen eines stillenden Säuglings gefunden. In Anbetracht der oben genannten Befunde und wegen des Potenzials für schwerwiegende unerwünschte Reaktionen bei stillenden Säuglingen durch Goldnatriumthiomalat sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen unterbrochen oder das Arzneimittel abgesetzt werden soll. Die langsame Ausscheidung und der Verbleib von Gold in der Mutter, auch nach Absetzen der Therapie, muss ebenfalls berücksichtigt werden.
Nebenwirkungen
Eine Vielzahl von Nebenwirkungen kann während der Anfangsphase (wöchentliche Injektionen) der Therapie oder während der Erhaltungsbehandlung auftreten. Unerwünschte Wirkungen werden am häufigsten beobachtet, wenn die verabreichte Gesamtdosis von Goldnatriumthiomalat zwischen 400 und 800 mg liegt. Sehr selten treten Komplikationen Tage bis Monate nach Beendigung der Behandlung auf.
Hautreaktionen: Dermatitis ist die häufigste Reaktion. Jeder Hautausschlag, insbesondere wenn er juckt, der während der Behandlung mit Goldnatriumthiomalat auftritt, sollte bis zum Beweis des Gegenteils als Reaktion auf Gold angesehen werden. Juckreiz tritt häufig auf, bevor sich eine Dermatitis zeigt, und sollte daher als Warnsignal für eine bevorstehende Hautreaktion angesehen werden. Die schwerwiegendste Form der Hautreaktion ist die generalisierte exfoliative Dermatitis, die zu Alopezie und Ablösung der Nägel führen kann. Die Golddermatitis kann sich durch Sonneneinstrahlung verschlimmern oder es kann sich ein aktinischer Ausschlag entwickeln.
Schleimhautreaktionen: Stomatitis ist die zweithäufigste unerwünschte Reaktion. Flache Geschwüre an den Wangenschleimhäuten, am Zungenrand, am Gaumen oder im Rachenraum können als einzige Nebenwirkung oder zusammen mit einer Dermatitis auftreten. Manchmal entwickelt sich eine diffuse Glossitis oder Gingivitis. Ein metallischer Geschmack kann diesen Mundschleimhautreaktionen vorausgehen und sollte als Warnsignal betrachtet werden.
Bindehautentzündung ist eine seltene Reaktion.
Nierenreaktionen: Gold kann toxisch für die Niere sein und ein nephrotisches Syndrom oder eine Glomerulitis mit Hämaturie hervorrufen. Diese Nierenreaktionen sind in der Regel relativ mild und klingen vollständig ab, wenn sie frühzeitig erkannt und die Behandlung abgesetzt wird. Sie können jedoch schwerwiegend und chronisch werden, wenn die Behandlung nach dem Auftreten der Reaktion fortgesetzt wird. Daher ist es wichtig, vor jeder Injektion eine Urinuntersuchung durchzuführen und die Behandlung sofort abzubrechen, wenn eine Proteinurie oder Hämaturie auftritt.
Hämatologische Reaktionen: Blutdyskrasie aufgrund von Goldtoxizität ist selten, muss aber wegen der möglichen schwerwiegenden Folgen ständig überwacht und durch häufige Blutuntersuchungen während der Behandlung frühzeitig erkannt werden. Es wurde über Granulozytopenie, Thrombozytopenie mit oder ohne Purpura, hypoplastische und aplastische Anämie und Eosinophilie berichtet. Diese hämatologischen Störungen können einzeln oder in Kombination auftreten.
Nitritoide und allergische Reaktionen: Es wurde über Reaktionen vom „Nitritoid-Typ“ berichtet, die anaphylaktoiden Wirkungen ähneln können. Am häufigsten wird über Erröten, Ohnmacht, Schwindel und Schwitzen berichtet. Weitere Symptome, die auftreten können, sind: Übelkeit, Erbrechen, Unwohlsein, Kopfschmerzen und Schwäche.
Zu den schwereren, aber weniger häufigen Wirkungen gehören: anaphylaktischer Schock, Synkope, Bradykardie, Verdickung der Zunge, Schluck- und Atembeschwerden und angioneurotisches Ödem. Diese Wirkungen können fast unmittelbar nach der Injektion oder erst 10 Minuten nach der Injektion auftreten. Sie können zu jedem Zeitpunkt während der Therapie auftreten, und wenn sie beobachtet werden, sollte die Behandlung mit Goldnatriumthiomalat abgebrochen werden.
Sonstige Reaktionen: Es wurde über gastrointestinale Reaktionen berichtet, einschließlich Übelkeit, Erbrechen, Anorexie, Bauchkrämpfe und Durchfall. Selten wurde über eine ulzerative Enterokolitis berichtet, die schwerwiegend oder sogar tödlich verlaufen kann.
Selten wurde über Reaktionen am Auge wie Iritis, Hornhautgeschwüre und Goldablagerungen im Augengewebe berichtet. Über Komplikationen des peripheren und zentralen Nervensystems wurde selten berichtet. Es wurde über periphere Neuropathie mit oder ohne Faszikulationen, sensomotorische Effekte (einschließlich Guillain-Barré-Syndrom) und erhöhte Proteinwerte in der Rückenmarksflüssigkeit berichtet. Zu den Komplikationen des zentralen Nervensystems gehörten Verwirrung, Halluzinationen und Krampfanfälle. In der Regel klangen diese Anzeichen und Symptome nach Absetzen der Goldtherapie ab.
Eine Hepatitis, Gelbsucht mit oder ohne Cholestase, Goldbronchitis, Lungenschäden, die sich durch interstitielle Pneumonitis und Fibrose manifestieren, teilweiser oder vollständiger Haarausfall und Fieber wurden ebenfalls berichtet.
Gelegentlich treten nach einer Injektion von Goldnatriumthiomalat für ein oder zwei Tage Arthralgien auf; diese Reaktion klingt in der Regel nach den ersten Injektionen ab.
Behandlung von unerwünschten Reaktionen
Bei Auftreten von toxischen Reaktionen sollte die Behandlung mit Goldnatriumthiomalat sofort abgebrochen werden. Geringfügige Komplikationen wie lokale Dermatitis, leichte Stomatitis oder leichte Proteinurie erfordern im Allgemeinen keine andere Therapie und klingen spontan mit dem Absetzen von Goldnatriumthiomalat ab. Bei mäßig schweren Haut- und Schleimhautreaktionen helfen häufig topische Kortikosteroide, orale Antihistaminika und beruhigende oder anästhetische Lotionen.
Wenn die Stomatitis oder Dermatitis schwerwiegend oder generalisiert wird, können systemische Kortikosteroide (im Allgemeinen Prednison 10 bis 40 mg täglich in geteilten Dosen) eine symptomatische Linderung bewirken.
Bei schwerwiegenden renalen, hämatologischen, pulmonalen und enterocolitischen Komplikationen werden hohe Dosen systemischer Kortikosteroide (Prednison 40 bis 100 mg täglich in geteilten Dosen) empfohlen. Die optimale Dauer der Kortikosteroidbehandlung hängt von der Reaktion des einzelnen Patienten ab. Bei ungewöhnlich schweren oder fortschreitenden unerwünschten Wirkungen kann eine monatelange Therapie erforderlich sein.
Bei Patienten, deren Komplikationen sich durch eine hochdosierte Kortikosteroidbehandlung nicht bessern oder die erhebliche steroidbedingte Nebenwirkungen entwickeln, kann ein Chelatbildner verabreicht werden, um die Goldausscheidung zu verbessern. Dimercaprol (BAL) wurde erfolgreich eingesetzt, doch müssen die Patienten sorgfältig überwacht werden, da bei seiner Anwendung zahlreiche unerwünschte Reaktionen auftreten können. Kortikosteroide und ein Chelatbildner können gleichzeitig verabreicht werden.
Natriumthiomalat Gold sollte nach schweren oder idiosynkratischen Reaktionen nicht erneut verabreicht werden.
Natriumthiomalat Gold kann nach Abklingen leichter Reaktionen in einer reduzierten Dosierung erneut verabreicht werden. Wenn eine anfängliche Testdosis von 5 mg Goldnatriumthiomalat gut vertragen wird, können in wöchentlichen bis monatlichen Abständen schrittweise höhere Dosen (in Schritten von 5 bis 10 mg) verabreicht werden, bis eine Dosis von 25 bis 50 mg erreicht ist.
DOSIERUNG UND ANWENDUNG
Goldnatriumthiomalat sollte nur durch intramuskuläre Injektion verabreicht werden, vorzugsweise intragluteal. Es sollte dem Patienten im Liegen verabreicht werden. Er sollte nach der Injektion für etwa 10 Minuten liegen bleiben.
Die therapeutische Wirkung von Goldnatriumthiomalat tritt langsam ein. Eine frühe Besserung, die sich oft auf eine Verringerung der Morgensteifigkeit beschränkt, kann nach sechs bis acht Wochen der Behandlung eintreten, aber vorteilhafte Wirkungen können erst nach Monaten der Therapie beobachtet werden.
Parenteralpräparate sollten vor der Verabreichung visuell auf Partikel und Verfärbungen überprüft werden. Nicht verwenden, wenn sich das Material verdunkelt hat. Die Farbe sollte blassgelb nicht überschreiten.
Für einen Erwachsenen durchschnittlicher Größe wird folgendes Dosierungsschema empfohlen:
Wöchentliche Injektionen:
1. Injektion………………………………………………………………………………………….10 mg
2. Injektion…………………………………………………………………………………………25 mg
Dritte und weitere Injektionen, 25 bis 50 mg, bis eine Toxizität oder eine wesentliche klinische Besserung eintritt oder, falls keines von beidem eintritt, die kumulative Dosis von Goldnatriumthiomalat ein Gramm erreicht.
Goldnatriumthiomalat wird fortgesetzt, bis die kumulative Dosis ein Gramm erreicht, es sei denn, eine Toxizität oder eine wesentliche klinische Besserung tritt ein. Tritt eine wesentliche klinische Besserung ein, bevor eine kumulative Dosis von einem Gramm verabreicht wurde, kann die Dosis verringert oder das Intervall zwischen den Injektionen wie bei der Erhaltungstherapie verlängert werden. Empfohlen werden Erhaltungsdosen von 25 bis 50 mg jede zweite Woche über zwei bis 20 Wochen. Wenn der klinische Verlauf stabil bleibt, können Injektionen von 25 bis 50 mg jede dritte und anschließend jede vierte Woche auf unbestimmte Zeit verabreicht werden. Bei einigen Patienten kann eine Erhaltungstherapie in Abständen von einer bis drei Wochen erforderlich sein. Sollte sich die Arthritis während der Erhaltungstherapie verschlimmern, können die wöchentlichen Injektionen vorübergehend wieder aufgenommen werden, bis die Krankheitsaktivität unterdrückt ist.
Sollte sich die Situation eines Patienten während der Anfangstherapie (kumulative Dosis von einem Gramm) nicht bessern, stehen mehrere Möglichkeiten zur Verfügung.
- Der Patient kann als nicht ansprechend betrachtet werden und Goldnatriumthiomalat wird abgesetzt.
- Die gleiche Dosis (25 bis 50 mg) Goldnatriumthiomalat kann für etwa zehn weitere Wochen fortgesetzt werden.
- Die Dosis von Goldnatriumthiomalat kann in Schritten von 10 mg alle ein bis vier Wochen erhöht werden, wobei 100 mg in einer einzigen Injektion nicht überschritten werden dürfen.
Wenn eine signifikante klinische Verbesserung durch Option 2 oder 3 eintritt, sollte das oben beschriebene Erhaltungsschema eingeleitet werden. Tritt keine signifikante Verbesserung ein oder kommt es zu Toxizität, sollte die Therapie mit Goldnatriumthiomalat abgebrochen werden. Je höher die individuelle Dosis von Goldnatriumthiomalat ist, desto größer ist das Risiko einer Goldtoxizität. Die Wahl einer dieser Optionen für die Chrysotherapie sollte auf einer Reihe von Faktoren beruhen, einschließlich der Erfahrung des Arztes mit der Goldsalztherapie, dem Krankheitsverlauf des Patienten, der Wahl alternativer Behandlungen und der Verfügbarkeit des Patienten für die erforderliche engmaschige Überwachung.
Jugendliche rheumatoide Arthritis
Die pädiatrische Dosis von Goldnatriumthiomalat ist proportional zur Erwachsenendosis auf Gewichtsbasis. Nach der anfänglichen Testdosis von 10 mg beträgt die empfohlene Dosis für Kinder 1 mg pro Kilogramm Körpergewicht, wobei 50 mg für eine einzige Injektion nicht überschritten werden dürfen. Ansonsten gelten die oben genannten Richtlinien für die Verabreichung an Erwachsene auch für Kinder.
Begleitende Arzneimitteltherapie-Goldsalze sollten nicht gleichzeitig mit Penicillamin angewendet werden.
Die Sicherheit der gleichzeitigen Verabreichung mit zytotoxischen Arzneimitteln wurde nicht nachgewiesen. Andere Maßnahmen, wie Salicylate, andere nichtsteroidale entzündungshemmende Arzneimittel oder systemische Kortikosteroide, können fortgesetzt werden, wenn Goldnatriumthiomalat begonnen wird. Nachdem eine Besserung eingetreten ist, können schmerzstillende und entzündungshemmende Medikamente langsam abgesetzt werden, wenn es die Symptome zulassen.
HINWEISE ZUR VERFÜGUNG
Myochrysine® Injection Gold-Natriumthiomalat ist eine hellgelbe bis gelbe Lösung, je nach Potenz, die vor Licht geschützt werden muss. Es wird wie folgt geliefert:
NDC 17478-533-01 Goldnatriumthiomalat, 50 mg pro mL, 1 mL in 2 mL (teilgefüllten) Durchstechflaschen in Packungen zu 6 Stück.
NDC 17478-533-10 Goldnatriumthiomalat, 50 mg pro mL, 10 mL Durchstechflaschen.
Lagerung: Bei 20° bis 25°C (68° bis 77°F) lagern. Vor Licht schützen. Behälter im Karton aufbewahren, bis der Inhalt aufgebraucht ist.
Akorn
Hergestellt von: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Hauptanzeigetafeltext für Behälteretikett:
NDC 17478-533-10
Myochrysin
Natriumthiomalat
Injektion, USP
50 mg/mL
10 mL Mehrfachdosis-Fläschchen
Rx nur Akorn-Logo
Mfg. by: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Hauptanzeigetafeltext für Kartonetikett:
NDC 17478-533-10
Myochrysin
Goldnatriumthiomalat
Injektion, USP
50 mg/ml
Nur zur intramuskulären Injektion.
Nicht intravenös anwenden.
10 mL Mehrfach
Dosierfläschchen
Nur Rx

| Myochrysin Natriumthiomalat-Injektion |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Akorn, Inc. (062649876)
| Einrichtung | |||
| Name | Adresse | ID/FEI | Betriebe |
| Akorn, Inc. | 155135783 | HERSTELLUNG, ANALYSE, VERPACKUNG | |
Mehr über Myochrysin (Goldnatriumthiomalat)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Wirkungszusammenhänge
- 1 Übersicht
- Medikamentenklasse: Antirheumatika
Related treatment guides
- Rheumatoide Arthritis
Medical Disclaimer