Nombre genérico: tiomalato sódico de oro
Forma farmacéutica: inyección
Revisado médicamente por Drugs.com. Última actualización: 23 de marzo de 2020.
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Embarazo
- Más
Descargo de responsabilidad: la FDA no ha determinado que este medicamento sea seguro y eficaz, y este etiquetado no ha sido aprobado por la FDA. Para obtener más información sobre los medicamentos no aprobados, haga clic aquí.
Sólo Rx
Los médicos que tengan previsto utilizar tiomalato sódico de oro deben familiarizarse a fondo con su toxicidad y sus beneficios. La posibilidad de reacciones tóxicas debe explicarse siempre al paciente antes de iniciar la terapia. Se debe advertir a los pacientes que informen rápidamente de cualquier síntoma que sugiera toxicidad. Antes de cada inyección de tiomalato sódico de oro, el médico debe revisar los resultados de los análisis de laboratorio y ver al paciente para determinar la presencia o ausencia de reacciones adversas, ya que algunas de ellas pueden ser graves o incluso mortales.
- DESCRIPCIÓN
- FARMACOLOGÍA CLÍNICA
- INDICACIONES Y USO
- CONTRAINDICACIONES
- ADVERTENCIAS
- PRECAUCIONES :
- Generales
- Carcinogenicidad
- Embarazo
- Madres lactantes
- Reacciones adversas
- Manejo de las reacciones adversas
- DOSIS Y ADMINISTRACIÓN
- Artritis reumatoide juvenil
- Cómo se suministra
- Más información sobre Miocisina (tiomalato sódico de oro)
- Guías de tratamiento relacionadas
DESCRIPCIÓN
Tiomalato sódico de oro de Miochrysine® es una solución acuosa estéril. Contiene un 0,5 por ciento de alcohol bencílico añadido como conservante. El pH del producto es de 5,8 a 6,5.
Tiomalato de Oro Sódico es una mezcla de las sales mono- y di- sódicas del ácido tiomálico de oro. La fórmula estructural es:
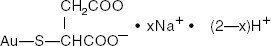
Ácido mercaptobutanedioico, sal sódica monogold (1 +)
El peso molecular para C4H3AuNa2O4S (la sal disódica) es 390,07 y para C4H4AuNaO4S (la sal monosódica) es 368.09.
Tiomalato de Oro Sódico se suministra como una solución para inyección intramuscular que contiene 50 mg de Tiomalato de Oro Sódico por mL.
FARMACOLOGÍA CLÍNICA
El modo de acción del Tiomalato de Oro Sódico es desconocido. La acción predominante parece ser un efecto supresor sobre la sinovitis de la enfermedad reumatoide activa.
INDICACIONES Y USO
Tiomalato sódico de oro está indicado en el tratamiento de casos seleccionados de artritis reumatoide activa, tanto del tipo adulto como juvenil. El mayor beneficio se produce en la fase activa temprana. En las fases tardías de la enfermedad, cuando se han producido daños en los cartílagos y los huesos, el oro sólo puede frenar la progresión de la artritis reumatoide y prevenir nuevos daños estructurales en las articulaciones. No puede reparar el daño causado por la enfermedad previamente activa.
Tiomalato sódico de oro debe utilizarse sólo como una parte de un programa completo de terapia; por sí solo no es un tratamiento completo.
CONTRAINDICACIONES
Hipersensibilidad a cualquier componente de este producto.
Toxicidad grave resultante de la exposición previa al oro u otros metales pesados.
Debilidad grave.
Lupus eritematoso sistémico.
ADVERTENCIAS
Antes de iniciar el tratamiento, deben determinarse los recuentos de hemoglobina, eritrocitos, glóbulos blancos, diferencial y plaquetas del paciente, y debe realizarse un análisis de orina que sirva de referencia básica. La orina debe analizarse para detectar cambios en las proteínas y en el sedimento antes de cada inyección. Los recuentos sanguíneos completos, incluida la estimación de las plaquetas, deben realizarse antes de cada segunda inyección a lo largo del tratamiento. La aparición de púrpura o equimosis en cualquier momento requiere siempre un recuento de plaquetas.
Las señales de peligro de una posible toxicidad del oro incluyen: reducción rápida de la hemoglobina, leucopenia por debajo de 4000 WBC/mm3, eosinofilia por encima del 5 por ciento, disminución de las plaquetas por debajo de 100.000/mm3, albuminuria, hematuria, prurito, erupción cutánea, estomatitis o diarrea persistente. No deben administrarse inyecciones adicionales de tiomalato sódico de oro a menos que estudios adicionales demuestren que estas anomalías son causadas por condiciones distintas a la toxicidad del oro.
PRECAUCIONES :
Generales
Las sales de oro no deben utilizarse de forma concomitante con la penicilamina.
No se ha establecido la seguridad de la coadministración con fármacos citotóxicos.
Se indica precaución en el uso de tiomalato de oro sódico en pacientes con lo siguiente:
- historia de discrasias sanguíneas como granulocitopenia o anemia causada por sensibilidad al medicamento,
- alergia o hipersensibilidad a los medicamentos,
- erupción cutánea,
- enfermedad renal o hepática previa,
- hipertensión marcada,
- circulación cerebral o cardiovascular comprometida.
La diabetes mellitus o la insuficiencia cardíaca congestiva deben estar bajo control antes de instituir la terapia con oro.
Carcinogenicidad
Se han notificado adenomas renales en estudios de toxicidad a largo plazo de ratas que recibieron tiomalato de sodio de oro a niveles de dosis elevados (2 mg/kg semanales durante 45 semanas, seguidos de 6mg/kg diarios durante 47 semanas), aproximadamente de 2 a 42 veces la dosis humana habitual. Estos adenomas son histológicamente similares a los producidos en ratas por la administración crónica de compuestos de oro experimentales y otros metales pesados, como el plomo. No se han recibido informes de adenomas renales en el hombre en asociación con el uso de tiomalato sódico de oro.
Embarazo
Categoría de embarazo C.
Tiomalato sódico de oro ha demostrado ser teratogénico durante el período organogenético en ratas y conejos cuando se administra en dosis, respectivamente, de 140 y 175 veces la dosis humana habitual. La hidrocefalia y la microftalmia fueron las malformaciones observadas en ratas cuando se administró tiomalato de oro por vía subcutánea a una dosis de 25 mg/kg/día desde el día 6 hasta el día 15 de la gestación. En conejos, las malformaciones de las extremidades y la gastrosquisis fueron las malformaciones observadas cuando se administró tiomalato de oro por vía subcutánea a dosis de 20 – 45 mg/kg/día desde el día 6 hasta el día 18 de la gestación.
No existen estudios adecuados y bien controlados en mujeres embarazadas. El tiomalato de oro sódico debe utilizarse durante el embarazo sólo si el beneficio potencial para la madre justifica el riesgo potencial para el feto.
Madres lactantes
Se ha demostrado la presencia de oro en la leche de madres lactantes. Además, se ha encontrado oro en el suero y en los glóbulos rojos de un bebé lactante. En vista de los hallazgos anteriores y debido a la posibilidad de que se produzcan reacciones adversas graves en los bebés lactantes a causa del tiomalato sódico de oro, debe tomarse la decisión de interrumpir la lactancia o de suspender el medicamento, teniendo en cuenta la importancia del mismo para la madre. También debe tenerse en cuenta la lenta excreción y la persistencia del oro en la madre, incluso después de interrumpir la terapia.
Reacciones adversas
Durante la fase inicial (inyecciones semanales) de la terapia o durante el tratamiento de mantenimiento pueden desarrollarse diversas reacciones adversas. Las reacciones adversas se observan con mayor frecuencia cuando la dosis acumulada de tiomalato sódico de oro administrada está entre 400 y 800 mg. Muy infrecuentemente, las complicaciones se producen de días a meses después de la interrupción del tratamiento.
Reacciones cutáneas: La dermatitis es la reacción más común. Cualquier erupción, especialmente si es pruriginosa, que se desarrolle durante el tratamiento con tiomalato sódico de oro debe considerarse una reacción al oro hasta que se demuestre lo contrario. El prurito existe a menudo antes de que se manifieste la dermatitis y, por lo tanto, debe considerarse una señal de advertencia de una reacción cutánea inminente. La forma más grave de reacción cutánea es la dermatitis exfoliativa generalizada, que puede provocar alopecia y caída de las uñas. La dermatitis dorada puede agravarse por la exposición a la luz solar o puede desarrollarse una erupción actínica.
Reacciones de las membranas mucosas: La estomatitis es la segunda reacción adversa más frecuente. Pueden aparecer úlceras superficiales en las membranas bucales, en los bordes de la lengua y en el paladar o en la faringe como única reacción adversa o junto con la dermatitis. A veces se produce una glositis o gingivitis difusa. Un sabor metálico puede preceder a estas reacciones de la mucosa oral y debe considerarse una señal de advertencia.
La conjuntivitis es una reacción poco frecuente.
Reacciones renales: El oro puede ser tóxico para el riñón y producir un síndrome nefrótico o una glomerulitis con hematuria. Estas reacciones renales suelen ser relativamente leves y ceden completamente si se reconocen a tiempo y se interrumpe el tratamiento. Pueden llegar a ser graves y crónicas si se continúa el tratamiento tras la aparición de la reacción. Por lo tanto, es importante realizar un análisis de orina antes de cada inyección, e interrumpir el tratamiento rápidamente si se desarrolla proteinuria o hematuria.
Reacciones hematológicas: La discrasia sanguínea debida a la toxicidad del oro es poco frecuente, pero debido a sus potenciales consecuencias graves debe vigilarse constantemente y reconocerse precozmente mediante análisis de sangre frecuentes realizados a lo largo del tratamiento. Se han notificado casos de granulocitopenia; trombocitopenia, con o sin púrpura; anemia hipoplásica y aplásica; y eosinofilia. Estos trastornos hematológicos pueden producirse por separado o en combinación.
Reacciones nitritoides y alérgicas: Se han notificado reacciones del «tipo nitritoide» que pueden parecerse a los efectos anafilactoides. Se han notificado con mayor frecuencia rubor, desmayos, mareos y sudoración. Otros síntomas que pueden aparecer son: náuseas, vómitos, malestar general, dolor de cabeza y debilidad.
Efectos más graves, pero menos comunes, incluyen: shock anafiláctico, síncope, bradicardia, engrosamiento de la lengua, dificultad para tragar y respirar y edema angioneurótico. Estos efectos pueden producirse casi inmediatamente después de la inyección o hasta 10 minutos después de la misma. Pueden ocurrir en cualquier momento durante el curso de la terapia y si se observan, el tratamiento con Tiomalato de Oro Sódico debe ser interrumpido.
Reacciones diversas: Se han notificado reacciones gastrointestinales, incluyendo náuseas, vómitos, anorexia, calambres abdominales y diarrea. En raras ocasiones se ha notificado enterocolitis ulcerosa, que puede ser grave o incluso mortal.
Se han notificado raras reacciones que afectan al ojo, como iritis, úlceras corneales y depósitos de oro en los tejidos oculares. Raramente se han notificado complicaciones del sistema nervioso periférico y central. Se ha notificado neuropatía periférica, con o sin, fasciculaciones, efectos sensoriomotores (incluyendo el síndrome de Guillain-Barré) y elevación de las proteínas del líquido cefalorraquídeo. Las complicaciones del sistema nervioso central han incluido confusión, alucinaciones y convulsiones. Por lo general, estos signos y síntomas desaparecieron al interrumpir el tratamiento con oro.
También se han notificado casos de hepatitis, ictericia, con o sin colestasis, bronquitis por oro, lesiones pulmonares manifestadas por neumonitis intersticial y fibrosis, pérdida parcial o total del cabello y fiebre.
A veces se produce artralgia durante uno o dos días después de una inyección de tiomalato sódico de oro; esta reacción suele remitir después de las primeras inyecciones.
Manejo de las reacciones adversas
El tratamiento con tiomalato sódico de oro debe interrumpirse inmediatamente cuando se produzcan reacciones tóxicas. Las complicaciones menores, como la dermatitis localizada, la estomatitis leve o la proteinuria leve, no suelen requerir ningún otro tratamiento y se resuelven espontáneamente con la suspensión del tiomalato sódico de oro. Las reacciones moderadamente graves de la piel y las membranas mucosas a menudo se benefician de los corticosteroides tópicos, los antihistamínicos orales y las lociones calmantes o anestésicas.
Si la estomatitis o la dermatitis se vuelve grave o más generalizada, los corticosteroides sistémicos (generalmente, prednisona 10 a 40 mg diarios en dosis divididas) pueden proporcionar alivio sintomático.
En caso de complicaciones renales, hematológicas, pulmonares y enterocolíticas graves, se recomiendan dosis altas de corticosteroides sistémicos (prednisona 40 a 100 mg diarios en dosis divididas). La duración óptima del tratamiento con corticosteroides varía según la respuesta de cada paciente. La terapia puede ser necesaria durante muchos meses cuando los efectos adversos son inusualmente graves o progresivos.
En los pacientes cuyas complicaciones no mejoran con el tratamiento con dosis altas de corticosteroides, o que desarrollan reacciones adversas significativas relacionadas con los esteroides, puede administrarse un agente quelante para mejorar la excreción de oro. El dimercaprol (BAL) se ha utilizado con éxito, pero los pacientes deben ser controlados cuidadosamente, ya que su uso puede provocar numerosas reacciones adversas. Pueden utilizarse corticosteroides y un agente quelante de forma concomitante.
Tiomalato sódico de oro no debe reinstaurarse después de reacciones graves o idiosincrásicas.
Tiomalato sódico de oro puede volver a administrarse tras la resolución de reacciones leves, utilizando una pauta de dosificación reducida. Si se tolera bien una dosis inicial de prueba de 5 mg de tiomalato sódico de oro, pueden administrarse dosis progresivamente mayores (incrementos de 5 a 10 mg) a intervalos semanales o mensuales hasta alcanzar una dosis de 25 a 50 mg.
DOSIS Y ADMINISTRACIÓN
Tiomalato sódico de oro debe administrarse únicamente mediante inyección intramuscular, preferiblemente intraglútea. Debe administrarse con el paciente tumbado. Debe permanecer tumbado durante aproximadamente 10 minutos después de la inyección.
Los efectos terapéuticos del tiomalato sódico de oro se producen lentamente. La mejora temprana, a menudo limitada a una reducción de la rigidez matutina, puede comenzar después de seis a ocho semanas de tratamiento, pero los efectos beneficiosos pueden no observarse hasta después de meses de terapia.
Los productos farmacéuticos parenterales deben inspeccionarse visualmente para detectar la presencia de partículas y la decoloración antes de su administración. No utilizar si el material se ha oscurecido. El color no debe ser superior al amarillo pálido.
Para el adulto de tamaño medio se sugiere la siguiente pauta de dosificación:
Inyecciones semanales:
1ª inyección………………………………………………………………………………………….10 mg
Segunda inyección…………………………………………………………………………………………25 mg
Tercera y subsiguientes inyecciones, de 25 a 50 mg hasta que se produzca toxicidad o una mejora clínica importante o, en ausencia de cualquiera de ellas, la dosis acumulativa de tiomalato sódico de oro alcance un gramo.
El tiomalato sódico de oro se continúa hasta que la dosis acumulativa alcance un gramo a menos que se produzca toxicidad o una mejora clínica importante. Si se produce una mejoría clínica importante antes de que se haya administrado una dosis acumulada de un gramo, se puede disminuir la dosis o aumentar el intervalo entre las inyecciones como en el caso del tratamiento de mantenimiento. Se recomiendan dosis de mantenimiento de 25 a 50 mg cada dos semanas durante dos a 20 semanas. Si el curso clínico se mantiene estable, pueden administrarse inyecciones de 25 a 50 mg cada tres y posteriormente cada cuatro semanas de forma indefinida. Algunos pacientes pueden necesitar un tratamiento de mantenimiento a intervalos de una a tres semanas. Si la artritis se exacerba durante la terapia de mantenimiento, las inyecciones semanales pueden reanudarse temporalmente hasta que se suprima la actividad de la enfermedad.
En caso de que un paciente no mejore durante la terapia inicial (dosis acumulada de un gramo), existen varias opciones.
- Se puede considerar que el paciente no responde y se interrumpe el Tiomalato de Oro Sódico.
- Se puede continuar con la misma dosis (25 a 50 mg) de tiomalato sódico de oro durante aproximadamente diez semanas adicionales.
- La dosis de tiomalato sódico de oro puede aumentarse en incrementos de 10 mg cada una a cuatro semanas, sin exceder los 100 mg en una sola inyección.
Si se produce una mejoría clínica significativa utilizando la opción 2 o 3, se debe iniciar el programa de mantenimiento descrito anteriormente. Si no se produce una mejoría significativa o si se produce toxicidad, debe interrumpirse la terapia con tiomalato sódico de oro. Cuanto mayor sea la dosis individual de tiomalato sódico de oro, mayor será el riesgo de toxicidad del oro. La selección de una de estas opciones para la crisoterapia debe basarse en una serie de factores, incluyendo la experiencia del médico con la terapia con sales de oro, la evolución de la enfermedad del paciente, la elección de tratamientos alternativos y la disponibilidad del paciente para la estrecha supervisión requerida.
Artritis reumatoide juvenil
La dosis pediátrica de tiomalato sódico de oro es proporcional a la dosis para adultos en función del peso. Después de la dosis inicial de prueba de 10 mg, la dosis recomendada para los niños es de un mg por kilo de peso corporal, sin superar los 50 mg en una sola inyección. Por lo demás, las directrices dadas anteriormente para la administración a adultos también se aplican a los niños.
Terapia farmacológica concomitante: las sales de oro no deben utilizarse de forma concomitante con la penicilamina.
No se ha establecido la seguridad de la coadministración con fármacos citotóxicos. Cuando se inicie la administración de tiomalato de sodio de oro, pueden continuarse otras medidas, como salicilatos, otros antiinflamatorios no esteroideos o corticosteroides sistémicos. Después de que comience la mejoría, los fármacos analgésicos y antiinflamatorios pueden suspenderse lentamente según lo permitan los síntomas.
Cómo se suministra
Tiomalato de Oro Sódico en inyección es una solución de color amarillo claro a amarillo, dependiendo de la potencia, que debe protegerse de la luz. Se suministra de la siguiente manera:
NDC 17478-533-01 Tiomalato de oro, 50 mg por mL, 1 mL en viales de 2 mL (parcialmente llenos) en paquetes de 6.
NDC 17478-533-10 Tiomalato de oro, 50 mg por mL, viales de 10 mL.
ALMACENAMIENTO: Almacenar de 20° a 25°C (68° a 77°F) . Proteger de la luz. Conservar el envase en la caja hasta que se haya utilizado el contenido.
Akorn
Fabricado por: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Texto principal del panel de visualización para la etiqueta del envase:
NDC 17478-533-10
Miocisina
Tiomalato de sodio dorado
Inyección, USP
50 mg/mL
Vial de dosis múltiple de 10 mL
Rx sólo logotipo de Akorn
Fabricado por: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Texto del panel principal para la etiqueta de cartón:
NDC 17478-533-10
Miocrisina
Tiomalato de sodio dorado
Inyección, USP
50 mg/mL
Sólo para inyección intramuscular.
No utilizar por vía intravenosa.
10 mL Múltiple
Vial de dosis
Sólo para uso en inyección

| Miocisina tiomalato sódico de oro inyectable. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiquetador – Akorn, Inc. (062649876)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Akorn, Inc. | 155135783 | Fabricación, análisis, embalaje | |
Más información sobre Miocisina (tiomalato sódico de oro)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Interacciones con otros medicamentos
- 1 Revisión
- Clase de medicamentos: antirreumáticos
Guías de tratamiento relacionadas
- Artritis reumatoide
Aviso médico