Generaattinen nimi: kultanatriumtiomalaatti
annosmuoto: injektio
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 23. maaliskuuta 2020.
- Haittavaikutukset
- Dosointi
- Professio
- Vuorovaikutukset
- Raskaus
- Lisää
Vastuunlauseke: FDA ei ole todennut tätä lääkettä turvalliseksi ja tehokkaaksi, eikä FDA ole hyväksynyt tätä lääkkeen merkintää. Lisätietoja hyväksymättömistä lääkkeistä saat klikkaamalla tästä.
Rx only
Lääkärin, joka suunnittelee käyttävänsä Gold Sodium Thiomalate -valmistetta, tulee perehtyä perusteellisesti sen toksisuuteen ja hyötyihin. Toksisten reaktioiden mahdollisuus on aina selitettävä potilaalle ennen hoidon aloittamista. Potilaita on varoitettava ilmoittamaan viipymättä kaikista toksisuuteen viittaavista oireista. Ennen jokaista Gold Sodium Thiomalate -injektiota lääkärin on tarkistettava laboratoriotutkimusten tulokset ja tavattava potilas selvittääkseen haittavaikutusten olemassaolon tai puuttumisen, koska jotkut niistä voivat olla vakavia tai jopa kuolemaan johtavia.
KUVAUS
Myochrysine® Gold Sodium Thiomalate on steriili vesiliuos. Se sisältää 0,5 prosenttia BENZYL-alkoholia, joka on lisätty säilöntäaineeksi. Tuotteen pH on 5,8 t o 6,5.
Kultanatriumtiomalaatti on kultatiomaliinihapon mono- ja dinatriumsuolojen seos. Rakennekaava on:
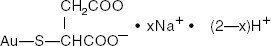
merkaptobutaanidihappo, monokullan (1 +) natriumsuola
C4H3AuNa2O4S:n (dinatriumsuola) molekyylipaino on 390,07 ja C4H4AuNaO4S:n (mononatriumsuola) 368.09.
Kultanatriumtiomalaatti toimitetaan liuoksena lihaksensisäistä injektiota varten, joka sisältää 50 mg kultanatriumtiomalaattia millilitrassa.
KLIININEN FARMAKOLOGIA
Kultanatriumtiomalaatin vaikutustapa on tuntematon. Vallitseva vaikutus näyttää olevan aktiivisen nivelreuman synoviittia suppressiivinen vaikutus.
MÄÄRÄYKSET JA NIIDEN KÄYTTÖAIHEET
Kultanatriumtiomalaatti on tarkoitettu aktiivisen nivelreuman valittujen tapausten hoitoon – sekä aikuisten että nuorten nivelreuman hoitoon. Suurin hyöty saavutetaan varhaisessa aktiivisessa vaiheessa. Sairauden myöhäisvaiheessa, kun rusto ja luusto ovat vaurioituneet, kulta voi vain hillitä nivelreuman etenemistä ja estää nivelten rakenteellisten vaurioiden lisääntymistä. Se ei voi korjata aiemmin aktiivisen taudin aiheuttamia vaurioita.
Kultanatriumtiomalaattia tulee käyttää vain yhtenä osana kokonaisvaltaista hoito-ohjelmaa; yksinään se ei ole täydellinen hoito.
VALMISTELUT
Yliherkkyys tämän valmisteen jollekin aineosalle.
Vaikea myrkyllisyys aiemmasta altistumisesta kullalle tai muille raskasmetalleille.
Vaikea heikentyminen.
Systeeminen lupus erythematosus.
VAROITUKSET
Ennen hoidon aloittamista potilaan hemoglobiini-, erytrosyytti-, valkosyytti-, differentiaali- ja trombosyyttiarvot on määritettävä ja virtsa- ja verihiutaleanalyysi on tehtävä perusviitteeksi. Virtsasta on analysoitava proteiini- ja sedimenttimuutokset ennen jokaista injektiota. Täydellinen verenkuva, mukaan lukien verihiutaleiden arviointi, on tehtävä ennen jokaista toista injektiota koko hoidon ajan. Purppuran tai ekhymoosien esiintyminen milloin tahansa edellyttää aina verihiutaleiden laskentaa.
Vaaraesimerkkejä mahdollisesta kultatoksisuudesta ovat: hemoglobiinin nopea lasku, leukopenia alle 4000 WBC/mm3, eosinofilia yli 5 prosenttia, verihiutaleiden väheneminen alle 100 000/mm3, albuminuria, hematuria, pruritus, ihopurkauma, stomatiitti tai jatkuva ripuli. Kultanatriumtiomalaatin lisäinjektioita ei tule antaa, elleivät lisätutkimukset osoita näiden poikkeavuuksien johtuvan muista tiloista kuin kultatoksisuudesta.
VAROITUKSET :
Yleistä
Kultasuoloja ei tule käyttää samanaikaisesti penisillamiinin kanssa.
Sytotoksisten lääkkeiden kanssa samanaikaisen annon turvallisuutta ei ole osoitettu.
Kultanatriumtiomalaatin käytössä on noudatettava varovaisuutta potilailla, joilla on seuraavat sairaudet:
- historiassa veren toimintahäiriöitä, kuten granulosytopeniaa tai lääkeaineyliherkkyydestä johtuvaa anemiaa,
- allergia tai yliherkkyys lääkkeille,
- ihoihottuma,
- aikaisempi munuais- tai maksasairaus,
- merkittyä verenpainetautia
- heikentynyttä verenkiertoa aivoissa tai sydämessä.
Diabeteksen tai kongestiivisen sydämen vajaatoiminnan tulisi olla hallinnassa ennen kultalääkityksen aloittamista.
Karsinogeenisuus
Renaalisia adenoomia on raportoitu pitkäaikaisissa myrkyllisyystutkimuksissa rotilla, jotka saivat kultanatriumtiomalaattia suurilla annostasoilla (2 mg/kg viikoittain 45 viikon ajan ja sen jälkeen 6 mg/kg päivittäin 47 viikon ajan), mikä on suunnilleen 2-42-kertainen tavanomaiseen ihmisannokseen verrattuna. Nämä adenoomat ovat histologisesti samanlaisia kuin ne, joita rotilla on syntynyt kokeellisten kultayhdisteiden ja muiden raskasmetallien, kuten lyijyn, kroonisen annostelun seurauksena. Ihmisillä ei ole saatu raportteja munuaisten adenoomista kullanatriumtiomalaatin käytön yhteydessä.
Raskaus
Raskausluokka C.
Kullanatriumtiomalaatin on osoitettu olevan teratogeeninen organogeneettisen kauden aikana rotilla ja kaneilla, kun sitä annettiin 140 ja 175 kertaa tavanomainen ihmisannos. Hydrokefalia ja mikrosilmäisyys olivat epämuodostumia, joita havaittiin rotilla, kun kullanatriumtiomalaattia annettiin ihon alle annoksena 25 mg/kg/vrk 6. päivästä 15. päivään tiineyden aikana. Kaneilla raajojen epämuodostumia ja gastroschisis olivat epämuodostumia, joita havaittiin, kun Gold Sodium Thiomalate annettiin ihon alle annoksina 20 – 45 mg/kg/vrk 6.-18. tiineyspäivän välisenä aikana.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Kultanatriumtiomalaattia tulee käyttää raskauden aikana vain, jos äidille mahdollisesti koituva hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imettävät äidit
Kultaa on osoitettu esiintyvän imettävien äitien maidossa. Lisäksi kultaa on löydetty imettävän lapsen seerumista ja punasoluista. Edellä mainittujen löydösten perusteella ja koska kultanatriumtiomalaatti voi aiheuttaa vakavia haittavaikutuksia imettäville imeväisille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille. Kullan hidas erittyminen ja säilyminen äidissä myös hoidon lopettamisen jälkeen on myös pidettävä mielessä.
Haittavaikutukset
Hoidon alkuvaiheessa (viikoittaiset injektiot) tai ylläpitohoidon aikana voi ilmaantua erilaisia haittavaikutuksia. Haittavaikutuksia havaitaan yleisimmin, kun annettavan Gold-natriumtiomalaatin kumulatiivinen annos on 400-800 mg. Hyvin harvoin komplikaatioita esiintyy päivistä kuukausiin hoidon lopettamisen jälkeen.
Kudosreaktiot: Ihottuma on yleisin reaktio. Kaikkia kultanatriumtiomalaattihoidon aikana kehittyviä ihottumia, erityisesti jos ne ovat kutiavia, on pidettävä kultareaktiona, kunnes toisin todistetaan. Kutinaa esiintyy usein ennen kuin ihotulehdus ilmenee, ja siksi sitä on pidettävä varoitusmerkkinä lähestyvästä ihoreaktiosta. Ihoreaktion vakavin muoto on yleistynyt eksfoliatiivinen dermatiitti, joka voi johtaa hiustenlähtöön ja kynsien irtoamiseen. Kultainen ihottuma voi pahentua altistumalla auringonvalolle tai siihen voi kehittyä aktiininen ihottuma.
Ihokalvoreaktiot: Stomatiitti on toiseksi yleisin haittavaikutus. Matalia haavaumia suun limakalvoilla, kielen reunoilla ja kitalaessa tai nielussa voi esiintyä ainoana haittavaikutuksena tai yhdessä ihottuman kanssa. Joskus kehittyy diffuusi kiille- tai ientulehdus. Metallinen maku voi edeltää näitä suun limakalvoreaktioita, ja sitä on pidettävä varoitussignaalina.
Konnekalvotulehdus on harvinainen reaktio.
Renaaliset reaktiot: Kulta voi olla myrkyllistä munuaisille ja aiheuttaa nefroottisen oireyhtymän tai glomeruliitin, johon liittyy hematuria. Nämä munuaisreaktiot ovat yleensä suhteellisen lieviä ja häviävät kokonaan, jos ne tunnistetaan ajoissa ja hoito lopetetaan. Ne voivat muuttua vakaviksi ja kroonisiksi, jos hoitoa jatketaan reaktion alkamisen jälkeen. Siksi on tärkeää, että virtsa tutkitaan ennen jokaista injektiota ja että hoito lopetetaan heti, jos kehittyy proteinuriaa tai hematuriaa.
Hematologiset reaktiot: Kullan myrkyllisyydestä johtuvat verihäiriöt ovat harvinaisia, mutta mahdollisten vakavien seurausten vuoksi niitä on jatkuvasti tarkkailtava ja ne on tunnistettava varhaisessa vaiheessa tekemällä tiheitä verikokeita koko hoidon ajan. Granulosytopeniaa; trombosytopeniaa, johon liittyy tai ei liity purppuraa; hypoplastista ja aplastista anemiaa; ja eosinofiliaa on raportoitu. Näitä hematologisia häiriöitä voi esiintyä erikseen tai yhdistelminä.
Nitritoidi- ja allergiset reaktiot: On raportoitu ”nitritoidityyppisiä” reaktioita, jotka voivat muistuttaa anafylaktoidisia vaikutuksia. Useimmiten on raportoitu punoitusta, pyörtymistä, huimausta ja hikoilua. Muita oireita, joita voi esiintyä, ovat: pahoinvointi, oksentelu, huonovointisuus, päänsärky ja heikkous.
Vaikeampia, mutta harvinaisempia vaikutuksia ovat: anafylaktinen sokki, pyörtyminen, bradykardia, kielen paksuuntuminen, nielemis- ja hengitysvaikeudet ja angioneuroottinen turvotus. Nämä vaikutukset voivat ilmetä lähes välittömästi injektion jälkeen tai vasta 10 minuutin kuluttua injektion jälkeen. Niitä voi esiintyä milloin tahansa hoidon aikana, ja jos niitä havaitaan, Gold Sodium Thiomalate -hoito on lopetettava.
Muut reaktiot: Ruoansulatuskanavan reaktioita on raportoitu, mukaan lukien pahoinvointia, oksentelua, ruokahaluttomuutta, vatsakramppeja ja ripulia. Harvoin on raportoitu haavaista enterokoliittia, joka voi olla vakava tai jopa kuolemaan johtava.
Harvoin on raportoitu silmään liittyviä reaktioita, kuten iriittiä, sarveiskalvon haavaumia ja kultakertymiä silmän kudoksissa. Perifeerisiä ja keskushermostokomplikaatioita on raportoitu harvoin. On raportoitu perifeeristä neuropatiaa, johon liittyy tai ei liity faskikulaatioita, sensomotorisia vaikutuksia (mukaan lukien Guillain-Barrén oireyhtymä) ja kohonneita selkäydinnesteen proteiineja. Keskushermostokomplikaatioita ovat olleet sekavuus, hallusinaatiot ja kouristukset. Yleensä nämä merkit ja oireet hävisivät, kun kultahoito lopetettiin.
Hepatiittia, keltatautia, kolestaasilla tai ilman kolestaasia, kultabronkiittia, keuhkovaurioita, jotka ilmenevät interstitiaalisena pneumoniittina ja fibroosina, osittaista tai täydellistä hiustenlähtöä ja kuumetta on myös raportoitu.
Joskus niveltulehdusta esiintyy päivän tai kahden ajan kultanatriumtiomalaatti-injektion jälkeen; tämä reaktio häviää tavallisesti muutaman ensimmäisen injektion jälkeen.
HAITTAVAIKUTUSTEN HALLINTA
Kultanatriumtiomalaattihoito on lopetettava välittömästi, jos toksisia reaktioita ilmenee. Vähäiset komplikaatiot, kuten paikallinen ihottuma, lievä stomatiitti tai lievä proteinuria, eivät yleensä vaadi muuta hoitoa ja häviävät spontaanisti Gold Sodium Thiomalate -hoidon keskeyttämisen myötä. Keskivaikeat iho- ja limakalvoreaktiot hyötyvät usein paikallisista kortikosteroideista, suun kautta otettavista antihistamiinilääkkeistä ja rauhoittavista tai puuduttavista voiteista.
Jos stomatiitti tai ihotulehdus muuttuu vaikeaksi tai yleistyneemmäksi, systeemiset kortikosteroidit (yleensä prednisoni 10-40 mg vuorokaudessa jaettuina annoksina) voivat helpottaa oireita.
Vakavien munuais-, hematologisten, keuhko- ja suolistokomplikaatioiden vuoksi suositellaan suuria annoksia systeemisiä kortikosteroideja (prednisonia 40-100 mg vuorokaudessa jaettuina annoksina). Kortikosteroidihoidon optimaalinen kesto vaihtelee yksittäisen potilaan vasteen mukaan. Hoitoa voidaan tarvita useita kuukausia, jos haittavaikutukset ovat epätavallisen vaikeita tai eteneviä.
Potilaille, joiden komplikaatiot eivät parane suurilla annoksilla kortikosteroidihoitoa tai joille kehittyy merkittäviä steroideihin liittyviä haittavaikutuksia, voidaan antaa kelaattorihoitoa kullan erittymisen tehostamiseksi. Dimerkaprolia (BAL) on käytetty menestyksekkäästi, mutta potilaita on seurattava huolellisesti, koska sen käyttöön voi liittyä lukuisia haittavaikutuksia. Kortikosteroideja ja kelatoivaa ainetta voidaan käyttää samanaikaisesti.
Kultanatriumtiomalaattia ei saa antaa uudelleen vakavien tai idiosynkraattisten reaktioiden jälkeen.
Kultanatriumtiomalaattia voidaan antaa uudelleen lievien reaktioiden häviämisen jälkeen pienemmällä annostuksella. Jos 5 mg:n aloituskoeannos Gold Sodium Thiomalate on hyvin siedetty, asteittain suurempia annoksia (5-10 mg:n lisäyksin) voidaan antaa viikoittain tai kuukausittain, kunnes saavutetaan 25-50 mg:n annos.
ANNOSTELU JA ANNOSTUS
Gold Sodium Thiomalate tulee antaa vain lihaksensisäisenä injektiona, mieluimmin suonensisäisesti. Se on annettava potilaan ollessa makuulla. Hänen on pysyttävä makuuasennossa noin 10 minuuttia injektion jälkeen.
Kultanatriumtiomalaatin terapeuttiset vaikutukset ilmenevät hitaasti. Varhainen paraneminen, joka usein rajoittuu aamujäykkyyden vähenemiseen, voi alkaa kuuden-kahdeksan viikon hoidon jälkeen, mutta suotuisia vaikutuksia saatetaan havaita vasta kuukausien hoidon jälkeen.
Parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti hiukkasmaisen aineksen ja värimuutosten varalta ennen antamista. Älä käytä, jos materiaali on tummunut. Väri ei saa ylittää vaaleankeltaista.
Keskikokoiselle aikuiselle suositellaan seuraavaa annosteluaikataulua:
Viikoittaiset injektiot:
1. injektio………………………………………………………………………………………….10 mg
2. injektio…………………………………………………………………………………………25 mg
3. ja sitä seuraavat injektiot, 25-50 mg, kunnes ilmenee toksisuutta tai merkittävää kliinistä paranemista tai, jos kumpaakaan näistä ei tapahdu, kultanatriumtiomalaatin kumulatiivinen annos saavuttaa yhden gramman.
Kultanatriumtiomalaattia jatketaan, kunnes kumulatiivinen annos saavuttaa yhden gramman, ellei ilmene toksisuutta tai merkittävää kliinistä paranemista. Jos merkittävää kliinistä paranemista tapahtuu ennen kuin yhden gramman kumulatiivinen annos on annettu, annosta voidaan pienentää tai pistosväliä pidentää kuten ylläpitohoidossa. Ylläpitoannoksiksi suositellaan 25-50 mg:n annoksia joka toinen viikko kahden tai 20 viikon ajan. Jos kliininen taudinkuva pysyy vakaana, 25-50 mg:n injektioita voidaan antaa joka kolmas ja myöhemmin joka neljäs viikko toistaiseksi. Jotkut potilaat saattavat tarvita ylläpitohoitoa yhden tai kolmen viikon välein. Jos niveltulehdus pahenee ylläpitohoidon aikana, viikoittaisia injektioita voidaan tilapäisesti jatkaa, kunnes taudin aktiivisuus on vähentynyt.
Jos potilaan tila ei parane alkuhoidon aikana (kumulatiivinen annos yksi gramma), käytettävissä on useita vaihtoehtoja.
- Potilasta voidaan pitää reagoimattomana, ja Gold-natriumtiomalaattihoito lopetetaan.
- samaa Gold-natriumtiomalaattiannosta (25-50 mg) voidaan jatkaa vielä noin kymmenen viikon ajan.
- Gold-natriumtiomalaattiannosta voidaan suurentaa 10 mg:n lisäyksin 1-4 viikon välein, enintään 100 mg:n suuruisena yksittäisenä injektiona.
Jos kliininen tilanne paranee merkittävästi vaihtoehdon 2 tai 3 avulla, edellä kuvattu ylläpitoannos on aloitettava. Jos merkittävää paranemista ei tapahdu tai jos ilmenee toksisuutta, Gold Sodium Thiomalate -hoito on lopetettava. Mitä suurempi kullan natriumtiomalaatin yksilöllinen annos on, sitä suurempi on kullan toksisuuden riski. Jommankumman vaihtoehdon valitsemisen krysoterapiaan tulisi perustua useisiin tekijöihin, kuten lääkärin kokemukseen kultasuolahoidosta, potilaan tilan kulkuun, vaihtoehtoisten hoitomuotojen valintaan ja potilaan saatavuuteen tarvittavaan tiiviiseen valvontaan.
Nuorten nivelreuma
Kultanatriumtiomalaatin pediatrinen annos on verrannollinen aikuisten annokseen painon perusteella. Alustavan 10 mg:n koeannoksen jälkeen suositeltu annos lapsille on yksi mg ruumiinpainokiloa kohti, kuitenkin enintään 50 mg kerta-annoksena. Muilta osin edellä aikuisille annostelusta annetut ohjeet pätevät myös lapsiin.
Yksi samanaikainen lääkehoito – Kultasuoloja ei saa käyttää samanaikaisesti penisillamiinin kanssa.
Yksi samanaikaisen annostelun turvallisuutta sytotoksisten lääkkeiden kanssa ei ole osoitettu. Muita toimenpiteitä, kuten salisylaatteja, muita ei-steroidisia tulehduskipulääkkeitä tai systeemisiä kortikosteroideja, voidaan jatkaa, kun Gold Sodium Thiomalate aloitetaan. Paranemisen alettua kipulääkkeet ja tulehduskipulääkkeet voidaan lopettaa hitaasti oireiden salliessa.
KUKA SAATTAA
Myochrysine® Injection Gold Sodium Thiomalate on tehosta riippuen vaaleankeltaisesta keltaiseen vaihteleva liuos, joka on suojattava valolta. Sitä toimitetaan seuraavasti:
NDC 17478-533-01 Gold Sodium Thiomalate , 50 mg/ml, 1 ml, 2 ml:n (osittain täytetyissä ) injektiopulloissa 6 kpl:n pakkauksissa.
NDC 17478-533-10 Gold Sodium Thiomalate , 50 mg/ml, 10 ml:n injektiopulloissa.
VARASTOINTI: Säilytä 20° – 25°C (68° – 77°F) . Suojattava valolta. Säilytä astia pahvipakkauksessa, kunnes sisältö on käytetty.
Akorn
Valmistaja: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Perusnäyttöpaneelin teksti säiliön etiketissä:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
10 ml:n monikerta-annos injektiopullo
Rx only Akorn logo
Mfg. by: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Pakkausetiketin päänäyttötaulun teksti:
NDC 17478-533-10
Myochrysine
Kultainen natriumtiomalaatti
Injektio, USP
50 mg/ml
Vain lihaksensisäiseen injektioon.
Ei saa käyttää laskimoon.
10 ml:n moninkertainen
annosinjektiopullo
Vain reseptilääke

| Myochrysine kultanatriumtiomalaatti-injektio. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Merkintä – Akorn, Inc. (062649876)
| Toimipaikka | |||
| Nimi | Asoite | ID/FEI | Toiminnot |
| Akorn, Inc. | 155135783 | VALMISTUS, ANALYYSI, PAKKAUS | |
Myochrysine (gold sodium thiomalate)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Asietiedot
- Lääkeinteraktiot
- 1 arvostelu
- Lääkeryhmä:
Hoito-oppaat
- reumaattinen niveltulehdus
Lääketieteellinen vastuuvapauslauseke
.