Generikus név: arany-nátrium-tiomalát
Adagolási forma: injekció
A Drugs.com által orvosilag felülvizsgált. Utolsó frissítés: 2020. március 23.
- Mellékhatások
- Adagolás
- Szakmai
- Ellenhatások
- Várandósság
- Még
Kizáró nyilatkozat: Ezt a gyógyszert az FDA nem találta biztonságosnak és hatásosnak, és ezt a jelölést az FDA nem hagyta jóvá. A nem jóváhagyott gyógyszerekkel kapcsolatos további információkért kattintson ide.
Kizárólag orvosi rendelvényre
A Gold Sodium Thiomalate alkalmazását tervező orvosoknak alaposan meg kell ismerkedniük a toxicitással és az előnyökkel. A toxikus reakciók lehetőségét a terápia megkezdése előtt mindig el kell magyarázni a betegnek. A betegeket figyelmeztetni kell, hogy azonnal jelentsék a toxicitásra utaló tüneteket. A Gold Sodium Thiomalate minden egyes injekciója előtt az orvosnak át kell tekintenie a laboratóriumi vizsgálatok eredményeit, és fel kell keresnie a beteget, hogy megállapítsa a mellékhatások jelenlétét vagy hiányát, mivel ezek közül néhány súlyos vagy akár halálos kimenetelű is lehet.
- LEÍRÁS
- KLINIKAI FARMAKOLÓGIA
- INDIKÁCIÓ ÉS HASZNÁLAT
- KONTRAINDIKÁCIÓK
- Figyelmeztetések
- FIGYELMEZTETÉSEK :
- Általános
- Karcinogenitás
- Terhesség
- Szoptató anyák
- Mellékhatások
- A MELLÉKHATÁSOK KEZELÉSE
- ADAGOLÁS ÉS ADAGOLÁS
- fiatalkori reumatoid artritisz
- HOW SUPPLIED
- Több információ a Myochrysine (arany nátriumtiomalát)
- Kapcsolódó kezelési útmutatók
LEÍRÁS
A Myochrysine® Gold Sodium Thiomalate steril vizes oldat. Tartósítószerként hozzáadott 0,5 százalék BENZYL alkoholt tartalmaz. A termék pH-ja 5,8 t o 6,5,
A Gold Sodium Thiomalate az aranytomiolsav mono- és di-nátriumsóinak keveréke. A szerkezeti képlet:
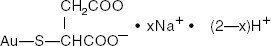
merkaptobutándiolsav, monogold (1 +) nátriumsó
A C4H3AuNa2O4S (a dinátriumsó) molekulatömege 390,07, a C4H4AuNaO4S (a mono- nátriumsó) molekulatömege 368.09.
A Gold Sodium Thiomalate intramuszkuláris injekcióhoz való oldat formájában kerül forgalomba, amely 50 mg Gold Sodium Thiomalate-ot tartalmaz milliliterenként.
KLINIKAI FARMAKOLÓGIA
A Gold Sodium Thiomalate hatásmechanizmusa nem ismert. Úgy tűnik, hogy az uralkodó hatás az aktív reumás betegség szinovitiszére gyakorolt szuppresszív hatás.
INDIKÁCIÓ ÉS HASZNÁLAT
A Gold Sodium Thiomalate az aktív reumás artritisz kiválasztott eseteinek – mind a felnőtt, mind a fiatalkori típusú – kezelésére javallt. A legnagyobb előny a korai aktív stádiumban jelentkezik. A betegség késői szakaszában, amikor a porc- és csontkárosodás már bekövetkezett, az arany csak a reumatoid artritisz progresszióját tudja megfékezni, és megakadályozni az ízületek további szerkezeti károsodását. A korábban aktív betegség által okozott károkat nem tudja helyrehozni.
A Gold Sodium Thiomalate csak egy teljes terápiás program egyik részeként alkalmazható; önmagában nem jelent teljes kezelést.
KONTRAINDIKÁCIÓK
A készítmény bármely összetevőjével szembeni túlérzékenység.
A korábbi arany- vagy más nehézfémeknek való kitettségből eredő súlyos toxicitás.
Súlyos legyengülés.
Szisztémás lupus erythematosus.
Figyelmeztetések
A kezelés megkezdése előtt meg kell határozni a beteg hemoglobin-, eritrocita-, fehérvérsejt-, differenciál- és vérlemezkeszámát, valamint alapreferenciaként vizeletvizsgálatot kell végezni. A vizeletet minden egyes injekció beadása előtt meg kell vizsgálni fehérje- és üledékváltozásokra. A kezelés során minden második injekció előtt teljes vérképet kell készíteni, beleértve a vérlemezkék becslését is. A purpura vagy ekchimózisok bármely időpontban történő megjelenése mindig vérlemezkeszámlálást igényel.
A lehetséges aranytoxicitásra utaló veszélyes jelek: a hemoglobin gyors csökkenése, 4000 WBC/mm3 alatti leukopénia, 5 százalék feletti eozinofília, 100 000/mm3 alatti vérlemezkecsökkenés, albuminuria, hematuria, pruritus, bőrkiütés, stomatitis vagy tartós hasmenés. Az arany-nátrium-tiomalát további injekcióit nem szabad beadni, kivéve, ha további vizsgálatok azt mutatják, hogy ezeket a rendellenességeket az aranytoxicitástól eltérő állapotok okozzák.
FIGYELMEZTETÉSEK :
Általános
Az aranysók nem alkalmazhatók egyidejűleg penicillaminnal.
A citotoxikus gyógyszerekkel való együttes alkalmazás biztonságossága nem bizonyított.
Az arany-nátrium-tiomalát alkalmazása során az alábbi betegeknél óvatosság javasolt:
- a kórtörténetben előforduló vérzavarok, mint például granulocitopénia vagy gyógyszerérzékenység okozta vérszegénység,
- allergia vagy gyógyszerekkel szembeni túlérzékenység,
- bőrkiütés,
- korábbi vese- vagy májbetegség,
- jelzett magas vérnyomás,
- romlott agyi vagy kardiovaszkuláris keringés.
Az aranyterápia megkezdése előtt a cukorbetegséget vagy a pangásos szívelégtelenséget kontroll alatt kell tartani.
Karcinogenitás
Az arany-nátrium-tiomalátot nagy dózisban (heti 2 mg/kg 45 héten át, majd napi 6mg/kg 47 héten át), a szokásos emberi dózis kb. 2-42-szeresével kapott patkányok hosszú távú toxicitási vizsgálataiban veseadenomákról számoltak be. Ezek az adenómák szövettanilag hasonlóak azokhoz, amelyeket kísérleti aranyvegyületek és más nehézfémek, például ólom krónikus adagolása során patkányokban hoztak létre. Embernél nem érkezett jelentés veseadenómákról az arany-nátrium-tiomalát alkalmazásával kapcsolatban.
Terhesség
C. terhességi kategória.
Az arany-nátrium-tiomalát a szokásos emberi adag 140, illetve 175-szörösének megfelelő dózisban adva teratogénnek bizonyult az organogenetikai időszakban patkányoknál és nyulaknál. Hydrocephalia és microphthalmia voltak a patkányoknál megfigyelt rendellenességek, amikor az arany-nátrium-tiomalátot 25 mg/kg/nap dózisban szubkután adták be a vemhesség 6. napjától a 15. napig. Nyulaknál végtag-rendellenességek és gastroschisis voltak a megfigyelt rendellenességek, amikor a vemhesség 6. napjától a 18. napjáig 20-45 mg/kg/nap dózisban arany-nátrium-tiomalátot adtak szubkután.
Vemhes nőkön nem állnak rendelkezésre megfelelő és jól ellenőrzött vizsgálatok. Az arany-nátrium-tiomalát terhesség alatt csak akkor alkalmazható, ha az anya számára jelentkező potenciális előnyök igazolják a magzatra jelentkező potenciális kockázatot.
Szoptató anyák
A szoptató anyák tejében kimutatták az arany jelenlétét. Ezenkívül aranyat találtak a szoptató csecsemő szérumában és vörösvérsejtjeiben is. Tekintettel a fenti megállapításokra és a szoptató csecsemőknél az arany-nátrium-tiomalát okozta súlyos mellékhatások lehetősége miatt, a szoptatás abbahagyásáról vagy a gyógyszer szedésének felfüggesztéséről kell dönteni, figyelembe véve a gyógyszer fontosságát az anya számára. Az arany lassú kiválasztódását és perzisztenciáját az anyában a terápia abbahagyása után is szem előtt kell tartani.
Mellékhatások
A terápia kezdeti szakaszában (heti injekciók) vagy a fenntartó kezelés során különféle mellékhatások alakulhatnak ki. A mellékhatások leggyakrabban akkor figyelhetők meg, amikor a beadott Gold Sodium Thiomalate kumulatív dózisa 400 és 800 mg között van. Nagyon ritkán a kezelés abbahagyása után napokkal vagy hónapokkal később lépnek fel szövődmények.
Bőrreakciók: A bőrgyulladás a leggyakoribb reakció. Minden olyan bőrkiütést, különösen ha viszketéses, amely az aranynátrium-tiomalát kezelés során alakul ki, az ellenkező bizonyításáig az arannyal szembeni reakciónak kell tekinteni. A viszketés gyakran már azelőtt jelentkezik, hogy a dermatitisz nyilvánvalóvá válna, és ezért a közelgő bőrreakció figyelmeztető jelének kell tekinteni. A bőrreakció legsúlyosabb formája az általános exfoliatív dermatitisz, amely alopeciához és körömhulláshoz vezethet. Az aranyszínű dermatitist súlyosbíthatja a napfénynek való kitettség, vagy aktinikus kiütés alakulhat ki.
Anyálkahártya reakciók: A szájnyálkahártya-gyulladás a második leggyakoribb mellékhatás. A szájnyálkahártyán, a nyelv határán, a szájpadláson vagy a garatban sekély fekélyek fordulhatnak elő egyedüli mellékhatásként vagy bőrgyulladással együtt. Néha diffúz szájnyálkahártya-gyulladás vagy ínygyulladás alakul ki. A fémes íz megelőzheti ezeket a szájnyálkahártya-reakciókat, és ezt figyelmeztető jelnek kell tekinteni.
A kötőhártya-gyulladás ritka reakció.
Renális reakciók: Az arany toxikus lehet a vesére és nefrotikus szindrómát vagy hematuriával járó glomerulitiszt okozhat. Ezek a vesereakciók általában viszonylag enyhék és teljesen lecsillapodnak, ha időben felismerik és a kezelést abbahagyják. Súlyosak és krónikusak lehetnek, ha a kezelést a reakció kialakulása után folytatják. Ezért fontos minden injekció beadása előtt vizeletvizsgálatot végezni, és a kezelést azonnal abbahagyni, ha proteinuria vagy hematuria alakul ki.
Hematológiai reakciók: Az aranytoxicitás okozta vérzavarok ritkák, de a lehetséges súlyos következmények miatt folyamatosan figyelni kell rájuk, és a kezelés során végzett gyakori vérvizsgálatokkal korán fel kell ismerni őket. Granulocitopéniáról; trombocitopéniáról, purpurával vagy anélkül; hipoplasztikus és aplasztikus anémiáról; és eozinofíliáról számoltak be. Ezek a hematológiai rendellenességek külön-külön vagy kombinációban is előfordulhatnak.
Nitritoid és allergiás reakciók: “Nitritoid típusú” reakciókról számoltak be, amelyek hasonlíthatnak anafilaktoid hatásokhoz. Leggyakrabban kipirulásról, ájulásról, szédülésről és izzadásról számoltak be. Egyéb tünetek is előfordulhatnak: hányinger, hányás, rossz közérzet, fejfájás és gyengeség.
Súlyosabb, de ritkábban előforduló hatások: anafilaxiás sokk, szinkópa, bradycardia, a nyelv megvastagodása, nyelési és légzési nehézség és angioneurotikus ödéma. Ezek a hatások szinte azonnal az injekció beadása után vagy akár az injekció beadását követő 10 perc elteltével is jelentkezhetnek. A terápia során bármikor jelentkezhetnek, és ha észlelik, a Gold Sodium Thiomalate kezelését abba kell hagyni.
Szerte reakciók: Gyomor-bélrendszeri reakciókról számoltak be, beleértve hányingert, hányást, étvágytalanságot, hasi görcsöket és hasmenést. Ritkán fekélyes bélgyulladásról számoltak be, amely súlyos vagy akár halálos kimenetelű is lehet.
Ritkán számoltak be a szemet érintő reakciókról, mint például írisz, szaruhártya-fekély és aranylerakódás a szemszövetekben. Ritkán perifériás és központi idegrendszeri szövődményekről is beszámoltak. Perifériás neuropátiáról, fasiculációkkal vagy anélkül, szenzomotoros hatásokról (beleértve a Guillain-Barré-szindrómát) és emelkedett gerincfolyadékfehérje-értékekről számoltak be. A központi idegrendszeri szövődmények között zavartság, hallucinációk és görcsrohamok szerepeltek. Általában ezek a jelek és tünetek az aranyterápia abbahagyásával megszűntek.
Hepatitis, sárgaság, kolestázissal vagy anélkül, arany bronchitis, interstitialis pneumonitisben és fibrózisban megnyilvánuló tüdőkárosodás, részleges vagy teljes hajhullás és láz is jelentkezett.
Néha előfordul, hogy az aranynátrium-tiomalát injekció beadása után egy-két napig ízületi fájdalom jelentkezik; ez a reakció általában az első néhány injekció után megszűnik.
A MELLÉKHATÁSOK KEZELÉSE
A toxikus reakciók jelentkezésekor az aranynátrium-tiomaláttal történő kezelést azonnal abba kell hagyni. Az olyan kisebb szövődmények, mint a lokalizált dermatitis, enyhe stomatitis vagy enyhe proteinuria általában nem igényelnek más terápiát és spontán megszűnnek a Gold Sodium Thiomalate felfüggesztésével. A mérsékelten súlyos bőr- és nyálkahártya-reakcióknak gyakran jót tesznek a helyi kortikoszteroidok, orális antihisztaminikumok és nyugtató vagy érzéstelenítő krémek.
Ha a sztomatitisz vagy dermatitisz súlyos vagy általánosabbá válik, szisztémás kortikoszteroidok (általában napi 10-40 mg prednizon osztott adagokban) tüneti enyhülést biztosíthatnak.
Súlyos vese-, hematológiai, tüdő- és enterokolitikus szövődmények esetén nagy dózisú szisztémás kortikoszteroidok (prednizon napi 40-100 mg osztott adagokban) alkalmazása javasolt. A kortikoszteroid-kezelés optimális időtartama az egyes betegek válaszától függően változik. A kezelésre több hónapig is szükség lehet, ha a mellékhatások szokatlanul súlyosak vagy progresszívek.
Azoknak a betegeknek, akiknek a szövődményei nem javulnak a nagy dózisú kortikoszteroid-kezelés hatására, vagy akiknél jelentős szteroiddal kapcsolatos mellékhatások alakulnak ki, kelátképző szer adható az arany kiválasztásának fokozására. A dimerkaprolt (BAL) sikeresen alkalmazták, de a betegeket gondosan ellenőrizni kell, mivel számos nemkívánatos reakció kísérheti az alkalmazását. Kortikoszteroidok és kelátképző szer egyidejűleg is alkalmazható.
Az arany nátriumtiomalátot súlyos vagy idioszinkráziás reakciók után nem szabad újra beadni.
Az arany nátriumtiomalát az enyhe reakciók megszűnését követően csökkentett adagolási ütemezéssel újra adható. Ha az 5 mg Gold Sodium Thiomalate kezdeti 5 mg-os tesztdózis jól tolerálható, akkor fokozatosan nagyobb adagok (5-10 mg-os lépésekben) adhatók heti vagy havi rendszerességgel a 25-50 mg-os adag eléréséig.
ADAGOLÁS ÉS ADAGOLÁS
A Gold Sodium Thiomalate csak intramuszkuláris injekcióval adható, lehetőleg intragluteálisan. A beteg fekvő helyzetben kell beadni. Az injekció beadása után körülbelül 10 percig fekvő helyzetben kell maradnia.
A Gold Sodium Thiomalate terápiás hatása lassan jelentkezik. A korai javulás, amely gyakran a reggeli merevség csökkenésére korlátozódik, a kezelés hat-nyolc hete után kezdődhet, de a jótékony hatások csak a terápia hónapjai után figyelhetők meg.
A parenterális gyógyszerkészítményeket beadás előtt vizuálisan meg kell vizsgálni részecskék és elszíneződések szempontjából. Ne használja fel, ha az anyag besötétedett. A szín nem haladhatja meg a halványsárgát.
Az átlagos méretű felnőttek számára a következő adagolási séma javasolt:
Heti injekciók:
1. injekció………………………………………………………………………………………….10 mg
2. injekció…………………………………………………………………………………………25 mg
3. és további injekciók, 25-50 mg, amíg toxicitás vagy jelentős klinikai javulás nem jelentkezik, vagy ezek bármelyikének hiányában a Gold Sodium Thiomalate kumulatív adagja eléri az egy grammot.
A Gold Sodium Thiomalate adagolását addig kell folytatni, amíg a kumulatív adag el nem éri az egy grammot, kivéve, ha toxicitás vagy jelentős klinikai javulás jelentkezik. Ha jelentős klinikai javulás következik be az egy gramm kumulatív adag beadása előtt, az adag csökkenthető vagy az injekciók közötti intervallum növelhető, mint a fenntartó terápia esetében. Két-húsz héten keresztül kéthetente 25-50 mg-os fenntartó adagok javasoltak. Ha a klinikai lefolyás stabil marad, 25-50 mg-os injekciókat lehet adni minden harmadik, majd ezt követően minden negyedik héten határozatlan ideig. Egyes betegeknél egy-háromhetes időközönként fenntartó kezelésre lehet szükség. Amennyiben az ízületi gyulladás a fenntartó terápia során súlyosbodik, a heti injekciókat átmenetileg újra lehet adni, amíg a betegség aktivitása nem szűnik.
Ha a beteg nem javul a kezdeti terápia során (egy gramm kumulatív adag), több lehetőség is rendelkezésre áll.
- A beteget úgy lehet tekinteni, hogy nem reagál a kezelésre, és a Gold Sodium Thiomalate alkalmazását abba kell hagyni.
- a Gold Sodium Thiomalate azonos adagja (25-50 mg) további körülbelül tíz hétig folytatható.
- a Gold Sodium Thiomalate adagja egy-négy hetente 10 mg-os lépésekkel növelhető, de nem haladhatja meg a 100 mg-ot egyetlen injekcióban.
Ha a 2. vagy 3. lehetőség alkalmazásával jelentős klinikai javulás következik be, a fent leírt fenntartási ütemezést kell megkezdeni. Ha nincs jelentős javulás, vagy ha toxicitás lép fel, a Gold Sodium Thiomalate kezelését abba kell hagyni. Minél nagyobb az Arany-nátrium-tiomalát egyedi adagja, annál nagyobb az aranytoxicitás kockázata. A krizoterápia valamelyik lehetőségének kiválasztását számos tényezőn kell alapulnia, beleértve az orvos aranysó-terápiával kapcsolatos tapasztalatait, a beteg állapotának lefolyását, az alternatív kezelések választását és a beteg elérhetőségét a szükséges szoros felügyelethez.
fiatalkori reumatoid artritisz
A Gold Sodium Thiomalate gyermekgyógyászati adagja a felnőtt adaggal arányos a testsúly alapján. A 10 mg-os kezdeti tesztadag után a gyermekek számára ajánlott adag kilogrammonként egy mg testtömeg-kilogrammonként, amely nem haladhatja meg az 50 mg-ot egyetlen injekció esetében. Egyébként a felnőtteknek történő adagolásra vonatkozó fenti irányelvek a gyermekekre is vonatkoznak.
Kísérő gyógyszeres kezelés – Az aranysók nem alkalmazhatók egyidejűleg penicillaminnal.
A citotoxikus gyógyszerekkel való együttes alkalmazás biztonságossága nem bizonyított. Egyéb intézkedések, mint például szalicilátok, egyéb nem-szteroid gyulladáscsökkentők vagy szisztémás kortikoszteroidok, folytathatók, ha az arany-nátrium-tiomalátot elkezdték. A javulás megindulása után a fájdalomcsillapító és gyulladáscsökkentő gyógyszerek a tüneteknek megfelelően lassan elhagyhatók.
HOW SUPPLIED
Myochrysine® Injection Gold Sodium Thiomalate világos sárga vagy sárga színű oldat, a hatáserősségtől függően, amelyet fénytől védeni kell. Az alábbiak szerint kerül forgalomba:
NDC 17478-533-01 Gold Sodium Thiomalate , 50 mg/ml, 1 ml, 2 ml-es (részben töltött ) injekciós üvegekben, 6 darabos kiszerelésben.
NDC 17478-533-10 Gold Sodium Thiomalate , 50 mg/ml, 10 ml-es injekciós üvegekben.
TÁROLÁS: 20°-25°C-on (68°-77°F) tárolandó. Fénytől óvni kell. A tartályt kartondobozban tárolja a tartalom felhasználásáig.
Akorn
Felelős:: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Fő kijelzőpanel szövege a tartály címkéjéhez:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
10 mL Multiple dose Vial
Rx only Akorn logo
Mfg. by: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Főcímke szövege a kartoncímkén:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
Csak intramuszkuláris injekcióhoz.
Nem alkalmazható intravénásan.
10 ml többszörös
dózisú injekciós üveg
Kizárólag orvosi rendelésre

| Myochrysin arany nátriumtiomalát injekció. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Címkéző – Akorn, Inc. (062649876)
| Település | |||
| Név | Adress | ID/FEI | Működés |
| Akorn, Inc. | 155135783 | Gyártás, analízis, csomagolás | |
Több információ a Myochrysine (arany nátriumtiomalát)
- Mellékhatások
- Terhesség vagy szoptatás alatt
- Adagolási információ
- Kölcsönhatások
- 1 felülvizsgálat
- A gyógyszercsoport:
Kapcsolódó kezelési útmutatók
- Rheumatoid arthritis
Egészségügyi nyilatkozat
.