Indledning
Der findes ca. 10.000 navngivne arter af mikrober. Det anslås, at der er mellem 10.000 og 100.000 flere uidentificerede arter for hver identificeret art. Der er ikke kun mange typer bakterier, der er også mange individuelle bakterier. En enkelt skefuld jord kan indeholde 100 millioner individuelle bakterier. En skrabning af dit tandkød kan give 1 million bakterier pr. cm2 (en cm2 er ca. på størrelse med din lillefingernegl). Bakterierne i og på vores krop udgør ca. 10 % af vores tørvægt.
De fleste af de nu kendte bakteriearter er blevet identificeret ved hjælp af traditionelle mikrobiologiske teknikker som f.eks. grampletreaktion, morfologi og metaboliske reaktioner. Bakterier lever sjældent alene, men i fællesskaber med andre bakterier. Dette gælder både i miljøet og i og på vores krop. Denne klasse fokuserer på bakteriers rolle i forbindelse med sygdom. Isolering af en enkelt bakterieart er det første skridt til at identificere de bakterier, der muligvis er ansvarlige for en sygdomsproces.
Det første krav til fysisk isolering af en bakterie er, at den kan dyrkes i laboratoriet. Dette kræver kendskab til den optimale temperatur for vækst, det optimale iltbehov og det optimale næringsbehov. Vi arbejder med et meget begrænset antal bakterier i dette kursus. De bakterier, vi arbejder med, er også meget lette at dyrke i laboratoriet. De fleste bakterier er ikke så behagelige!
Der er to hovedmåder at isolere organismer på.
- Stræk til isolering på en agarplade
- Hældplademetoden
Stræk til isolering på en agarplade indebærer en successiv fortynding af organismer, indtil man har cellerne ved en så lav tæthed, at de enkelte celler er fysisk isolerede rumligt, så de giver anledning til genkendelige individuelle kolonier. Ved hældeplademetoden fortyndes prøven tilstrækkeligt, inden den tilsættes til smeltet, afkølet agar og derefter hældes denne blanding i en skål. De isolerede celler giver anledning til individuelle kolonier, der vokser i selve agaren. Denne teknik kan være lidt vanskelig. Hvis den smeltede agar er for varm, dræber man alle bakterierne. Hvis den smeltede agar er for kold, ender du med en stor klump i din petriskål. Ved at strejle metoden får man individuelle kolonier på agarens overflade. Denne teknik er meget hurtigere og lettere at mestre.
Overblik
Du får en bouillonprøve, der indeholder tre organismer, Staphylococcus xylosus, Serratia marsescens og Escherichia. coli.
Alle tre organismer vokser let aerobt på tryptisk sojaagar (TSA). S. marsescens danner dog kun et rødt pigment ved 35 °C eller derunder og optimalt ved stuetemperatur (25 °C). Den vokser meget hurtigt ved alle temperaturer til mellemstore kolonier.
E. coli har et solbrunt udseende ved alle temperaturer og vokser også hurtigt og danner store kolonier.
S. xylosus har et gul-orange udseende ved alle temperaturer, vokser hurtigt og danner mellemstore til store kolonier.
Din evne til at isolere og se de tre organismer på din plade er afhængig af passende inkubationsbetingelser. Dine plader skal inkuberes ved stuetemperatur i 48 timer. Du skal være i stand til at identificere de tre organismer ud fra kolonistørrelse og pigment.
Materialer
- 1 blandingskultur i tryptisk sojabouillon (TSB)-rør indeholdende Staphylococcus xylosus, Serratia marsescens og Escherichia. Coli (alle BSL2)
- 3 TSA-plader
Streaking til isoleringsprocedure
Der findes flere metoder til streaking til isolering. Langt de fleste af vores studerende har haft størst succes med kvadrantmetoden, som er beskrevet nedenfor.
- Mærk din plade med dit navn, dato, afsnit og organisme.
- Anvend BSL2-procedurer for at få en løkke fuld af organismer fra dit TSB-rør (tryptic soy broth). Se protokollen om aseptisk teknik.
- Sørg for, at du har blandet dit bouillonrør tilstrækkeligt, så organismerne er ensartet suspenderet i bouillonen.
- Gentag dit TSB-rør.
- Du kan udføre den næste del med din plade på laboratoriebænken eller med den i hånden. Du bestemmer selv, hvad der fungerer bedst. Træk let din løkke frem og tilbage over agarens overflade. (Se figur 1.)
- Jo mere du trækker, jo flere bakterier afsætter du.
- Den generelle idé er at mindske bakteriekoncentrationen med hvert stryg.
- Fire til fem zigzag synes at fungere godt.
- Eksperimentér med dine forskellige plader. Sørg for at holde styr på, hvad du har gjort på hver enkelt plade.
- Hvis du bruger en forbrændingsovn, skal du sterilisere din løkke. Hvis du bruger plastiksløjfer, skal du kassere din brugte sløjfe i kavicidbeholderen og skaffe en ny steril plastiksløjfe.
- Gå ikke tilbage i det oprindelige bouillonrør.
- Tør din sløjfe mod agaroverfladen mod den yderste ende af din første stribe. Gentag ved at trække frem og tilbage.
- o Træk ikke ind i midten af din plade.
- o Du bør kunne se de svage indrykninger af din stribe på agaroverfladen.
- Genbrug en steril løkke, gentag proceduren på din anden stribe.
- Genbrug en steril løkke, gentag proceduren på din tredje stribe. Stik den sidste del i zigzag ind i midten af pladen.
- Du bør ende med isolerede kolonier et sted i din sidste stribe.
- Hvis du bruger en forbrændingsmaskine, skal du sterilisere din løkke. Hvis du bruger plastiksløjfer, skal du kassere din brugte sløjfe i kavicidbeholderen.
- Sæt låget på din plade igen.
- Sæt dine færdige plader med agarsiden opad på inkubationsstativet på den forreste bordplade i inkubationsafsnittet.
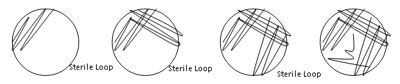
Figur 1: Kvadrantmetode til udstrygning til isolering.
Notes
- Det er absolut nødvendigt at sterilisere din løkke mellem hver udstrygning, enten ved at bruge forbrændingsmaskinen eller ved at skaffe en ny steril plastikløkke. Dette er den mest almindelige fejl, som studerende begår.
- Lad ikke din plade stå åben for længe, da der ellers vil falde ekstra bakterier fra omgivelserne ned i din plade.
- Du skal ikke blive skuffet, hvis du ikke får isolerede kolonier ved første forsøg. Dette er en vanskelig procedure.