Generisk navn: guld natrium thiomalat
Doseringsform: injektion
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 23. marts 2020.
- Bivirkninger
- Dosering
- Professionel
- Interaktioner
- Graviditet
- Mere
Disclaimer: Dette lægemiddel er ikke blevet fundet af FDA for at være sikkert og effektivt, og denne mærkning er ikke blevet godkendt af FDA. For yderligere oplysninger om ikke-godkendte lægemidler, klik her.
Kun på recept
Læger, der planlægger at bruge Gold Sodium Thiomalate, bør sætte sig grundigt ind i dets toksicitet og dets fordele. Muligheden for toksiske reaktioner skal altid forklares til patienten, før behandlingen påbegyndes. Patienterne skal advares om straks at indberette alle symptomer, der tyder på toksicitet. Før hver injektion af guldnatriumthiomalat bør lægen gennemgå resultaterne af laboratoriearbejdet og se patienten for at fastslå tilstedeværelsen eller fraværet af bivirkninger, da nogle af disse kan være alvorlige eller endog dødelige.
- BESKRIVELSE
- KLINISK FARMAKOLOGI
- INDIKATIONER OG ANVENDELSE
- KONTRAINDIKATIONER
- VARNEMÅL
- FORANSTALTNINGER :
- Alment
- Carcinogenicitet
- Graviditet
- Sygeplejersker
- Bivirkninger
- Håndtering af bivirkninger
- DOSERING OG ADMINISTRATION
- Jugendlig reumatoid arthritis
- Hvordan leveres
- Mere om Myochrysin (guldnatriumthiomalat)
- Relaterede behandlingsvejledninger
BESKRIVELSE
Myochrysine® Gold Sodium Thiomalate er en steril vandig opløsning. Den indeholder 0,5 procent BENZYL-alkohol tilsat som et konserveringsmiddel. Produktets pH-værdi er 5,8 t o 6,5.
Guldnatriumthiomalat er en blanding af mono- og di-natriumsalte af guldthiomalsyre. Strukturformlen er:
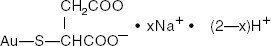
mercaptobutanedioinsyre, monoguld (1 +) natriumsalt
Molekylvægten for C4H3AuNa2O4S (dinatriumsaltet) er 390,07 og for C4H4AuNaO4S (mononatriumsaltet) er 368.09.
Guldnatriumthiomalat leveres som en opløsning til intramuskulær injektion indeholdende 50 mg guldnatriumthiomalat pr. mL.
KLINISK FARMAKOLOGI
Guldnatriumthiomalat’s virkemåde er ukendt. Den fremherskende virkning synes at være en undertrykkende virkning på synovitis ved aktiv reumatoid sygdom.
INDIKATIONER OG ANVENDELSE
Guldnatriumthiomalat er indiceret til behandling af udvalgte tilfælde af aktiv reumatoid arthritis – både af voksen og juvenil type. Den største fordel opstår i den tidlige aktive fase. I de sene stadier af sygdommen, hvor der er opstået brusk- og knogleskader, kan guld kun bremse progressionen af reumatoid arthritis og forhindre yderligere strukturelle skader på leddene. Det kan ikke reparere skader forårsaget af tidligere aktiv sygdom.
Guldnatriumthiomalat bør kun anvendes som en del af et komplet behandlingsprogram; alene er det ikke en komplet behandling.
KONTRAINDIKATIONER
Overfølsomhed over for nogen af bestanddelene i dette produkt.
Svær forgiftning som følge af tidligere udsættelse for guld eller andre tungmetaller.
Svær svækkelse.
Systemisk lupus erythematosus.
VARNEMÅL
Hvor behandlingen påbegyndes, bør patientens hæmoglobin-, erytrocyt-, erytrocyt-, hvide blodlegemer-, differential- og trombocyttal bestemmes, og der bør foretages urinanalyse for at tjene som grundlæggende reference. Urinen bør analyseres for protein- og sedimentændringer før hver injektion. Der bør foretages en komplet blodtælling, herunder en vurdering af blodpladerne, før hver anden injektion under hele behandlingen. Forekomst af purpura eller ecchymoser på et hvilket som helst tidspunkt kræver altid en trombocyttælling.
Farussignaler for mulig guldtoksicitet omfatter: hurtig reduktion af hæmoglobin, leukopeni under 4.000 WBC/mm3, eosinofili over 5 procent, trombocytnedsættelse under 100.000/mm3, albuminuri, hæmaturi, pruritus, hududslæt, stomatitis eller vedvarende diarré. Der bør ikke gives yderligere injektioner af guldnatriumthiomalat, medmindre yderligere undersøgelser viser, at disse abnormiteter er forårsaget af andre tilstande end guldtoksicitet.
FORANSTALTNINGER :
Alment
Guldsalte bør ikke anvendes samtidig med penicillamin.
Sikkerheden ved samtidig indgift med cytotoksiske lægemidler er ikke blevet fastslået.
Forsigtighed er påkrævet ved anvendelse af guldnatriumthiomalat hos patienter med følgende:
- anamnese af bloddyskrasier som granulocytopeni eller anæmi forårsaget af lægemiddeloverfølsomhed,
- allergi eller overfølsomhed over for lægemidler,
- hududslæt,
- tidligere nyre- eller leversygdom,
- markeret hypertension,
- kompromitteret cerebralt eller kardiovaskulært kredsløb.
Diabetes mellitus eller kongestiv hjertesvigt bør være under kontrol, før guldbehandling iværksættes.
Carcinogenicitet
Renal adenomer er blevet rapporteret i langtidstoksicitetsundersøgelser af rotter, der fik guldnatriumthiomalat i høje doser (2 mg/kg ugentligt i 45 uger, efterfulgt af 6mg/kg dagligt i 47 uger), ca. 2 til 42 gange den sædvanlige dosis til mennesker. Disse adenomer ligner histologisk set dem, der opstår hos rotter ved kronisk indgift af eksperimentelle guldforbindelser og andre tungmetaller, f.eks. bly. Der er ikke modtaget nogen rapporter om nyreadenomer hos mennesker i forbindelse med brug af guldnatriumthiomalat.
Graviditet
Graviditetskategori C.
Guldnatriumthiomalat har vist sig at være teratogen i den organogenetiske periode hos rotter og kaniner, når det er givet i doser på henholdsvis 140 og 175 gange den sædvanlige dosis til mennesker. Hydrocephali og microphthalmia var de misdannelser, der blev observeret hos rotter, når guldnatriumthiomalat blev administreret subkutant i en dosis på 25 mg/kg/dag fra dag 6 til dag 15 i drægtigheden. Hos kaniner blev der observeret misdannelser i lemmer og gastroschisis, når guldnatriumthiomalat blev indgivet subkutant i doser på 20-45 mg/kg/dag fra dag 6 til dag 18 i gestationen.
Der findes ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Guldnatriumthiomalat bør kun anvendes under graviditet, hvis den potentielle fordel for moderen retfærdiggør den potentielle risiko for fosteret.
Sygeplejersker
Forekomsten af guld er blevet påvist i mælken hos ammende mødre. Desuden er der fundet guld i serum og røde blodlegemer hos et ammende spædbarn. På baggrund af ovenstående fund og på grund af muligheden for alvorlige bivirkninger hos ammende spædbørn ved guldnatriumthiomalat bør der træffes en beslutning om, hvorvidt amningen skal afbrydes eller om lægemidlet skal seponeres, idet der tages hensyn til lægemidlets betydning for moderen. Den langsomme udskillelse og persistens af guld hos moderen, selv efter at behandlingen er afbrudt, skal også tages i betragtning.
Bivirkninger
En række bivirkninger kan opstå i den indledende fase (ugentlige injektioner) af behandlingen eller under vedligeholdelsesbehandlingen. Bivirkninger observeres hyppigst, når den kumulative dosis af guldnatriumthiomalat, der administreres, er mellem 400 og 800 mg. Meget sjældent forekommer komplikationer dage til måneder efter ophør af behandlingen.
Kutane reaktioner: Dermatitis er den mest almindelige reaktion. Ethvert udbrud, især hvis det er pruritisk, der udvikles under behandling med guldnatriumthiomalat, skal betragtes som en reaktion på guld indtil andet er bevist. Pruritus er ofte til stede, før dermatitis viser sig, og bør derfor betragtes som et advarselssignal om en forestående kutan reaktion. Den alvorligste form for kutan reaktion er generaliseret eksfoliativ dermatitis, som kan føre til alopeci og afskalning af negle. Gulddermatitis kan forværres ved udsættelse for sollys, eller der kan udvikles et aktinisk udslæt.
Slimhinde-reaktioner: Stomatitis er den næsthyppigste bivirkning. Lavvandede sår på mundvigene, på tungens rand og på ganen eller i svælget kan forekomme som den eneste bivirkning eller sammen med dermatitis. Undertiden udvikles diffus glossitis eller gingivitis. En metallisk smag kan gå forud for disse reaktioner på mundslimhinderne og bør betragtes som et advarselssignal.
Konjunktivitis er en sjælden reaktion.
Renale reaktioner: Guld kan være toksisk for nyrerne og give et nefrotisk syndrom eller glomerulitis med hæmaturi. Disse nyrereaktioner er normalt relativt milde og aftager fuldstændigt, hvis de erkendes tidligt og behandlingen afbrydes. De kan blive alvorlige og kroniske, hvis behandlingen fortsættes, efter at reaktionen er opstået. Derfor er det vigtigt at foretage en urinanalyse før hver injektion og at afbryde behandlingen omgående, hvis der udvikles proteinuri eller hæmaturi.
Hæmatologiske reaktioner: Bloddyskrasi som følge af guldtoksicitet er sjælden, men på grund af de potentielle alvorlige konsekvenser skal den konstant overvåges og erkendes tidligt ved hyppige blodundersøgelser, der foretages under hele behandlingen. Granulocytopeni; trombocytopeni, med eller uden purpura; hypoplastisk og aplastisk anæmi; og eosinofili er alle blevet rapporteret. Disse hæmatologiske lidelser kan forekomme separat eller i kombinationer.
Nitritoid og allergiske reaktioner: Der er rapporteret om reaktioner af “nitritoid type”, som kan ligne anafylaktoide virkninger. Rødme, besvimelse, svimmelhed og svedtendens er hyppigst rapporteret. Andre symptomer, der kan forekomme, omfatter: kvalme, opkastning, utilpashed, hovedpine og svaghed.
Mere alvorlige, men mindre almindelige virkninger omfatter: anafylaktisk chok, synkope, bradykardi, fortykkelse af tungen, synke- og vejrtrækningsbesvær og angioneurotisk ødem. Disse virkninger kan forekomme næsten umiddelbart efter injektion eller så sent som 10 minutter efter injektion. De kan forekomme på et hvilket som helst tidspunkt i løbet af behandlingsforløbet, og hvis de observeres, skal behandlingen med guldnatriumthiomalat afbrydes.
Diverse reaktioner: Der er rapporteret gastrointestinale reaktioner, herunder kvalme, opkastning, anoreksi, abdominale kramper og diarré. Ulcerøs enterocolitis, som kan være alvorlig eller endog dødelig, er sjældent rapporteret.
Der er sjældent rapporteret om reaktioner, der involverer øjet, såsom iritis, hornhinde-sår og guldaflejringer i øjenvæv. Perifere komplikationer og komplikationer i centralnervesystemet er sjældent blevet rapporteret. Der er rapporteret om perifer neuropati, med eller uden, fascikulationer, sensomotoriske virkninger (herunder Guillain-Barré syndrom) og forhøjet proteinindhold i spinalvæske. Komplikationer i centralnervesystemet har omfattet forvirring, hallucinationer og kramper. Normalt forsvandt disse tegn og symptomer ved ophør af guldbehandling.
Hepatitis, gulsot, med eller uden kolestase, guldbronkitis, lungeskader manifesteret ved interstitiel pneumonitis og fibrose, delvist eller fuldstændigt hårtab og feber er også blevet rapporteret.
I nogle tilfælde forekommer arthralgier i en dag eller to efter en injektion af guldnatriumthiomalat; denne reaktion aftager normalt efter de første par injektioner.
Håndtering af bivirkninger
Behandlingen med guldnatriumthiomalat skal straks afbrydes, når der opstår toksiske reaktioner. Mindre komplikationer såsom lokaliseret dermatitis, let stomatitis eller let proteinuri kræver generelt ingen anden behandling og forsvinder spontant med suspension af guldnatriumthiomalat. Moderat alvorlige hud- og slimhindereaktioner har ofte gavn af topiske kortikosteroider, orale antihistaminika og beroligende eller bedøvende lotioner.
Hvis stomatitis eller dermatitis bliver alvorlig eller mere generaliseret, kan systemiske kortikosteroider (generelt prednison 10 til 40 mg dagligt i opdelte doser) give symptomlindring.
Ved alvorlige nyre-, hæmatologiske, pulmonale og enterokolitiske komplikationer anbefales høje doser af systemiske kortikosteroider (prednison 40 til 100 mg dagligt i opdelte doser). Den optimale varighed af kortikosteroidbehandlingen varierer alt efter den enkelte patients respons. Behandling kan være nødvendig i mange måneder, når bivirkningerne er usædvanligt alvorlige eller progressive.
I patienter, hvis komplikationer ikke forbedres med højdosis kortikosteroidbehandling, eller som udvikler betydelige steroidrelaterede bivirkninger, kan der gives et chelatdannende middel for at øge udskillelsen af guld. Dimercaprol (BAL) er blevet anvendt med succes, men patienterne skal overvåges omhyggeligt, da talrige uheldige reaktioner kan ledsage brugen heraf. Kortikosteroider og et chelatdannende middel kan anvendes samtidig.
Guldnatriumthiomalat bør ikke genindføres efter alvorlige eller idiosynkratiske reaktioner.
Guldnatriumthiomalat kan genindgives efter afblødning af milde reaktioner ved hjælp af en reduceret doseringsskema. Hvis en indledende testdosis på 5 mg guldnatriumthiomalat tolereres godt, kan der gives gradvist større doser (5-10 mg intervaller) med ugentlige til månedlige intervaller, indtil en dosis på 25-50 mg er nået.
DOSERING OG ADMINISTRATION
Guldnatriumthiomalat bør kun administreres ved intramuskulær injektion, fortrinsvis intraglutealt. Det bør gives med patienten liggende. Han skal forblive liggende i ca. 10 minutter efter injektionen.
De terapeutiske virkninger af guldnatriumthiomalat indtræder langsomt. Tidlig forbedring, ofte begrænset til en reduktion af morgenstivhed, kan begynde efter seks til otte ugers behandling, men gavnlige virkninger kan ikke observeres før efter måneders behandling.
Parenterale lægemidler skal inspiceres visuelt for partikler og misfarvning før administration. Må ikke anvendes, hvis materialet er blevet mørkere. Farven bør ikke overstige lysegul.
For den voksne af gennemsnitlig størrelse foreslås følgende doseringsskema:
Ugentlige injektioner:
1. injektion………………………………………………………………………………………….10 mg
2. injektion…………………………………………………………………………………………25 mg
3. og efterfølgende injektioner, 25 til 50 mg, indtil der opstår toksicitet eller større klinisk bedring, eller, i mangel af en af disse, den kumulative dosis af guldnatriumthiomalat når op på et gram.
Guldnatriumthiomalat fortsættes, indtil den kumulative dosis når op på et gram, medmindre der opstår toksicitet eller større klinisk bedring. Hvis der indtræder en væsentlig klinisk forbedring, før den kumulative dosis på et gram er nået, kan dosis nedsættes, eller intervallet mellem injektionerne kan øges som ved vedligeholdelsesbehandling. Vedligeholdelsesdoser på 25 til 50 mg hver anden uge i to til 20 uger anbefales. Hvis det kliniske forløb forbliver stabilt, kan der gives injektioner på 25 til 50 mg hver tredje og derefter hver fjerde uge på ubestemt tid. Nogle patienter kan kræve vedligeholdelsesbehandling med intervaller på en til tre uger. Hvis gigten forværres under vedligeholdelsesbehandling, kan de ugentlige injektioner genoptages midlertidigt, indtil sygdomsaktiviteten er undertrykt.
Hvis en patient ikke opnår bedring under den indledende behandling (kumulativ dosis på 1 gram), er der flere muligheder.
- Patienten kan anses for ikke at reagere, og Gold Sodium Thiomalate afbrydes.
- den samme dosis (25 til 50 mg) guldnatriumthiomalat kan fortsættes i yderligere ca. 10 uger.
- dosis af guldnatriumthiomalat kan øges i intervaller på 10 mg hver en til fire uger, dog ikke over 100 mg i en enkelt injektion.
Hvis der sker en betydelig klinisk forbedring ved anvendelse af mulighed 2 eller 3, skal den ovenfor beskrevne vedligeholdelsesplan påbegyndes. Hvis der ikke sker nogen væsentlig forbedring, eller hvis der opstår toksicitet, skal behandlingen med guldnatriumthiomalat stoppes. Jo højere den individuelle dosis af guldnatriumthiomalat er, jo større er risikoen for guldtoksicitet. Valget af en af disse muligheder for krysoterapi bør baseres på en række faktorer, herunder lægens erfaring med guldsaltbehandling, forløbet af patientens tilstand, valget af alternative behandlinger og patientens tilgængelighed til den tætte overvågning, der er nødvendig.
Jugendlig reumatoid arthritis
Den pædiatriske dosis af guldnatriumthiomalat er proportional med den voksne dosis på vægtbasis. Efter den indledende testdosis på 10 mg er den anbefalede dosis til børn 1 mg pr. kilo gram kropsvægt, dog ikke over 50 mg for en enkelt injektion. Ellers gælder ovenstående retningslinjer for administration til voksne også for børn.
Komitant lægemiddelbehandling-Guldsalte bør ikke anvendes samtidig med penicillamin.
Sikkerheden ved samtidig administration med cytotoksiske lægemidler er ikke blevet fastslået. Andre foranstaltninger, såsom salicylater, andre ikke-steroide antiinflammatoriske lægemidler eller systemiske kortikosteroider, kan fortsættes, når guldnatriumthiomalat påbegyndes. Når bedring er begyndt, kan smertestillende og antiinflammatoriske lægemidler langsomt afbrydes, efterhånden som symptomerne tillader det.
Hvordan leveres
Myochrysin® Injektion Guldnatriumthiomalat er en lysegul til gul opløsning, afhængig af styrke, som skal beskyttes mod lys. Det leveres som følger:
NDC 17478-533-01 Guldnatriumthiomalat , 50 mg pr. mL, 1 mL i 2 mL (delvist fyldte) hætteglas i pakninger med 6.
NDC 17478-533-10 Guldnatriumthiomalat, 50 mg pr. mL, 10 mL hætteglas.
LAGERING: Opbevares ved 20° til 25°C (68° til 77°F) . Beskyttes mod lys. Opbevar beholderen i karton, indtil indholdet er blevet brugt.
Akorn
Produceret af: Akorn, Inc.
Lake Forest, IL 60045
MI00N
Rev. 09/08
Principal Display Panel Text for Container Label:
NDC 17478-533-10
Myochrysin
Gold natriumthiomalat
Injektion, USP
50 mg/mL
10 mL flerdosis hætteglas
Rx kun Akorn-logo
Fabrikat. af: Akorn, Inc. MIABL
Lake Forest, IL 60045 Rev. 09/08

Principal Display Panel Text for Carton Label:
NDC 17478-533-10
Myochrysine
Gold Sodium Thiomalate
Injection, USP
50 mg/mL
Kun til intramuskulær injektion.
Da må ikke anvendes intravenøst.
10 mL flerdosisflaske
Doseringsflaske
Kun på recept

| Myochrysin guldnatriumthiomalat injektion |
||||||||||||
|
||||||||||||
|
||||||||||||
| Næringsstoffer | |
| Ingrediens navn | Styrke |
| benzylalkohol | |
| vand | |
| Pakning | ||||
| # | Artikelkode | Pakkebeskrivelse | ||
| 1 | NDC:17478-533-10 | 1 VIAL (1 VIAL) i 1 KARTON | ||
| 1 | 10 mL i 1 VIAL | |||
| 2 | NDC: 17478-533-10 | NDC: 17478-533-10 | 1 VIAL i 1 KARTON:17478-533-01 | 6 VIAL (6 VIAL) i 1 KARTON |
| 2 | 1 mL i 1 VIAL | |||
| Marketingoplysninger | |||
| Marketingkategori | Anmeldingsnummer eller henvisning til monografi | Startdato for markedsføring | Slutdato for markedsføring |
| Ugodkendt lægemiddel andet | 2204/2010 | ||
Mærkningssted – Akorn, Inc. (062649876)
| Etablering | ||||
| Navn | Adresse | ID/FEI | ID/FEI | Operationer |
| Akorn, Inc. | 155135783 | FABRIK, ANALYSE, PACK | ||
Mere om Myochrysin (guldnatriumthiomalat)
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- 1 anmeldelse
- Lægemiddelklasse: antirheumatika
Relaterede behandlingsvejledninger
- Rheumatoid artrit
Medicinsk ansvarsfraskrivelse