Die besten Pläne von Fruchtfliegen und Wissenschaftlern gehen manchmal schief. Zu solchen Plänen gehören Versuchspläne, bei denen Fruchtfliegenmodelle (oder andere Tiermodelle) als Ersatz für Menschen dienen sollen. Nach Angaben von Genetikern der Universität Toronto sind DNA-Abschnitte, so genannte Transkriptionsfaktoren (TFs), die als Landeplätze für regulatorische Proteine dienen, über die Arten hinweg weniger konserviert, als man früher dachte.
Die neuen Erkenntnisse, so die Wissenschaftler aus dem Labor von Timothy Hughes, PhD, deuten darauf hin, dass alle Studien, die Erkenntnisse über menschliche TFs liefern sollen, besondere Vorsicht walten lassen müssen, wenn sie sich auf Tiermodelle wie die Fruchtfliege oder Drosophila melanogaster stützen.
Positiv ist zu vermerken, dass die Wissenschaftler mit ihren Erkenntnissen faszinierende Möglichkeiten eröffnen. So könnte die Diversifizierung der Transkriptionsfaktoren zum Teil erklären, wie sich der Mensch entwickelt hat. Und die neuen Erkenntnisse könnten auch zu einem besseren Verständnis des Sexualdimorphismus führen, der sich auf die Unterschiede in der Größe oder im Aussehen zwischen den Geschlechtern bezieht, nicht aber auf die Unterschiede zwischen den Geschlechtsorganen.
In der Fachzeitschrift Nature Genetics („Similarity regression predicts evolution of transcription factor sequence specificity“) beschreibt das Team der Universität Toronto eine neue Berechnungsmethode, mit der es die Motivsequenzen, die jeder TF in vielen verschiedenen Arten bindet, genauer vorhersagen kann. Die Ergebnisse zeigen, dass einige Unterklassen von TFs funktionell sehr viel vielfältiger sind als bisher angenommen.
„Selbst zwischen eng verwandten Arten gibt es einen nicht zu vernachlässigenden Anteil von TFs, die wahrscheinlich neue Sequenzen binden“, sagte Sam Lambert, ehemaliger Doktorand in Hughes‘ Labor, der den Großteil der Arbeit an der Studie geleistet hat und inzwischen als Postdoktorand an der Universität Cambridge tätig ist. „Das bedeutet, dass sie wahrscheinlich neue Funktionen haben, indem sie verschiedene Gene regulieren, was für die Unterschiede zwischen den Arten wichtig sein könnte“, fügte er hinzu.
Selbst zwischen Schimpansen und Menschen, deren Genome zu 99 % identisch sind, gibt es Dutzende von TFs, die verschiedene Motive zwischen den beiden Arten in einer Weise erkennen, die die Expression von Hunderten von verschiedenen Genen beeinflussen würde. „Wir glauben, dass diese molekularen Unterschiede für einige der Unterschiede zwischen Schimpansen und Menschen verantwortlich sein könnten“, so Lambert.
In dem Nature Genetics-Artikel beschreiben die Wissenschaftler, wie sie die Ähnlichkeitsregression, eine deutlich verbesserte Methode zur Vorhersage von Motiven, zur Aktualisierung und Erweiterung der Cis-BP-Datenbank eingesetzt haben.
„Die Ähnlichkeitsregression quantifiziert inhärent die Entwicklung von TF-Motiven und zeigt, dass frühere Behauptungen über eine nahezu vollständige Erhaltung von Motiven zwischen Mensch und Drosophila übertrieben sind, wobei fast die Hälfte der Motive in jeder Spezies in der anderen fehlt, was größtenteils auf eine große Divergenz bei C2H2-Zinkfingerproteinen zurückzuführen ist“, schreiben die Autoren. „Wir kommen zu dem Schluss, dass die Diversifizierung von DNA-bindenden Motiven weit verbreitet ist, und stellen ein neues Werkzeug und eine aktualisierte Ressource zur Untersuchung der TF-Vielfalt und der Genregulierung bei Eukaryonten vor.“
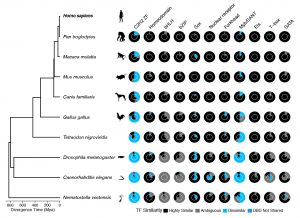
Lambert hat eine Software entwickelt, die nach strukturellen Ähnlichkeiten zwischen den DNA-Bindungsregionen der TFs sucht, die sich auf ihre Fähigkeit beziehen, die gleichen oder unterschiedliche DNA-Motive zu binden. Wenn zwei TFs aus verschiedenen Arten eine ähnliche Zusammensetzung von Aminosäuren, den Bausteinen von Proteinen, aufweisen, binden sie wahrscheinlich ähnliche Motive. Aber im Gegensatz zu älteren Methoden, die diese Regionen als Ganzes vergleichen, weist Lambert automatisch denjenigen Aminosäuren – einem Bruchteil der gesamten Region – einen höheren Wert zu, die in direktem Kontakt mit der DNA stehen. In diesem Fall können zwei TFs insgesamt ähnlich aussehen, aber wenn sie sich in der Position dieser Schlüsselaminosäuren unterscheiden, ist es wahrscheinlicher, dass sie unterschiedliche Motive binden. Als Lambert alle TFs verschiedener Spezies verglich und mit allen verfügbaren Motivsequenzdaten abglich, stellte er fest, dass viele menschliche TFs andere Sequenzen erkennen – und daher andere Gene regulieren – als Versionen der gleichen Proteine in anderen Tieren.
Dieser Befund steht im Widerspruch zu früheren Forschungsergebnissen, wonach fast alle TFs des Menschen und der Fruchtfliege die gleichen Motivsequenzen binden, und ist ein Aufruf zur Vorsicht für Wissenschaftler, die hoffen, Erkenntnisse über menschliche TFs zu gewinnen, indem sie nur ihre Gegenstücke in einfacheren Organismen untersuchen.
„Es gibt diese Vorstellung, die sich hartnäckig gehalten hat, nämlich dass die TFs beim Menschen und bei der Fruchtfliege fast identische Motive binden“, sagte Hughes, der Professor an der Universität von Toronto ist. „Und obwohl es viele Beispiele gibt, in denen diese Proteine funktionell konserviert sind, ist dies keineswegs in dem Maße der Fall, wie es angenommen wurde.“
Die TFs, die beim Menschen eine einzigartige Rolle spielen, gehören zu der sich schnell entwickelnden Klasse der so genannten C2H2-Zinkfinger-TFs, benannt nach den zinkionenhaltigen, fingerartigen Ausstülpungen, mit denen sie die DNA binden.
Ihre Rolle bleibt eine offene Frage, aber es ist bekannt, dass Organismen mit einer größeren Vielfalt an TFs auch mehr Zelltypen haben, die auf neuartige Weise zusammenkommen können, um kompliziertere Körper zu bilden.
Hughes ist begeistert von der verlockenden Möglichkeit, dass einige dieser Zinkfinger-TFs für die einzigartigen Merkmale der menschlichen Physiologie und Anatomie verantwortlich sein könnten – unser Immunsystem und das Gehirn, die die komplexesten unter den Tieren sind. Ein weiteres Thema ist der Sexualdimorphismus: die zahllosen sichtbaren und oft weniger offensichtlichen Unterschiede zwischen den Geschlechtern, die die Partnerwahl leiten – Entscheidungen, die sich unmittelbar auf den Fortpflanzungserfolg auswirken und auch langfristig tiefgreifende Auswirkungen auf die Physiologie haben können. Der Pfauenschwanz oder die Gesichtsbehaarung bei Männern sind klassische Beispiele für solche Merkmale.
„Fast niemand in der Humangenetik erforscht die molekularen Grundlagen des Geschlechtsdimorphismus, doch sind dies Merkmale, die alle Menschen aneinander sehen und die uns alle faszinieren“, so Hughes. „Ich bin versucht, die letzte Hälfte meiner Karriere damit zu verbringen, wenn ich herausfinden kann, wie man das macht!“