Wzrost mikroorganizmów
Jak omówiono w niebieskich/zielonych poziomach tego rozdziału, komórki mikroorganizmów wykorzystują składniki odżywcze do wzrostu, produkcji energii i tworzenia produktów, jak wskazano w następującym wyrażeniu;
Składniki odżywcze + komórki mikroorganizmów >wzrost komórek + energia + produkty reakcji
Rozważmy działanie systemu „Batch” pokazanego na Rysunku 1. Pojemnik ten zawiera początkowo znane stężenie substratu wzrostu S. Pojemnik jest dobrze wymieszany i dlatego stężenie rozpuszczonego tlenu O2 nie staje się czynnikiem ograniczającym dla wzrostu mikroorganizmów. Początkowo do pojemnika dodawane jest znane stężenie X żywych komórek mikroorganizmów (tj. inokulum) i z czasem substrat wzrostu S jest wykorzystywany do wzrostu komórek. Dlatego z czasem będziemy obserwować spadek S (ujemne dS/dt) i odpowiadający mu wzrost X (dodatnie dX/dt).
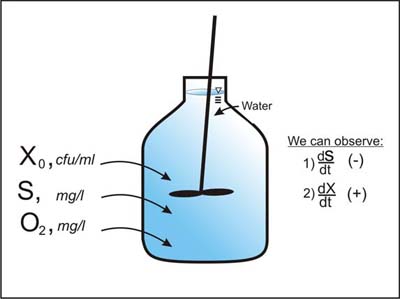
A. Cunningham, Center for Biofilm Engineering, Montana State Univeristy, Bozeman, MT
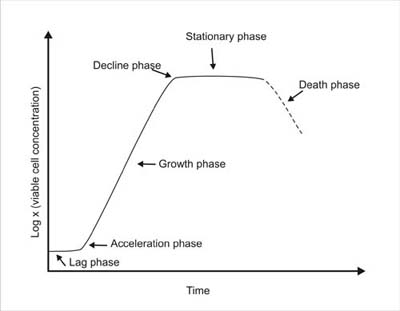
Koncepcyjny wykres stężenia komórek mikroorganizmów w funkcji czasu dla systemu wsadowego nazywany jest krzywą wzrostu, jak pokazano na rysunku 2.
A. Cunningham, Center for Biofilm Engineering, Montana State Univeristy, Bozeman, MT
Wykreślając logarytm stężenia żywych komórek, X, z czasem, można zidentyfikować pięć wyraźnych faz krzywej wzrostu; 1) fazę opóźnienia, która występuje natychmiast po inokulacji i trwa do czasu, gdy komórki zaaklimatyzują się w nowym środowisku, 2) fazę wzrostu wykładniczego, podczas której wzrost komórek postępuje w tempie wykładniczym (wskazanym przez linię prostą na wykresie półlogarytmicznym), 3) fazę spowolnienia, gdy podstawowe składniki odżywcze są wyczerpane lub zaczynają się gromadzić produkty toksyczne, 4) fazę stacjonarną, podczas której wzrost netto komórek wynosi w przybliżeniu zero, oraz 5) fazę śmierci, w której niektóre komórki tracą żywotność lub są niszczone przez lizę.
Kinetyka wzrostu drobnoustrojów
Podczas fazy lag dX/dt i dS/dt wynoszą zasadniczo zero. Jednakże, gdy rozpoczyna się faza wzrostu wykładniczego, możliwe jest zmierzenie wartości dX/dt i dS/dt, które są bardzo przydatne do określenia ważnych parametrów kinetycznych mikroorganizmów. Wykorzystując odpowiednie obserwacje dS/dt i dX/dt uzyskane tuż po rozpoczęciu fazy wzrostu wykładniczego na Rysunku 2 możemy obliczyć współczynnik wydajności YXS i specyficzną szybkość wzrostu µ jako:
Współczynnik wydajności
![]() (1)
(1)
Szczególne tempo wzrostu
![]() (2)
(2)
Współczynnik wydajności, powszechnie określany jako wydajność substratu do biomasy, jest używany do konwersji między tempem wzrostu komórek dX/dt a tempem wykorzystania substratu dS/dt. Współczynnik wydajności i specyficzna szybkość wzrostu są wykorzystywane do opracowania trzech typów kinetycznych zależności wzrostu mikroorganizmów; Kinetyka Monoda, Kinetyka pierwszego rzędu i Kinetyka zerowego rzędu.
Kinetyka Monoda
Doświadczenie wsadowe pokazane na Rysunku 1 może być powtórzone przez zmianę początkowego stężenia substratu S w szerokim zakresie wartości- skutkując obserwacją indywidualnych wartości µ, które odpowiadają każdemu stężeniu substratu. Wykres arytmetyczny µ vs S będzie wykazywał ogólne zachowanie przedstawione na rysunku 3.
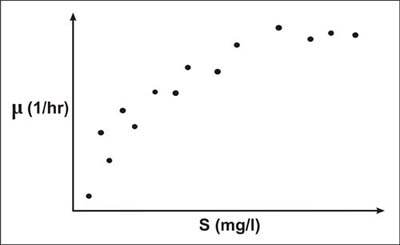
A. Cunningham, Center for Biofilm Engineering, Montana State Univeristy, Bozeman, MT
Najpowszechniej stosowane wyrażenie opisujące specyficzną szybkość wzrostu jako funkcję stężenia substratu przypisuje się Monodowi (1942, 1949). To wyrażenie to:
![]() (3)
(3)
Rysunek 4. Pokazuje koncepcyjnie, jak równanie Monoda jest dopasowane do obserwowanych danych dotyczących substratu i specyficznego tempa wzrostu na rysunku 3. Na rysunku 4 widać, że µmax jest maksymalnym zaobserwowanym specyficznym tempem wzrostu, a KS jest stężeniem substratu odpowiadającym 1/2 µmax.
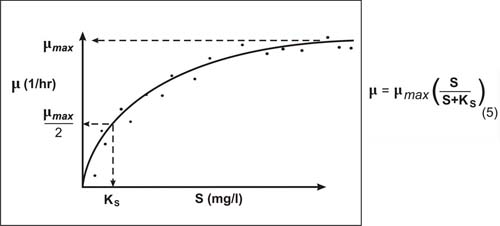
A. Cunningham, Center for Biofilm Engineering, Montana State Univeristy, Bozeman, MT
Kinetyka Monoda
Łącząc równania 2 i 3 możemy napisać następujące wyrażenie na szybkość zmian biomasy w czasie:
![]() (4)
(4)
Podobnie, łącząc równania 1 i 3 możemy napisać wyrażenie na szybkość wykorzystania substratów.
![]() (5)
(5)
Kinetyka pierwszego rzędu
Równanie 5 opisuje zależność kinetyczną Monoda dla utylizacji substratu. Z rysunku 4 można zauważyć, że jeżeli S << KS , równanie 5 można przybliżyć jako:
![]() (6)
(6)
Równanie 6 opisuje warunek, w którym wykorzystanie substratu jest proporcjonalne do stężenia substratu (tj. pierwszego rzędu w odniesieniu do S).
Kinetyka zerowego rzędu
Podobnie, jeśli S >> KS Równanie 5 można przybliżyć jako:
![]() (7)
(7)
Równanie 7 opisuje warunek, w którym szybkość utylizacji substratu jest stałą (tj. zerowego rzędu względem S).
.