Introduction
La synthèse facile et efficace de molécules biologiquement actives est l’un des principaux objectifs de la chimie organique et médicinale. Ces dernières années, les réactions multicomposantes sont devenues l’un des outils importants dans la synthèse de bibliothèques chimiques structurellement diverses de molécules organiques polyfonctionnelles de type médicament . En outre, les réactions multicomposantes offrent l’avantage de la simplicité et de l’efficacité synthétique par rapport aux réactions chimiques conventionnelles sous plusieurs aspects. Les MCR permettent la construction de bibliothèques combinatoires de molécules organiques complexes pour une identification et une optimisation efficaces de la structure principale dans la découverte de médicaments .
Dans la suite de nos travaux de recherche en cours sur la synthèse assistée par micro-ondes de nanomatériaux, nous avons constaté que, les oxydes métalliques nanocristallins ont attiré une attention considérable des chimistes synthétiques et médicinaux en raison de leur haute activité catalytique et de leur réutilisabilité . L’oxyde de zinc est un matériau peu coûteux, stable à l’humidité, réutilisable, disponible dans le commerce, non toxique et insoluble dans les solvants polaires et non polaires. Une large gamme de réactions organiques qui incluent les réarrangements de Beckmann, la N-benzylation, l’acylation, la déshydratation des oximes, les réactions d’ouverture de cycle nucléophile des époxydes, la synthèse de l’urée cyclique, la N-formylation des amines. En particulier, l’oxyde nano-ZnO cristallin présente une meilleure activité catalytique par rapport à ses homologues en vrac.
Ces dernières années, une grande attention a été portée à la synthèse des composés de dihydropyridine en raison de leur énorme application dans divers domaines de recherche, y compris la science biologique et la chimie médicinale. De nombreux DHP sont déjà des produits commerciaux tels que l’amlodipine, la félodipine, l’isradipine, la lacidipine, la nicardipine, la nitrendipine, la nifédipine et la nimodipine B, dont la nitrendipine et la nimodipine B présentent de puissantes activités de blocage des canaux calciques (Figure 1) et sont devenus l’une des classes de médicaments les plus importantes pour le traitement des maladies cardiovasculaires. De plus, les dérivés de la dihydropyridine possèdent une variété d’activités biologiques telles que des activités géroprotectrices, hépatoprotectrices, anti-athérosclérotiques, antitumorales et antidiabétiques. De nombreuses études ont révélé que les composés contenant des unités de dihydropyridine présentent diverses fonctions médicinales telles que des neuroprotecteurs, une activité antiagrégante plaquettaire, une activité anti ischémique cérébrale dans le traitement de la maladie d’Alzheimer, un chimiosensibilisateur dans la thérapie tumorale. Modificateurs de résistance aux médicaments, antioxydants et un médicament pour le traitement de l’incontinence urinaire par impériosité .
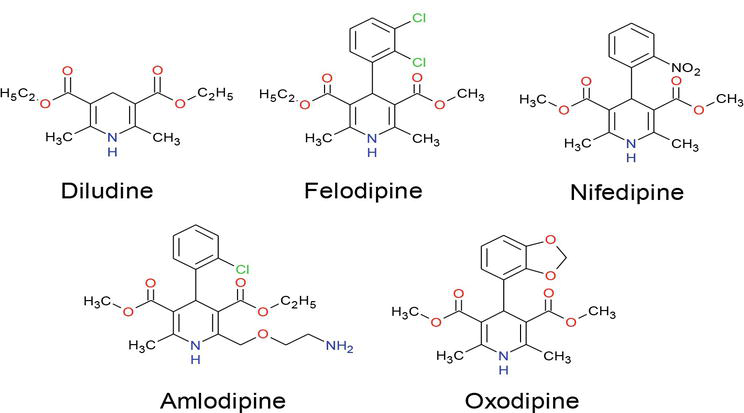
Figure 1.
Médicaments contenant des fragments de 1,4-DHP.
Afin de modéliser et de comprendre ces propriétés biologiques et de développer de nouveaux agents chimiothérapeutiques basés sur les composés 1,4-DHP, des efforts importants ont été consacrés à établir des méthodes efficaces pour leur synthèse. Généralement, les 1,4-DHPs ont été synthétisés par la méthode de Hantzsch, qui implique la cyclocondensation d’un aldéhyde, d’un β-cétoester et de l’ammoniac, soit dans l’acide acétique, soit sous reflux dans des alcools, pendant de longues périodes de réaction, ce qui conduit généralement à de faibles rendements. D’autres méthodes comprennent l’utilisation de micro-ondes , de températures élevées à reflux , d’organocatalyseurs et de triflates métalliques .
Récemment, l’ADN est une cible importante des médicaments et il régule de nombreux processus biochimiques qui se produisent dans le système cellulaire. Les interactions des petites molécules avec l’ADN continuent d’être intensément et largement étudiées pour leur utilité en tant que sondes de la réplication cellulaire et de la régulation transcriptionnelle et pour leur potentiel en tant que produits pharmaceutiques . En particulier, la conception de composés basés sur leur capacité à cliver l’ADN est d’une grande importance non seulement du point de vue de la biologie primaire mais aussi en termes d’approche thérapeutique photodynamique pour développer des médicaments puissants. Les dérivés de la 1,4-dihydropyridine ont attiré l’attention des chimistes en raison de leurs diverses applications biologiques. L’importance biologique de cette classe de composés nous a incités à étendre cette série en travaillant sur la synthèse et les études de photoclivage de l’ADN des dérivés de la 1,4-dihydropyridine. Dans cette communication, la synthèse de dérivés de 1,4-dihydropyridine et leurs études de photoclivage de l’ADN et de docking moléculaire ont été rapportées.
Dans la littérature, il existe plusieurs méthodes connues pour la synthèse de dérivés de 1,4-dihydropyridine. Dans la continuité de notre programme sur la chimie des nanomatériaux, nous rapportons ici une méthode efficace par micro-ondes pour la synthèse de ZnO-NPs cristallins. Le ZnO utilisé dans ce travail a été synthétisé selon une méthode modifiée. Les nanoparticules de ZnO cristallines préparées ont été caractérisées par XRD, SEM et EDX (Figure 2). Notre approche synthétique a commencé par la condensation de 1 équiv. de benzaldéhyde 1a avec 2 équiv. d’acétoacétate d’éthyle 2a et 2 équiv. de NH4OAc 3a en présence de ZnO-Nps, ce qui a entraîné la formation de la 1,4-dihydropyridine de Hantzsch 4a (Figure 3). La réaction a été complète en 5 min sous irradiation micro-ondes et le produit a été isolé par la méthode habituelle, avec un rendement de 90% et une grande pureté. Dans des conditions similaires, divers aldéhydes aromatiques substitués portant des substituants donneurs ou attracteurs d’électrons ont réagi avec des 1,3-dicétones pour former des 1,4-DHPs dans des rendements bons à excellents, et les résultats sont résumés dans le tableau 1.
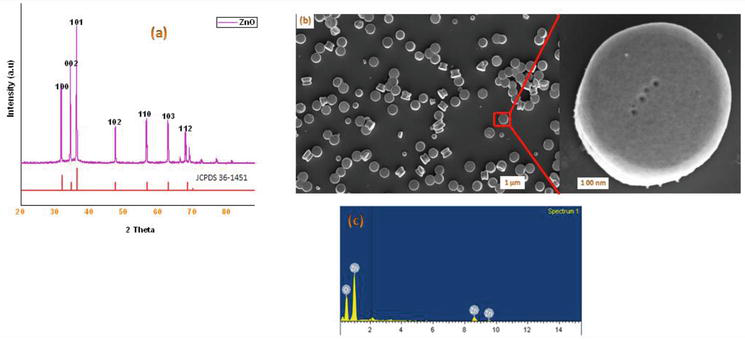
Figure 2.
(a) XRD en poudre des nanoparticules de ZnO obtenues par la méthode des micro-ondes ; (b) images SEM des ZnO-NPs ; (c) spectre d’analyse EDX des nanoparticules de ZnO obtenues par la méthode des micro-ondes.
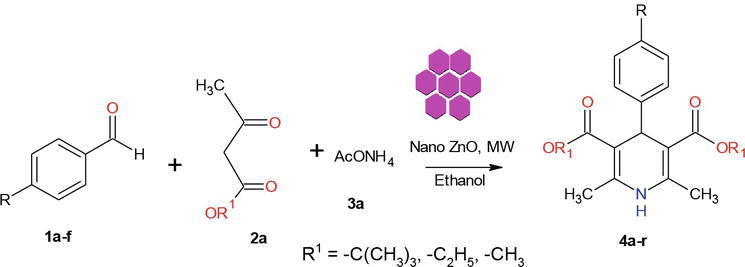
Figure 3.
Synthèse des 1,4-dihydropyridines.
| Entréea | R | R1 | Produits | Entréea | Rendement (%)b |
|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 |
| 2 | 4-MeO-C6H5 | t-Bu | 4b | 2 | 95 |
| 3 | 4-OH-C6H5 | t-Bu | 4c | 3 | 95 |
| 4 | 4-F-C6H5 | t-Bu | 4d | 4 | 95 |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 |
| 7 | C6H5 | Et | 4 g | 7 | 90 |
| 8 | 4-MeO-C6H5 | Et | 4 h | 8 | 95 |
| 9 | 4-OH-C6H5 | Et | 4i | 9 | 92 |
| 10 | 4-F-C6H5 | Et | 4j | 10 | 92 |
| 11 | 4-Cl-C6H5 | Et | 4 k | 11 | 90 |
| 12 | 4-NO2-C6H5 | Et | 4 l | 12 | 90 |
| 13 | C6H5 | Me | 4 m | 13 | 90 |
| 14 | 4-MeO-C6H5 | Me | 4n | 14 | 87 |
| 15 | 4-OH-C6H5 | Me | 4o | 15 | 90 |
| 16 | 4-F-C6H5 | Me | 4p | 16 | 90 |
| 17 | 4-Cl-C6H5 | Me | 4q | 17 | 90 |
| 18 | 4-NO2-C6H5 | Me | 4r | 18 | 90 |
Tableau 1.
Synthèse de 1,4-dihydropyridines.
aTous les produits ont été caractérisés par des études de RMN 1H et RMN 13C et comparés aux mps de la littérature. bRendement des produits isolés
Un procédé assisté par irradiation micro-ondes minimise très souvent la formation de sous-produits et nécessite beaucoup moins de temps que les méthodes thermiques. Les principaux avantages de la réalisation de réactions dans des conditions contrôlées dans des récipients scellés sont les améliorations significatives de la vitesse et les rendements de produits plus élevés qui peuvent fréquemment être obtenus. Par conséquent, dans la continuité de nos études sur la synthèse par micro-ondes de nanomatériaux , nous avons tenté de développer un protocole rapide, assisté par micro-ondes, pour la synthèse de 1,4-DHPs en utilisant un nanocatalyseur ZnO cristallin (Figure 3).
Le clivage de l’ADN des dérivés de 1,4-DHP a été étudié par électrophorèse sur gel d’agarose. Lorsque l’ADN plasmidique circulaire a été soumis à l’électrophorèse, une migration relativement rapide a été observée pour l’ADN super enroulé intact (type I). Si la scission se produit sur un brin (nicking), l’ADN superenroulé se détend pour générer une forme circulaire ouverte se déplaçant plus lentement (type II). Si les deux brins sont clivés, une forme linéaire (type III) qui migre entre le type I et le type II sera générée. La conversion du type I (superenroulé) en type II (circulaire entaillé) a été observée avec différentes concentrations de 1,4-DHP et irradiée pendant 2 h, dans un mélange 1:9 DMSO/trisbuffer (20 μM, pH- 7,2) à 365 nm. Aucun clivage de l’ADN n’a été observé pour le contrôle dans lequel le 1,4-DHP était absent (voie 1) (Figure 4). Avec l’augmentation de la concentration de ces 1,4-DHP, la quantité d’ADN de type I de pUC 19 a diminué progressivement, alors que le type II a augmenté (Figure 4).
À une concentration de 40 μM, le composé (4c) ne peut favoriser que 30 % de conversion de l’ADN de type I en type II (Figure 5). À la concentration de 80 μM, le composé (4c) peut presque promouvoir la conversion d’environ 80 % de l’ADN de type I à II (figure 5). Le potentiel de clivage des composés testés a été évalué en comparant les bandes apparues dans le contrôle et les composés testés à la concentration de 80 μM. Cependant, les autres dérivés présentent une efficacité de clivage beaucoup plus faible pour l’ADN pUC 19. Même à la concentration de 80 μM, il ne peut favoriser que 40% de conversion de l’ADN de type I à II (Figure 5).
Mais à des concentrations plus élevées autour de 130 μM, les composés se précipitent et il n’y a pas de moment dans l’ADN. L’image (figure 6) démontre clairement que les composés (4b, 4c, 4d, 4e, 4f et 4 g) présentent un clivage de l’ADN de pUC19 à une concentration de 80 μM. Les résultats indiquent que les composés portant -OCH3 et -OH en position -para du cycle phényle (C-6) ont clivé l’ADN complètement, les autres composés ont montré un clivage presque complet de l’ADN. Dans l’ensemble, cela indique que les groupes alcoxy sont des radicaux très réactifs, qui attirent efficacement les atomes d’hydrogène en C-4′ du 2-désoxyribose. Il est intéressant de noter que le groupe hydroxyle a été signalé pour apporter des dommages à l’ADN médiés par les radicaux d’oxygène en présence de photoirradiation .
Les études de relation structure-activité des 1,4-DHPs en ce qui concerne les études de photoclivage de l’ADN montre que, les changements dans le modèle de substitution aux positions C-3, C-4, et C-5 modifient le cycle 1,4-DHP. Osiris Property Explorer est un outil de prédiction d’activité basé sur la connaissance qui prédit la probabilité d’un médicament, le score du médicament et les propriétés indésirables telles que les effets mutagènes, tumorigènes, irritants et reproductifs des nouveaux composés basés sur les données de fragments chimiques de médicaments et de non-médicaments disponibles, comme indiqué (Tableau 2). Il a été observé que les composés ayant des groupes aliphatiques tels que -CH3, -COOCH3, -COOC2H5 et -COOC(CH3)3, attachés à C-2 et C-3 du 1,4-DHP ont montré une bonne activité. D’autres dérivés possédant un substituant donneur d’électrons, tel qu’un groupe hydroxy ou méthoxy sur le cycle phényle (C-6), augmentent l’activité de photoclivage de l’ADN. Une paire d’électrons solitaires sur l’atome d’oxygène du groupe méthoxy se délocalise dans l’espace π du cycle benzénique, augmentant ainsi l’activité. De même, les substituants qui retirent des électrons, comme le 4-fluorophényle, le 4-chlorophényle du 1,4-DHP, diminuent l’activité. Ces résultats indiquent que les substituants alcoxy et l’azote du cycle pyridine dans la structure du 1,4-DHP sont responsables du clivage de l’ADN.
Afin de rationaliser les résultats spectroscopiques observés et de mieux comprendre la modalité d’intercalation, les 1,4-DHP (4a-r) ont été successivement dockés dans le duplex d’ADN de séquence d(CGCGAATTCGCG)2 dodécamère (PDB ID : 1BNA) afin de prédire le site de liaison choisi ainsi que l’orientation préférée du ligand à l’intérieur du sillon mineur de l’ADN. Tous les dérivés synthétisés du 1,4-DHP ont été dessinés dans ChemSketch et les structures ont été enregistrées au format .mol. Ensuite, le format .mol a été utilisé dans Hyperchem-7, pour ajuster leurs fragments, suivi d’une minimisation de l’énergie totale des ligands afin qu’ils puissent atteindre une conformation stable et le fichier a été enregistré au format .pdb.
La structure 3D protéique du B-DNA a été obtenue à partir de RCSB PDB (un portail d’information sur les structures macromoléculaires biologiques). Les molécules d’eau ont été retirées du fichier, et la protéine a été protonée en 3D pour ajouter des hydrogène polaires. La poche de liaison a été identifiée à l’aide du site finder, et les résidus respectifs ont été sélectionnés. Les paramètres de docking ont été réglés sur les valeurs par défaut et l’algorithme de notation, les cycles de docking ont été maintenus à 30 conformations par ligand. Les structures protéiques arrimées ont été enregistrées au format .pdb, et les conformations des ligands ont été étudiées une par une. Les complexes avec les meilleures conformations ont été sélectionnés sur la base du score le plus élevé, de l’énergie de liaison la plus faible et des valeurs RMSD minimales .
Les composés organiques synthétisés exercent leur activité biologique plus efficacement en se liant aux protéines ou à l’ADN respectifs sur leur site de liaison spécifique. L’identification des résidus d’interaction avec les ligands est une étape nécessaire vers la conception rationnelle de médicaments, la compréhension de la voie moléculaire et l’action mécaniste de la protéine.
Le docking moléculaire a été effectué entre la protéine réceptrice rigide et les ligands flexibles. Le tableau 3 montre les détails des résultats du docking, y compris les valeurs de RMSD et d’énergie de liaison des complexes protéine-ligand. Les ligands (4b, 4c, 4 h, 4i, 4n et 4o) se lient fortement à l’ADN-B comme le déduisent leurs valeurs d’énergie de liaison minimale, soit -13,8, -12,9 et – 12,3 kcal/mol, respectivement (Figure 7).
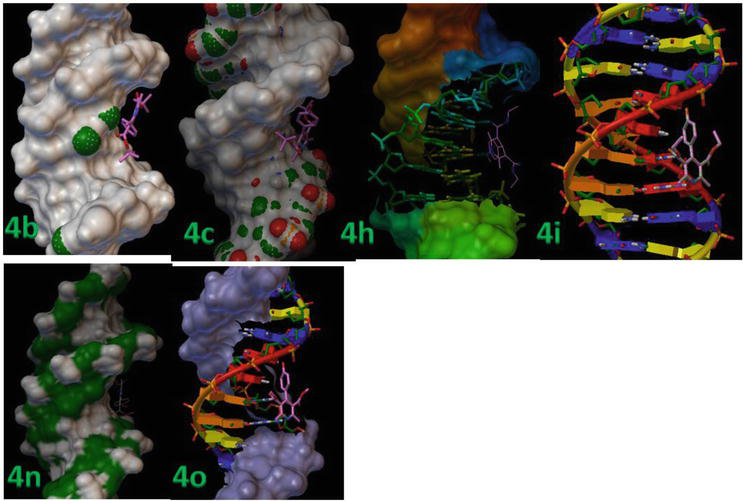
Figure 7.
Le 1,4-DHP a été successivement docké au sein du duplex d’ADN de séquence d(CGCGAATTCGCG)2 dodécamère (PDB ID : 1BNA).
Figure 8 montre la position du site actif dans la structure hélicoïdale de l’ADN et elle montre également que tous les ligands dockés se sont regroupés à l’intérieur de la poche. La figure 8 présente l’interaction par liaison hydrogène de 4c et 4d avec les résidus clés du site actif à l’intérieur de la structure hélicoïdale de l’ADN. Dans ce modèle, il est clairement indiqué que le composé 4c a formé une liaison hydrogène entre le -OH et le N1 de la thymine, qui sont DT7 et DT19 avec la longueur de liaison de 2,02 et 2,05 Ǻ respectivement. De plus, les autres dérivés du 1,4-DHP ont formé moins d’interaction de liaison H avec l’ADN en raison de l’orientation du cycle aromatique impliqué dans les interactions de van der Waals (modèle Wireframe) et des régions hydrophobes plates des sites de liaison de l’ADN (Tableau 3). Ces résultats ont démontré que les études in silico de docking moléculaire des 1,4-DHP avec l’ADN-B suggèrent que les 1,4-DHP possèdent le potentiel de perturber les interactions hydrophobes et de liaison H affectant ainsi la stabilité de la fixation de l’ADN-B, et peuvent être efficaces pour les lignées de cellules cancéreuses.
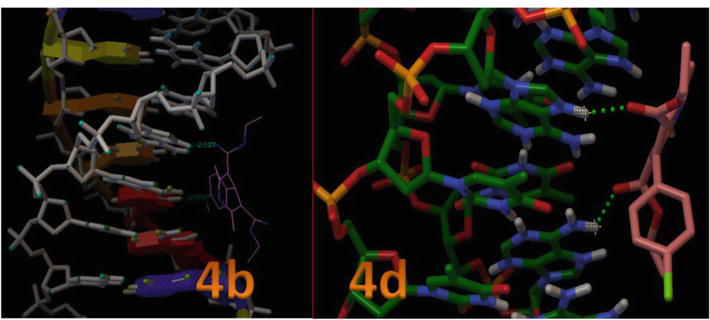
Figure 8.
Interaction du 1,4-DHP avec le duplex d’ADN de séquence d(CGCGAATTCGCG)2 dodécamère (PDB ID : 1BNA).
.