Introducere
Sinteza facilă și eficientă a moleculelor biologic active este unul dintre obiectivele principale ale chimiei organice și medicinale. În ultimii ani, reacțiile multicomponente au devenit unul dintre instrumentele importante în sinteza unor biblioteci chimice diverse din punct de vedere structural de molecule organice polifuncționale de tip medicament . În plus, MCR-urile oferă avantajul simplității și eficienței sintetice față de reacțiile chimice convenționale în mai multe aspecte. MCR-urile permit construirea de biblioteci combinatoriale de molecule organice complexe pentru o identificare și optimizare eficientă a structurilor conducătoare în descoperirea de medicamente.
În continuarea activității noastre de cercetare în curs de desfășurare privind sinteza asistată de microunde a nanomaterialelor, am constatat că, oxizii metalici nanocristalini au atras o atenție considerabilă a chimiștilor sinteticieni și medicaliști datorită activității lor catalitice ridicate și a posibilității de reutilizare. Oxidul de zinc este un oxid de zinc ieftin, stabil la umiditate, reutilizabil, disponibil în comerț și este netoxic, insolubil în solvenți polari și nepolari. O gamă largă de reacții organice care includ rearanjamente Beckmann , N-benzilarea , acilarea , deshidratarea omezelor , reacții nucleofile de deschidere a inelului de epoxizi , sinteza ureei ciclice , N-formilarea aminelor . În special nano-oxidul de ZnO cristalin prezintă o activitate catalitică mai bună în comparație cu omologii lor de dimensiuni mari.
În ultimii ani, o mare atenție a fost îndreptată spre sinteza compușilor dihidropiridinici datorită aplicațiilor lor extraordinare în diferite domenii de cercetare, inclusiv în științele biologice și chimia medicală. Multe DHP sunt deja produse comerciale, cum ar fi: amlodipina, felodipina, isradipina, lacidipina, nicardipina, nitrendipina, nifedipina și nimodipina B, dintre care nitrendipina și nemadipina B prezintă activități puternice de blocare a canalelor de calciu (figura 1) și au apărut ca una dintre cele mai importante clase de medicamente pentru tratamentul bolilor cardiovasculare . În plus, derivații de dihidropiridină posedă o varietate de activități biologice, cum ar fi activități geroprotectoare, hepatoprotectoare, antiaterosclerotice, antitumorale și antidiabetice . Studii pe scară largă au scos la iveală faptul că compușii care conțin unități de dihidropiridină prezintă diverse funcții medicinale, cum ar fi neuroprotector, activitate antiagregantă plachetară, activitate antiischemică cerebrală în tratamentul bolii Alzheimer, chimiosensibilizator în terapia tumorală . Modificatori de rezistență la medicamente , antioxidanți și un medicament pentru tratamentul incontinenței urinare de urgență .
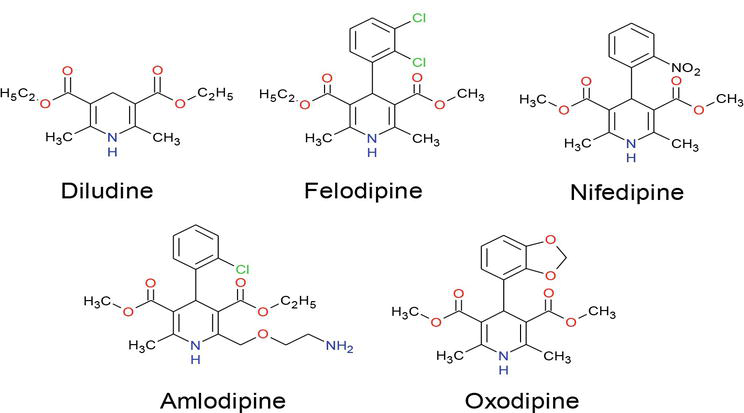
Figura 1.
Medicamente care conțin fracțiuni 1,4-DHP.
Pentru a modela și înțelege aceste proprietăți biologice și pentru a dezvolta noi agenți chimioterapeutici pe baza compușilor 1,4-DHP, au fost depuse eforturi semnificative pentru a stabili metode eficiente de sinteză a acestora. În general, 1,4-DHP au fost sintetizate prin metoda Hantzsch , care implică ciclocondensarea unei aldehide, a unui β-cetoester și a amoniacului, fie în acid acetic, fie sub reflux în alcooli, pentru timpi de reacție lungi, ceea ce duce, de obicei, la randamente scăzute . Alte metode cuprind utilizarea de microunde , temperaturi ridicate la reflux , organocatalizatori și triflați metalici .
În ultimul timp, ADN-ul este o țintă importantă a medicamentelor și reglează multe procese biochimice care au loc în sistemul celular. Interacțiunile moleculelor mici cu ADN-ul continuă să fie intens și pe scară largă studiate pentru utilitatea lor ca sonde ale replicării celulare și ale reglării transcripționale și pentru potențialul lor ca produse farmaceutice . În special, proiectarea compușilor pe baza capacității lor de a scinda ADN-ul este de mare importanță nu numai din punct de vedere biologic primar, ci și din punct de vedere al abordării terapeutice fotodinamice pentru a dezvolta medicamente puternice . Derivații de 1,4-Dihidropiridină au atras atenția chimiștilor datorită diverselor lor aplicații biologice . Semnificația biologică a acestei clase de compuși ne-a impulsionat să extindem această serie lucrând la sinteza și studiile de fotocleavare a ADN-ului derivaților de 1,4-dihidropiridină. În această comunicare, a fost raportată sinteza derivaților de 1,4-dihidropiridină și studiile de fotocleavage a ADN-ului și de docking molecular ale acestora.
În literatura de specialitate, există mai multe metode cunoscute pentru sinteza derivaților de 1,4-dihidropiridină. În continuarea programului nostru privind chimia materialelor nanometrice, în prezentul raport prezentăm o metodă eficientă cu microunde pentru sinteza de ZnO-NPs cristaline. ZnO utilizat în această lucrare a fost sintetizat în conformitate cu o metodă modificată. Nanoparticulele cristaline de ZnO pregătite au fost caracterizate folosind XRD pentru pulberi, SEM, EDX (Figura 2). Abordarea noastră sintetică a început cu condensarea a 1 echiv. de benzaldehidă 1a cu 2 echiv. de acetoacetat de etil 2a și 2 echiv. de NH4OAc 3a în prezența de ZnO-NPs, ceea ce a dus la formarea 1,4-dihidropiridinei Hantzsch 4a (Figura 3). Reacția a fost completă în 5 minute sub iradiere cu microunde, iar produsul a fost izolat prin procedeul obișnuit de prelucrare, cu un randament de 90% și o puritate ridicată. În condiții similare, diverse aldehide aromatice substituite purtătoare de substituenți donatori sau retractori de electroni au reacționat cu 1,3-dicetone pentru a forma 1,4-DHP în randamente bune până la excelente, iar rezultatele sunt rezumate în tabelul 1.
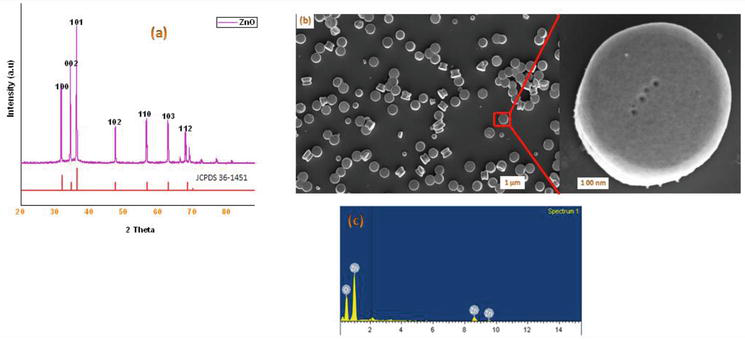
Figura 2.
(a) Pulberea XRD a nanoparticulelor de ZnO obținute prin metoda cu microunde; (b) Imagini SEM ale ZnO-NPs; (c) Spectrul de analiză EDX al nanoparticulelor de ZnO obținute prin metoda cu microunde.
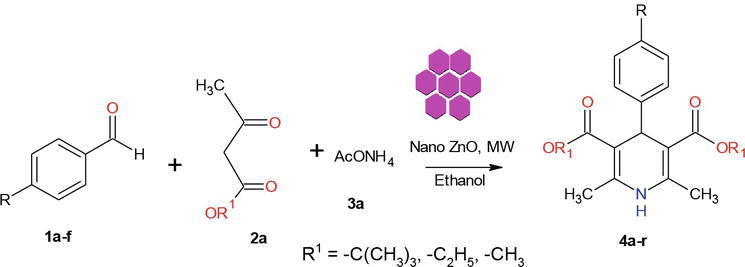
Figura 3.
Sinteza 1,4-dihidropiridinelor.
| Entrya | R | R1 | Produse | Produse | Entrya | Randament (%)b |
|---|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 | |
| 2 | 4-MeO-C6H5 | t-Bu | 4b | 2 | 95 | |
| 3 | 4-OH-C6H5 | t-Bu | 4c | 3 | 95 | |
| 4 | 4-F-.C6H5 | t-Bu | 4d | 4 | 95 | |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 | |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 | |
| 7 | C6H5 | Et | 4 g | 7 | 90 | 90 |
| 8 | 4-MeO-C6H5 | Et | 4 h | 8 | 95 | |
| 9 | 4-OH-.C6H5 | Et | 4i | 9 | 92 | |
| 10 | 4-F-C6H5 | Et | 4j | 10 | 92 | |
| 11 | 4-.Cl-C6H5 | Et | 4 k | 11 | 90 | |
| 12 | 4-.NO2-C6H5 | Et | 4 l | 12 | 90 | |
| 13 | C6H5 | Me | 4 m | 13 | 90 | |
| 14 | 4-.MeO-C6H5 | Me | 4n | 14 | 87 | |
| 15 | 4-OH-.C6H5 | Me | 4o | 15 | 90 | |
| 16 | 4-F-C6H5 | Me | 4p | 16 | 90 | |
| 17 | 4-.Cl-C6H5 | Me | 4q | 17 | 90 | |
| 18 | 4-NO2-.C6H5 | Me | 4r | 18 | 90 |
Tabelul 1.
Sinteza 1,4-dihidropiridinelor.
aToți produșii au fost caracterizați prin studii 1H RMN și 13C RMN și comparați cu mps din literatură. bCâștigurile produselor izolate
Un proces asistat de iradierea cu microunde minimizează foarte des formarea de subproduse și necesită mult mai puțin timp decât metodele termice. Principalele avantaje ale efectuării reacțiilor în condiții controlate în recipiente închise ermetic sunt creșterile semnificative ale vitezei și randamentele mai mari ale produselor care pot fi frecvent obținute. Prin urmare, în continuarea studiilor noastre privind sinteza cu microunde a nanomaterialelor , am încercat să dezvoltăm un protocol rapid, asistat de microunde, pentru sinteza 1,4-DHP folosind un catalizator cristalin ZnO-nano (Figura 3).
Cuplarea ADN a derivaților 1,4-DHP a fost studiată prin electroforeză pe gel de agaroză. Atunci când ADN-ul plasmidic circular a fost supus electroforezei, a fost observată o migrare relativ rapidă pentru ADN-ul supraînfășurat intact (tip I). În cazul în care are loc scindarea unui fir (nicking), ADN-ul supraînfășurat se va relaxa pentru a genera o formă circulară deschisă cu mișcare mai lentă (tip II). Dacă ambele șiruri sunt scindate, se va genera o formă liniară (tip III) care migrează între tipul I și tipul II . Conversia tipului I (supraînfășurat) în tipul II (circular crestat) a fost observată cu diferite concentrații de 1,4-DHP și iradiat timp de 2 h, în 1:9 DMSO/trisbuffer (20 μM, pH- 7,2) la 365 nm. Nu s-a observat nicio scindare a ADN-ului pentru martorul în care 1,4-DHP a fost absent (banda 1) (figura 4). Odată cu creșterea concentrației acestor 1,4-DHP, cantitatea de ADN de tip I din pUC 19 a scăzut treptat, în timp ce tipul II a crescut (figura 4).
La o concentrație de 40 μM, compusul (4c) poate promova doar 30% din conversia ADN-ului din tipul I în II (figura 5). La concentrația de 80 μM, compusul (4c) poate promova aproape 80% din conversia ADN-ului de la tipul I la II (Figura 5). Potențialul de scindare al compușilor testați a fost evaluat prin compararea benzilor apărute în compușii de control și în compușii testați la concentrația de 80 μM. Cu toate acestea, ceilalți derivați prezintă o eficiență de clivare mult mai mică pentru ADN-ul pUC 19. Chiar și la concentrația de 80 μM, poate promova doar 40% din conversia ADN-ului din tipul I în II (Figura 5).
Dar la concentrații mai mari, în jur de 130 μM, compușii se precipită și nu există niciun moment în ADN. Imaginea (Figura 6) demonstrează în mod clar că compușii (4b, 4c, 4d, 4e, 4f și 4 g) prezintă scindarea ADN-ului ADN-ului pUC19 la o concentrație de 80 μM. Rezultatele au indicat că compușii care poartă -OCH3 și -OH în poziția -para a inelului fenilic (C-6) au scindat complet ADN-ul, alți compuși au prezentat o scindare aproape completă a ADN-ului. În general, aceasta indică faptul că, grupările alcoxi sunt radicali foarte reactivi, care extrag eficient atomii de hidrogen la C-4′ din 2-deoxiriboză. Este interesant de remarcat faptul că s-a raportat că gruparea hidroxil a provocat leziuni ale ADN-ului mediate de radicalii de oxigen în prezența fotoiradierii.
Studiile privind relația structură-activitate a 1,4-DHP în ceea ce privește studiile de fotocleavare a ADN-ului arată că modificările în modelul de substituție în pozițiile C-3, C-4 și C-5 modifică inelul 1,4-DHP. Osiris Property Explorer este un astfel de instrument de predicție a activității bazat pe cunoaștere, care prezice probabilitatea de apariție a medicamentului, scorul medicamentului și proprietățile nedorite, cum ar fi efectul mutagen, tumorigen, iritant și reproductiv al compușilor noi, pe baza datelor privind fragmentele chimice ale medicamentelor și non-medicamentoaselor disponibile, după cum se raportează (tabelul 2) . S-a observat că, compușii care au grupări alifatice, cum ar fi -CH3, -COOCH3, -COOC2H5 și -COOC(CH3)3, atașate la C-2 și C-3 din 1,4-DHP au prezentat o activitate bună. Alți derivați care posedă un substituent donator de electroni, cum ar fi gruparea hidroxi și metoxi pe inelul fenil (C-6), sporesc activitatea de fotocleavare a ADN-ului. O pereche de electroni singuratici de pe atomul de oxigen al grupului metoxi se delocalizează în spațiul π al inelului benzenic, crescând astfel activitatea. În mod similar, substituenții retractori de electroni, cum ar fi 4-fluorofenilul, 4-clorofenilul din 1,4-DHP scad activitatea. Aceste rezultate indică faptul că substituenții alcoxi și azotul inelului piridinic din structura 1,4-DHP sunt responsabili pentru scindarea ADN-ului.
Pentru a raționaliza rezultatele spectroscopice observate și pentru a obține mai multe informații despre modalitatea de intercalare, 1,4-DHP (4a-r) au fost andocați succesiv în cadrul duplexului de ADN cu secvența d(CGCGAATTCGCG)2 dodecameră (PDB ID: 1BNA) pentru a prezice locul de legare ales împreună cu orientarea preferată a ligandului în interiorul șanțului minor al ADN. Toți derivații de 1,4-DHP sintetizați au fost desenați în ChemSketch, iar structurile au fost salvate în format .mol. Ulterior, formatul .mol a fost utilizat în Hyperchem-7, pentru ajustarea fragmentelor acestora, urmată de minimizarea energiei totale a liganzilor, astfel încât aceștia să poată atinge o conformație stabilă, iar fișierul a fost salvat în format .pdb.
Structura 3D proteică a B-DNA a fost obținută din RCSB PDB (un portal de informații pentru structuri macromoleculare biologice). Moleculele de apă au fost eliminate din fișier, iar proteina a fost protonată în 3D pentru a adăuga hidrogeni polari. Buzunarul de legare a fost identificat cu ajutorul site finder, iar reziduurile respective au fost selectate. Parametrii de andocare au fost setați la valorile implicite și la algoritmul de scorare, cursele de andocare au fost reținute la 30 de conformații pentru fiecare ligand. Structurile proteice andocate au fost salvate în format .pdb, iar conformațiile ligandului au fost analizate una câte una. Complexele cu cele mai bune conformații au fost selectate pe baza celui mai mare scor, a celei mai mici energii de legare și a valorilor minime ale RMSD .
Compușii organici sintetizați își desfășoară activitatea biologică mai eficient prin legarea proteinei respective sau a ADN-ului la situsul lor de legare specific. Identificarea reziduurilor care interacționează cu liganzii este un pas necesar pentru proiectarea rațională a medicamentelor, înțelegerea căii moleculare și a acțiunii mecaniciste a proteinei.
Amplasarea moleculară a fost realizată între proteina receptoare rigidă și liganzii flexibili. Tabelul 3 prezintă detalii ale rezultatelor de docking, inclusiv valorile RMSD și ale energiei de legare a complexelor proteină-ligand. Liganzii (4b, 4c, 4 h, 4i, 4n și 4o) se leagă puternic de B-DNA, așa cum reiese din valorile minime ale energiei de legare, adică -13,8, -12,9 și, respectiv, -12,3 kcal/mol (Figura 7).
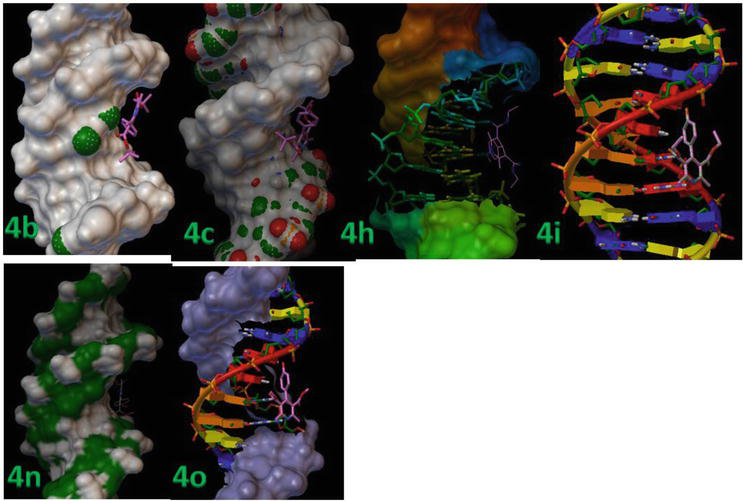
Figura 7.
1,4-DHP a fost andocat succesiv în cadrul duplexului de ADN de secvență d(CGCGAATTCGCG)2 dodecameră (PDB ID: 1BNA).
Figura 8 arată poziția situsului activ în structura elicoidală a ADN și arată, de asemenea, că toți liganzii andocați s-au grupat în interiorul buzunarului. Figura 8 a prezentat interacțiunea legăturii de hidrogen a 4c și 4d cu reziduurile cheie din situsul activ din interiorul structurii elicoidale a ADN-ului. În acest model, se indică în mod clar că compusul 4c a format o legătură de hidrogen între -OH și N1 al timinei, care este DT7 și DT19, cu lungimea legăturii de 2,02 și, respectiv, 2,05 Ǻ. Mai mult, ceilalți derivați de 1,4-DHP au format mai puține interacțiuni de legătură H cu ADN-ul datorită orientării inelului aromatic implicat în interacțiunile van der Waals (modelul Wireframe) și regiunilor hidrofobe plate ale situsurilor de legare a ADN-ului (tabelul 3). Aceste rezultate au demonstrat că studiile de andocare moleculară in silico ale 1,4-DHP cu B-DNA au sugerat că 1,4-DHP posedă potențialul de a perturba interacțiunile hidrofobe și de legătură H, afectând astfel stabilitatea atașării B-DNA, și poate fi eficient pentru liniile de celule canceroase.
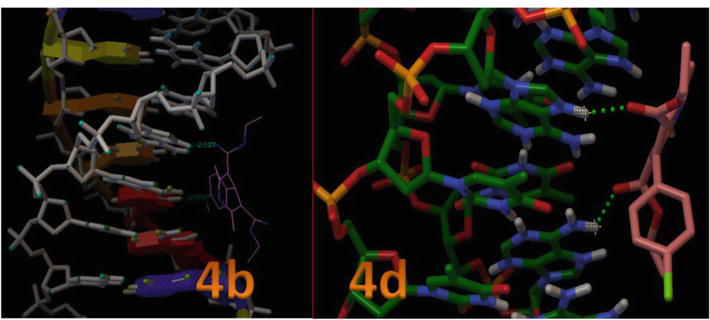
Figura 8.
Interacțiunea 1,4-DHP cu duplexul de ADN de secvență d(CGCGAATTCGCG)2 dodecameră (PDB ID: 1BNA).
.