Introduktion
En smidig och effektiv syntes av biologiskt aktiva molekyler är ett av de viktigaste målen för organisk och medicinsk kemi. På senare år har multikomponentreaktioner blivit ett av de viktiga verktygen vid syntesen av strukturellt olika kemiska bibliotek av läkemedelsliknande polyfunktionella organiska molekyler . MCR-reaktioner har dessutom fördelen av enkelhet och syntetisk effektivitet jämfört med konventionella kemiska reaktioner i flera avseenden. MCR gör det möjligt att bygga kombinatoriska bibliotek av komplexa organiska molekyler för en effektiv identifiering och optimering av ledande strukturer vid upptäckt av läkemedel.
I fortsättningen av vårt pågående forskningsarbete om mikrovågsassisterad syntes av nanomaterial har vi funnit att nanokristallina metalloxider har tilldragit sig stor uppmärksamhet från syntetiska och medicinska kemister på grund av deras höga katalytiska aktivitet och återanvändningsmöjligheter. Zinkoxid är en billig, fuktstabil, återanvändbar, kommersiellt tillgänglig och är giftfri, olöslig i polära och opolära lösningsmedel. Ett brett spektrum av organiska reaktioner som omfattar Beckmann-omläggningar , N-benzylering , acylering , dehydrering av oximer , nukleofila ringöppningsreaktioner av epoxider , syntes av cyklisk urea , N-formylering av aminer . I synnerhet kristallin nano-ZnO-oxid uppvisar bättre katalytisk aktivitet jämfört med sina motsvarigheter i bulkstorlek .
Under de senaste åren har mycket uppmärksamhet riktats mot syntesen av dihydropyridinföreningar på grund av deras enorma tillämpning inom olika forskningsområden, inklusive biologisk vetenskap och läkemedelskemi . Många DHP:er är redan kommersiella produkter, t.ex. amlodipin, felodipin, isradipin, lacidipin, nikardipin, nitrendipin, nifedipin och nimodipin B, av vilka nitrendipin och nemadipin B uppvisar potenta kalciumkanalblockerande aktiviteter (figur 1) och har framstått som en av de viktigaste läkemedelsklasserna för behandling av kardiovaskulära sjukdomar . Dessutom har dihydropyridinderivat en rad olika biologiska aktiviteter, t.ex. geroprotektiva, hepatoprotektiva, anti-aterosklerotiska, antitumör- och antidiabetiska aktiviteter . I omfattande studier har man upptäckt att föreningar som innehåller dihydropyridin-enheter uppvisar olika medicinska funktioner, t.ex. neuroprotektant, trombocytaggregationshämmande aktivitet, antiischemisk aktivitet i hjärnan vid behandling av Alzheimers sjukdom, kemosensitiserande medel vid tumörbehandling . Läkemedelsresistansmodifierare , antioxidanter och ett läkemedel för behandling av urininkontinens .
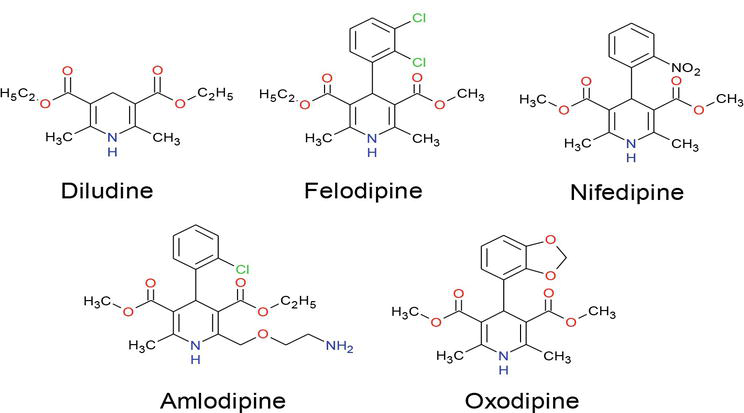
Figur 1.
Läkemedel som innehåller 1,4-DHP-grupper.
För att modellera och förstå dessa biologiska egenskaper och för att utveckla nya kemoterapeutiska medel baserade på 1,4-DHP-föreningar har betydande ansträngningar gjorts för att fastställa effektiva metoder för deras syntes. Generellt syntetiserades 1,4-DHP:er genom Hantzsch-metoden , som innebär cyklokondensation av en aldehyd, en β-ketoester och ammoniak antingen i ättiksyra eller under återflöde i alkoholer under långa reaktionstider, vilket vanligtvis leder till låga utbyten . Andra metoder omfattar användning av mikrovågor , höga temperaturer vid återflöde , organokatalysatorer och metalltriflater .
Nyligen är DNA en viktig måltavla för läkemedel och det reglerar många biokemiska processer som sker i det cellulära systemet. Småmolekylära interaktioner med DNA fortsätter att studeras intensivt och i stor omfattning för deras användbarhet som sonder av cellulär replikation och transkriptionell reglering och för deras potential som läkemedel . Framför allt är det av stor betydelse att utforma föreningar utifrån deras förmåga att klyva DNA, inte bara ur primärbiologisk synvinkel utan också när det gäller fotodynamisk terapi för att utveckla potenta läkemedel . 1,4-dihydropyridinderivat har tilldragit sig kemisternas uppmärksamhet på grund av deras olika biologiska tillämpningar . Den biologiska betydelsen av denna klass av föreningar fick oss att utvidga denna serie genom att arbeta med syntes och DNA-fotokleavage-studier av 1,4-dihydropyridinderivat. I detta meddelande har syntesen av 1,4-dihydropyridinderivat och deras DNA-fotokleavage-studier och molekylär dockning rapporterats.
I litteraturen finns det flera kända metoder för syntesen av 1,4-dihydropyridinderivat. I fortsättningen av vårt program om kemin i nanomaterial rapporterar vi här en effektiv mikrovågsmetod för syntes av kristallina ZnO-NPs. ZnO som används i detta arbete syntetiserades enligt en modifierad metod. De framställda kristallina ZnO-nanopartiklarna karakteriserades med hjälp av pulver-XRD, SEM och EDX (figur 2). Vår syntetiska metod började med kondensationen av 1 ekvivalent bensaldehyd 1a med 2 ekvivalenter etylacetoacetat 2a och 2 ekvivalenter NH4OAc 3a i närvaro av ZnO-Nps resulterade i bildandet av Hantzsch 1,4-dihydropyridin 4a (figur 3). Reaktionen slutfördes på 5 minuter under mikrovågsstrålning och produkten isolerades genom sedvanlig bearbetning, med 90 % utbyte och hög renhet. Under liknande förhållanden reagerade olika substituerade aromatiska aldehyder med antingen elektrondonerande eller -dragande substituenter med 1,3-diketoner för att bilda 1,4-DHP i goda till utmärkta utbyten, och resultaten sammanfattas i tabell 1.
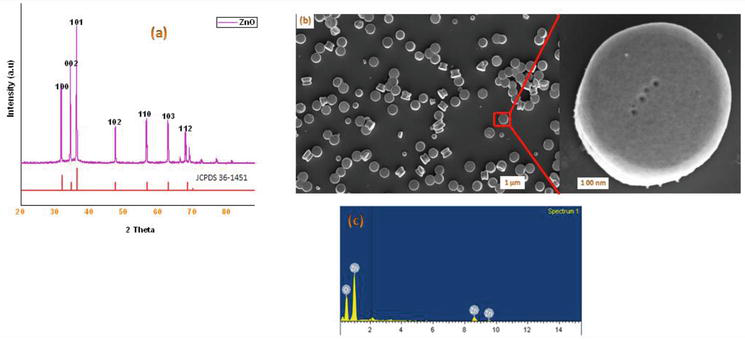
Figur 2.
(a) Pulver-XRD av erhållna ZnO-nanopartiklar genom mikrovågsmetoden; (b) SEM-bilder av ZnO-NPs; (c) EDX-analysspektrum av erhållna ZnO-nanopartiklar genom mikrovågsmetoden.
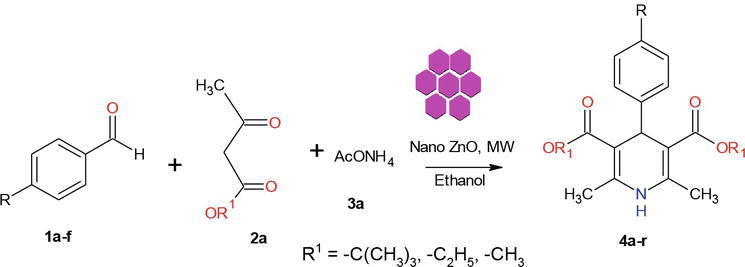
Figur 3.
Syntesen av 1,4-dihydropyridiner.
| Entrya | R | R1 | Produkter | Inträdea | Avkastning (%)b |
|---|---|---|---|---|---|
| 1 | C6H5 | t-Bu | 4a | 1 | 90 |
| 2 | 4-MeO-C6H5 | t-Bu | 4b | 2 | 95 |
| 3 | 4-OH-C6H5 | t-Bu | 4c | 3 | 95 |
| 4 | 4-F-C6H5 | t-Bu | 4d | 4 | 95 |
| 5 | 4-Cl-C6H5 | t-Bu | 4e | 5 | 90 |
| 6 | 4-NO2-C6H5 | t-Bu | 4f | 6 | 95 |
| 7 | C6H5 | Et | 4 g | 7 | 90 |
| 8 | 4-MeO-C6H5 | Et | 4 h | 8 | 95 |
| 9 | 4-OH-C6H5 | Et | 4i | 9 | 92 |
| 10 | 4-F-C6H5 | Et | 4j | 10 | 92 |
| 11 | 4-Cl-C6H5 | Et | 4 k | 11 | 90 |
| 12 | 4-NO2-C6H5 | Et | 4 l | 12 | 90 |
| 13 | C6H5 | Me | 4 m | 13 | 90 |
| 14 | 4-MeO-C6H5 | Me | 4n | 14 | 87 |
| 15 | 4-OH-C6H5 | Me | 4o | 15 | 90 |
| 16 | 4-F-C6H5 | Me | 4p | 16 | 90 |
| 17 | 4-Cl-C6H5 | Me | 4q | 17 | 90 |
| 18 | 4-NO2-C6H5 | Me | 4r | 18 | 90 |
Tabell 1.
Syntes av 1,4-dihydropyridiner
aAlla produkter karakteriserades genom 1H NMR- och 13C NMR-studier och jämfördes med litteraturens mps. bAvkastning av isolerade produkter
En process som stöds av mikrovågsstrålning minimerar mycket ofta bildandet av biprodukter och kräver mycket mindre tid än termiska metoder. De främsta fördelarna med att utföra reaktioner under kontrollerade förhållanden i slutna kärl är de betydande hastighetsförbättringar och de högre produktavkastningar som ofta kan uppnås. Som en fortsättning på våra studier om mikrovågssyntes av nanomaterial har vi därför försökt utveckla ett snabbt, mikrovågsassisterat protokoll för syntesen av 1,4-DHP med hjälp av kristallin ZnO-nanokatalysator (figur 3).
Den DNA-klyvning som 1,4-DHP-derivaten ger upphov till studerades med hjälp av agarosgelelektrofores. När cirkulärt plasmid-DNA utsattes för elektrofores observerades en relativt snabb migration för intakt supercoiled DNA (typ I). Om en delning sker på en sträng (nicking) kommer det superspolade DNA:t att slappna av och generera en långsammare rörlig öppen cirkulär form (typ II). Om båda strängarna klyvs skapas en linjär form (typ III) som vandrar mellan typ I och typ II. Omvandlingen av typ I (supercoiled) till typ II (nicked circular) observerades med olika koncentrationer av 1,4-DHP och bestrålades i 2 timmar i 1:9 DMSO/trisbuffert (20 μM, pH- 7,2) vid 365 nm. Ingen DNA-klyvning observerades för kontrollen där 1,4-DHP saknades (körfält 1) (figur 4). Med ökande koncentration av dessa 1,4-DHP minskade mängden DNA av typ I i pUC 19 gradvis, medan typ II ökade (figur 4).
Vid en koncentration på 40 μM kan föreningen (4c) främja endast 30 % omvandling av DNA från typ I till II (figur 5). Vid koncentrationen 80 μM kan förening (4c) nästan främja ca 80 % omvandling av DNA från typ I till II (figur 5). Testföreningarnas klyvningspotential bedömdes genom att jämföra de band som förekom i kontroll- och testföreningarna vid 80 μM koncentration. Andra derivat uppvisar dock mycket lägre klyvningseffektivitet för pUC 19-dna. Även vid en koncentration på 80 μM kan det främja endast 40 % omvandling av DNA från typ I till II (figur 5).
Men vid högre koncentrationer runt 130 μM fälls föreningarna ut och det finns inget moment i DNA. Bilden (figur 6) visar tydligt att föreningarna (4b, 4c, 4d, 4e, 4f och 4 g) visar DNA-klyvning av pUC19-DNA vid 80 μM koncentration. Resultaten visade att föreningar med -OCH3 och -OH i -para-positionen i fenylringen (C-6) klyvde DNA helt och hållet, medan andra föreningar uppvisade nästan fullständig klyvning av DNA. Sammantaget tyder det på att alkoxygrupperna är mycket reaktiva radikaler, som effektivt tar upp väteatomer vid C-4′ i 2-deoxyribose. Det är av intresse att notera att hydroxylgruppen har rapporterats ge upphov till syreradikalmedierad DNA-skada i närvaro av fotostrålning.
Studierna av struktur-aktivitetsförhållandet mellan 1,4-DHP:er med avseende på studier av DNA-fotoklyvning visar att förändringarna i substitutionsmönstret i positionerna C-3, C-4 och C-5 förändrar 1,4-DHP-ringen. Osiris Property Explorer är ett sådant kunskapsbaserat verktyg för prediktion av aktivitet som förutspår läkemedelslikhet, läkemedelspoäng och oönskade egenskaper såsom mutagena, tumörigena, irriterande och reproduktiva effekter hos nya föreningar baserat på kemiska fragmentdata från tillgängliga läkemedel och icke-droger som rapporterats (tabell 2). Det observerades att de föreningar som har alifatiska grupper som -CH3, -COOCH3, -COOC2H5 och -COOC(CH3)3, knutna till C-2 och C-3 av 1,4-DHP uppvisade god aktivitet. Andra derivat som har en elektrondonatorisk substituent, t.ex. hydroxi- och metoxygrupp på fenylringen (C-6), ökar DNA-fotokleavageaktiviteten. Ett ensam elektronpar på metoxygruppens syreatom delokaliseras till bensenringens π-rum, vilket ökar aktiviteten. På samma sätt sänker elektronavdragande substituenter, t.ex. 4-fluorfenyl, 4-chlorfenyl i 1,4-DHP aktiviteten. Dessa resultat tyder på att alkoxysubstituenten och pyridinringens kväve i 1,4-DHP-strukturen är ansvariga för DNA-klyvningen.
För att rationalisera de observerade spektroskopiska resultaten och för att få mer insikt i interkalationsmodaliteten dockades 1,4-DHP (4a-r) successivt i DNA-duplexen med sekvensen d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA) för att förutsäga den valda bindningsplatsen tillsammans med den föredragna orienteringen av liganden i DNA:s lilla spår. Alla syntetiserade 1,4-DHP-derivat ritades i ChemSketch och strukturerna sparades i .mol-format. Därefter användes .mol-formatet i Hyperchem-7, för att justera deras fragment, följt av total energiminimering av liganderna så att de kan uppnå en stabil konformation och filen sparades i .pdb-format.
Protein 3D-struktur av B-DNA hämtades från RCSB PDB (en informationsportal för biologiska makromolekylära strukturer). Vattenmolekylerna togs bort från filen och proteinet protonerades i 3D för att lägga till polära väteämnen. Bindningsfickan identifierades med hjälp av site finder och respektive rester valdes ut. Dockningsparametrarna ställdes in på standardvärden och poängsättningsalgoritm. Dockningskörningarna behölls till 30 konformationer per ligand. De dockade proteinstrukturerna sparades i .pdb-format och ligandernas konformationer undersöktes en efter en. Komplex med de bästa konformationerna valdes ut på grundval av högsta poäng, lägsta bindningsenergi och minsta RMSD-värden .
De syntetiserade organiska föreningarna utför sin biologiska aktivitet mer effektivt genom att binda respektive protein eller DNA vid deras specifika bindningsställe. Identifiering av interagerande rester med ligander är ett nödvändigt steg mot rationell läkemedelsdesign, förståelse av molekylära vägar och mekanistisk verkan av protein.
Molekylär dockning utfördes mellan styvt receptorprotein och de flexibla liganderna. Tabell 3 visar detaljerna i dockningsresultaten inklusive RMSD- och bindningsenergivärden för protein-ligandkomplexen. Liganderna (4b, 4c, 4 h, 4i, 4n och 4o) binder starkt till B-DNA, vilket framgår av deras lägsta värden för bindningsenergi, det vill säga -13,8, -12,9 respektive -12,3 kcal/mol (figur 7).
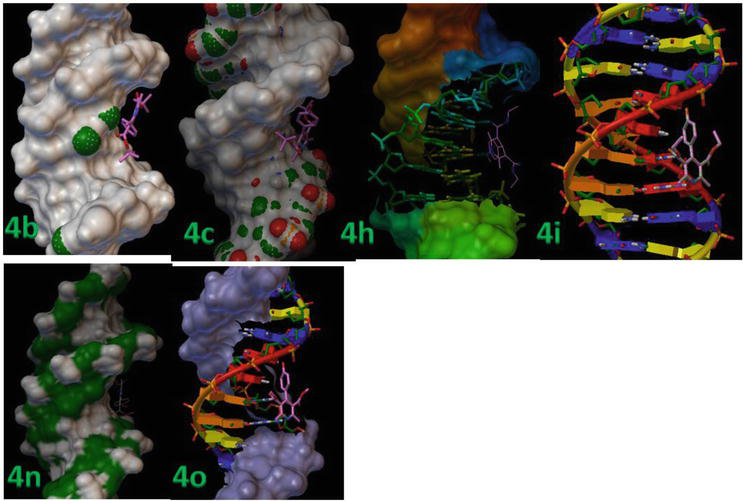
Figur 7.
1,4-DHP dockades successivt inom DNA-duplexen med sekvensen d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA).
Figur 8 visar den aktiva platsens position i DNA:s spiralformade struktur och den visar också att alla dockade ligander klustrade inom fickan. Figur 8 visar vätebindningsinteraktionen mellan 4c och 4d och nyckelrester i den aktiva platsen i DNA:s spiralformade struktur. I denna modell framgår det tydligt att föreningen 4c bildade vätebindning mellan -OH och N1 i tymin, som är DT7 och DT19 med bindningslängden 2,02 respektive 2,05 Ǻ. Dessutom bildade de andra derivaten av 1,4-DHP mindre H-bindningsinteraktion med DNA på grund av den aromatiska ringens orientering som är involverad i van der Waals-interaktioner (Wireframe-modellen) och platta hydrofoba områden i DNA:s bindningsställen (tabell 3). Dessa resultat visade att in silico molekylära dockningsstudier av 1,4-DHP med B-DNA tyder på att 1,4-DHP har potential att störa hydrofoba och H-bindningsinteraktioner och därigenom påverka stabiliteten i bindningen av B-DNA, och kan vara effektiva för cancercellinjer.
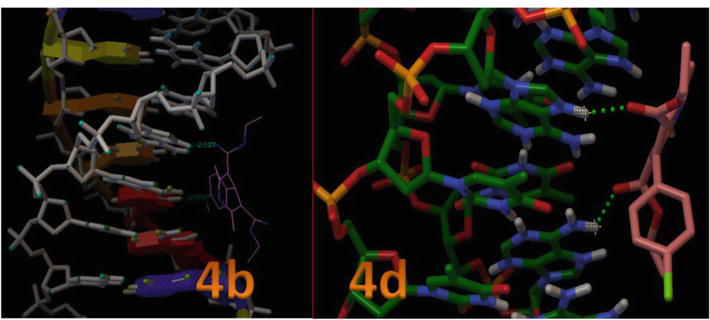
Figur 8.
Interaktion mellan 1,4-DHP och DNA-duplex med sekvensen d(CGCGAATTCGCG)2 dodecamer (PDB ID: 1BNA).