- Compound C1 can cleave DNA containing AP site
- C1のいくつかの構造部位が触媒作用に重要
- DNA structure modulates the C1-catalyzed cleavage
- C1によるAP部位のDNAの切断は、第二級アミンを含む中間体を介して進む
- AP部位の構造アナログを含むDNAの熱安定性に対するC1の効果を検討した31。 Tと反対のTHFを含む二重鎖DNA(T:THF)のTmは、1当量のC1を添加すると6.3℃上昇したが、TとAのペアを含む対照DNAのTmはあまり影響を受けず、1℃の上昇にとどまった(図5)。 T:THFの融解曲線はC1による熱安定化を示していたが、C1の存在によって融解曲線が広がり、協力的ではない融解転移が起きていることが示された。 これらのことから、C1はAPサイトのDNAに特異的に結合し、DNAらせんを局所的に安定化させることが示唆された。 これは、インドリノン-ピロール部位がAP部位で利用可能なスペースを占有するという、C1とDNAの間の相互作用の提案モデルと一致している。 T:A (a) および T:THF (b) の融点曲線は、10 mM リン酸ナトリウムバッファ、pH 7、5 μM DNAを用いて得られたものです。0、100mM NaCl、1mM EDTA中、5μM C1の非存在下(実線)および存在下(破線)で測定した。 C1 は AP サイトを含む DNA に対してより高い親和性を持つ
- 結論
Compound C1 can cleave DNA containing AP site
研究中の低分子のサブセットに異常な活性があることが最初にわかったのは、C1(図1a)をhOGG1阻害剤としてテストした時であった。 具体的には、部位特異的8-oxo-dG付加物を含む蛍光標識二重鎖オリゴヌクレオチドとhOGG1の反応にこの化合物を加えると(図1b)、β-脱離生成物よりも速く移動する付加生成物が得られた。 8-oxo-dG含有DNAをC1単独でインキュベートした場合、ニック生成物は観察されなかった。

AP部位含有DNAは対応するdU含有DNAをUDGと処理して取得した。 (a)代表的なDNA切断用触媒の構造。 (b)DNA基質。 (c)hOGG1(100nM)およびC1(10μM)存在下での8-oxo-dG含有DNA(250nM)の切断。 (d)hOGG1(50nM)およびC1(10μM)存在下でのAP部位含有DNA(250nM)の切断。 (e)hNEIL1(50nM)およびC1(10μM)存在下でのAP部位含有DNA(250nM)の切断。 (f)C1によるAP部位含有DNA(2μM)の切断。 生成物のパーセントは、自発的な切断について補正した。 反応は37℃で30分(b-d)または16時間(e)行った。
新しい生成物の形成を説明し得るいくつかの機構的可能性が仮定された。 1) C1存在下、hOGG1はグリコシラーゼとβ-脱離APリアーゼの機能に加え、δ-脱離反応を触媒する能力を獲得した、2) C1がβ-脱離生成物をδ-脱離生成物に変換できる、3) グリコシラーゼ反応で生成したAP部位がC1触媒によるβ、δ-脱離反応の基質になり得る、などであった。 これらの可能性を検討するために、単一の部位特異的AP部位を含む二重鎖DNAを、対応するdU含有DNAをウラシルDNAグリコシラーゼ(UDG)で処理することによって生成し(図1b)、C1またはhOGG1と、単独または組み合わせて反応させた。 8-oxo-dG含有オリゴデオキシヌクレオチドと同様に、hOGG1は期待通りのβ-エリミネーション生成物を生成したが、C1の添加により2つの生成物の混合物が生成した(図1d)。 この生成物の混合物は、AP含有オリゴデオキシヌクレオチドをC1のみとインキュベートした場合にも形成された。 移動速度の遅い生成物バンドの位置は、hOGG1のβ-脱離生成物と一致する(図1d)が、移動速度の速い生成物バンドは、hNEIL1の既知のδ-脱離生成物と共移動していた(図1e)。 このように、C1はAP部位のβ-およびδ-脱離反応を促進する。
AP部位を含むDNAに対するC1による切断反応は濃度依存的であり(図1eおよび補足図S1)、低μモル濃度で十分生成物を観察することができた。 以前に設計された「人工ヌクレアーゼ」26 と同様に、C1 は DNA 基質上でターンオーバー触媒作用を示した。 1 pmolのC1は16時間で1.4 pmolの生成物を生成した(図1f)。 つまり、C1がDNAを切断する速度は、1.5×10-3 min-1以上であることがわかった。 C1と現在市販されているAPリアーゼ試薬のスペルミン17およびKWKKペプチド23との比較から、今回同定された触媒は少なくとも100倍以上の効率を持つことが示された(補足図S1)。
C1のいくつかの構造部位が触媒作用に重要
鎖切断化学に対する特定の構造特性の寄与を調べるためにC1のアナログをアッセイした。 まず、インドリノン-ピロール部分を欠いた単純な市販のアミンC2(図2)とCS1-CS3(補足図S2)について、AP部位のDNAを切断する能力を調査した。 切開生成物の形成は、あったとしても10μMで検出できるレベル以下であった。 このように、インドリノン-ピロール部位は反応に重要である。 インドリノン-ピロールサブユニットがAP部位29 または小溝に結合し、二級アミンを配置して、AP部位との共有結合中間体を介して鎖切断を触媒している可能性がある。 インドリノン-ピロール部分を含み、二級アミンを欠く化合物C3(図2)およびCS4(補足図S2)も完全に不活性であった。 これらのデータは、反応性官能基としてのアミンの役割を強く示唆するものであった。 ピロールのメトキシ基をC4やC5など他の置換基で置換すると(図2)、活性が低下した。 また、アミノ基の置換基によっても反応が調節され、2級アミンの立体的要求性が高くなると、観測される生成物の量が減少した(C1、C6、C7(図2)、C4、CS5、CS6(補足図S2)の比較)。 これらの構造活性解析から、個々の部位のいくつかは切断に必要であるが十分ではなく、鎖切断を起こすにはこれらの部位が協調的に作用する必要があることが示された。 (b)DNA基質。 (c)代表的な化合物(10μM)のAP部位含有DNA(250nM)を切開する能力についてのアッセイ。 反応は37℃で30分間行った。
DNA structure modulates the C1-catalyzed cleavage
鎖切断化学におけるインドリノン-ピロール部分の重要性は、DNA基板の構造がC1による切断に影響を及ぼす可能性を示唆した。 そこで、一本鎖DNA(図1a)と、AP部位の反対側にA、C、G、Tのいずれかを含む二本鎖DNAについて、初期反応速度を測定したところ、一本鎖DNAの場合よりも、二本鎖DNAの場合の方が、反応速度が速いことが分かりました。 ホモポリマーオリゴデオキシヌクレオチド、5′-TAMRA-(T)5-AP-(T)11-3′も、一本鎖DNA構造として明確に調べることができた。 これらのデータから、鎖切断は一本鎖DNAでも起こりうるが、二本鎖DNAがC1にとってはるかに好ましい基質であることが示された(図3)。 また、AP部位の反対側の塩基の性質によって触媒作用が変化し、AP部位の加水分解速度は、プリンよりもピリミジンの反対側が速いことも明らかになった。 これらの結果は、インドリノン-ピロールサブユニットがDNAと相互作用してAP部位の空いたスペースを占有しているという提案と一致する。 注目すべきは、AP部位の反対側にCを持つ二本鎖DNAについて測定された初期速度が、C1濃度が限界の条件下でこの基質について観察された速度に非常に近いということである(図1f)。

250nM DNAと5μM C1を使って37℃で反応させた。 KaleidaGraph 4.1 ソフトウェア (Synergy Software) を用いて、3つの独立した実験から平均初期速度およびそれぞれの標準偏差を算出した。 P値はStudents’ t-testを用いて算出した。
C1によるAP部位のDNAの切断は、第二級アミンを含む中間体を介して進む
開環してアルデヒド型のデオキシリボースとの共有中間体を調べるために、AP部位に32Pラベルしたオリゴデキストリン(図1)を入れたもので、DNAの切断はC1による切断を経由した。 4a)をNaB(CN)H3存在下でC1とともにインキュベートした。 この還元剤はAP損傷とゆっくりと反応する一方で、イミンまたはイミニウムイオン-コンジュゲートを効率的に捕捉する。 AP部位を含むオリゴデオキシヌクレオチドとNaB(CN)H3を用いたコントロール反応(図4b、レーン5)では、ごく一部(~3%)のDNAの移動度が低下した。 この低存在量の生成物は、トラップ反応23でよく観察され、以前マロンジアルデヒドピリミドプリノンDNA付加物30との反応で示されたように、Tris分子との複合体を表していると思われる。 リジン・トリプトファン・リジン(KWKK)ペプチドを用いたポジティブコントロール反応23では、DNA移動度のシフトから明らかなように、イミン中間体はトラップされた(図4b、レーン3)。 NaB(CN)H3 と C1 の存在下では、大部分の DNA (~80%) が複合体を形成し、移動度が低下した種として現れた (Fig. 4b, lane 4)。 この複合体形成は、C1のDNAへの非特異的結合によるものではなく、対応するdU含有オリゴデオキシヌクレオチドを同一条件下で試験した際にはシフトが観察されなかった(図4b、レーン1)。 これらのデータは、試薬が共有結合のイミニウムイオン中間体を形成し、それが糖鎖からプロトンを引き離すための側鎖を配置するという仮説と一致していた。

(a)DNA substrate. (b)C1とAP部位を含むDNAとの複合体のシアノボロハイドライドトラッピング。 (c)還元型イミニウムイオン中間体のCIDフラグメンテーション。 (d)酵素消化後の還元型C1-デオキシリボース結合体のフラグメンテーション。
非標識のAP部位含有オリゴデキストリン(図4a)を用いてC1の還元トラップを繰り返し、生成物を質量分析(MS)により解析した。 分析の結果、還元型DNA-C1共有結合複合体と一致する質量が得られた(-2についてはm/z 1134.64)。 このイオンの衝突誘起解離(CID)により、a-B(Base)イオンとwイオンの完全なセットが得られ、C1とAPサイトの間の還元イミニウムイオン中間体と一致した(補足図S3)。 a-Bイオン系列では、C3′-O結合の断片化は、通常、核酸塩基の中性喪失を伴う。 C1とAP部位の結合が減少しているため、より低活性になると予想され、その結果、a4 (m/z 1330.1) イオンだけでなく、a4-B (m/z 1005.6) も観測された。 また、オリゴデオキシヌクレオチドを酵素で消化し、MSで分析しました(図4cおよび補足図S4)。 このプロダクトイオンのフラグメンテーションにより、N-メチルアミノ-2-デオキシリビトールの中性喪失に起因するm/z 295.09の娘イオンが得られた(図4dおよび補足図S4)。 この生成物は、2-デオキシリボースとC1の還元的アミノ化反応から調製されたものと同一であった。 C1はAP部位のアナログを含むDNAの熱安定性を向上させる
AP部位の構造アナログを含むDNAの熱安定性に対するC1の効果を検討した31。 Tと反対のTHFを含む二重鎖DNA(T:THF)のTmは、1当量のC1を添加すると6.3℃上昇したが、TとAのペアを含む対照DNAのTmはあまり影響を受けず、1℃の上昇にとどまった(図5)。 T:THFの融解曲線はC1による熱安定化を示していたが、C1の存在によって融解曲線が広がり、協力的ではない融解転移が起きていることが示された。 これらのことから、C1はAPサイトのDNAに特異的に結合し、DNAらせんを局所的に安定化させることが示唆された。 これは、インドリノン-ピロール部位がAP部位で利用可能なスペースを占有するという、C1とDNAの間の相互作用の提案モデルと一致している。
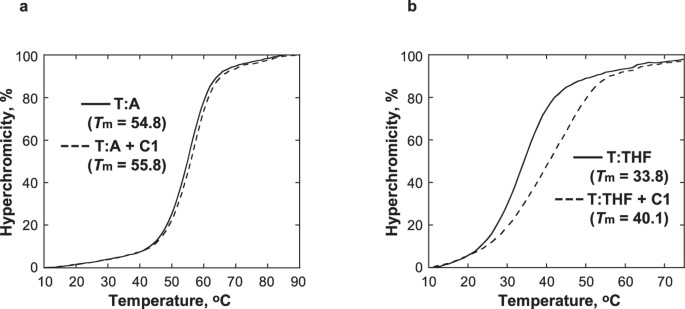
T:A (a) および T:THF (b) の融点曲線は、10 mM リン酸ナトリウムバッファ、pH 7、5 μM DNAを用いて得られたものです。0、100mM NaCl、1mM EDTA中、5μM C1の非存在下(実線)および存在下(破線)で測定した。
C1 は AP サイトを含む DNA に対してより高い親和性を持つ

T:A (a) および T:THF (b) の融点曲線は、10 mM リン酸ナトリウムバッファ、pH 7、5 μM DNAを用いて得られたものです。0、100mM NaCl、1mM EDTA中、5μM C1の非存在下(実線)および存在下(破線)で測定した。
C1 の AP サイト含有 DNA への結合様式および親和性を調べるために、THF 含有および対照の T:A 二重オリゴデキシヌクレオチドを用いて円二色性(CD)分析を行った(図 6)。 T:THF二重鎖との相互作用によるC1の誘導CD(ICD)は、強い励起子シグナルとして観察され、遊離のC1の吸収極大に対して正と負のバンドを持つ二重像の形状であった。 これは一般に、溝結合モードまたは外部スタッキング結合モードによる二量体または高次の複合体の形成を示すものである32。 T:THF濃度を増加させながらC1を滴定すると(図6aおよび補足図S5)、非特異的相互作用と特異的相互作用の両方が確認された。 滴定の開始時点では、C1は過剰であり、非特異的な相互作用が好まれる。 T:THFを添加すると、~488 nmのICDが増加した。 DNA濃度が約2μMになると、ICDバンドは低エネルギー(~495nm)にシフトし、その後等価点まで減少し、DNA過剰でプラトーとなり、特異的相互作用が示された。 C1をコントロールのT:A DNAで滴定すると(図6aおよび補足図S5)、495 nm付近で正のICDを示さず、特異的相互作用がないことが示された。 T:THFの前方滴定でも、非特異的および特異的相互作用の証拠が示された(図6b)。 DNA過剰の低濃度C1では、ICDバンドは495 nmを中心としていた(特異的)。DNAに対してC1の濃度が増加すると、ICD強度は増加し、高エネルギー(~488 nm)にシフトした。これは、高濃度のリガンドで予想される非特異的結合を示すものである。 これは、高濃度のリガンドで予想される非特異的結合を示す。観察された低ソクロミックシフトは、APサイトに特異的に結合したときのC1のコンフォメーションの変化またはより明確なコンフォメーションを示しているのかもしれない。 AP部位を持たない対照DNAの滴定でもICDが見られ、非特異的結合の証拠が得られた(図6c)。 450-520 nmのバンドは、DNAに対してC1が3倍過剰な場合にのみ現れるため、この波長域が結合曲線を作成するのに最適な選択であることは注目に値する。 結合等温線は、以前に発表された単純な二分子結合モデルを用いて構築され、解析された32。 500 nm の等温線から得られた非線形方程式 (Fig. 6d) は、コントロールの T:A DNA (非特異的結合) では 64 μM、T:THF DNA (特異的結合) では 29 μM の解離定数を与えた。C1 と THF を含む二重鎖の KD は、非特異的結合とリガンド-リガンド相互作用を補正して、22μM と算出した (Table 1)。 495 nmで計算したKD値は、500 nmで計算したKD値とわずかに誤差があった(表1)。

(a) 一定のC1濃度(20μM)と濃度の高いDNAを用いた500nmでのICD強度の滴定曲線(逆滴定)。 (b) T:THFと(c) T:AのCDスペクトル、DNA濃度10μM、C1濃度増加(順滴定)。 (d) T:THFおよびT:Aにおける500 nmのICD強度対C1濃度の滴定曲線(パネルbおよびcのデータから作成)。 (e) T:THFとT:AのC6濃度の対数に対する500nmでのICD強度の滴定曲線(補足図S6のデータから導出)。 (d) T:APとT:Aにおける500nmのICD強度対C6濃度の対数曲線(補足図S6のデータから作成)
さらに、THFではなく天然のAPサイトを含むDNAでは、C1の親和性が異なる可能性が考えられています。 この疑問を解決するために、構造的に関連するが不活性な化合物C6(図2)を、THFまたはUDG処理によってdUから作成したAP部位を含むDNAとCD分析でテストした。 T:THFおよびT:A DNAを用いた前方滴定実験でC6に観測されたCDスペクトル(補足図S6)は、C1に観測されたものと概して類似していた(図6b,c)。 結合等温線を作成し(図6e)、上記と同様に解析した。 THFを含む二重鎖に対するC6のKDは、非特異的相互作用を補正して28μMと計算され(表1)、これはC1について計算された対応するKDよりも25%高いだけであった。 このことから、C6はC1とDNAの相互作用を研究するための適切なモデルであると思われる。 次に、UDG由来のAPサイトを含むDNAを用いて、C6の前方滴定を行った(補足図S6)。 結合等温線の解析から、このDNAに対するC6の親和性は、THFを含むDNAと本質的に同じであることが明らかになった(図6fおよび表1)。 天然のAPサイトにあるデオキシリボースは、主に環を閉じたTHFのような形で存在することを考えると31、後者の結果は驚くには値しない。 共有結合中間体が形成される前、AP部位を含むDNAに対するC1の親和性は、THFを含むDNAで測定されたものと同等であろうと予想される。 このように、AP部位を持つDNAへのC1の結合が対照DNAに比べて強いことは、熱安定性のデータと一致しており、インドリノン-ピロールサブユニットがDNAのAP部位の空いた空間を占めるという提案を支持するものであった。 C1 の AP 部位への親和性はリアーゼ活性に寄与し、インドリノン-ピロール部分を持たない C2、CS1、CS2、CS3 に対して明確な利点をもたらすと考えられる (図 2 および補足図 S2)。
結論
この研究で述べた AP DNA 鎖切断触媒は、生理条件下の AP 部位の切断に利用できる新しいクラスの化合物といえる。 このコア構造に基づき、異なる塩基や異なる配列コンテキストに対するAP部位の切断の選択性を向上させる分子を設計することができる可能性がある。 近年のハイスループットなスクリーニング技術の発達により、これらの化合物は、細胞や生物における脱プリンティングやBER経路によって生じたAP部位を効率的に切断する試薬として、急速に発展することが期待される。 また、最適化されたC1は、特に、アルキル化剤33のようなDNA損傷を与えるか、PARP34,35やAPエンドヌクレアーゼ36阻害剤のようなDNA修復を標的とする多くの一般的な抗がん剤と組み合わせて、治療に応用できる可能性がある。 なお、β-あるいはβ,δ-脱離によって生じた3′末端は、事前に修復しなければDNAポリメラーゼによって利用されることはない37。 AP部位がこのようなDNA鎖切断に変換されることによる生物学的影響は複雑で、異なるタイプのDNA損傷を修復または許容する細胞能力によって異なると予想される。 考えられる結果としては、抗癌剤の治療効果の向上(より効率的な細胞死)、薬剤誘発性突然変異誘発の減少などがある。 AP部位でのDNA切断は、BRCA欠損癌のようにDNA鎖切断の修復機構に欠陥がある癌の治療に特に有効であろう34,35。