- Introduction
- Patiënten en Methoden
- Onderwerpen
- Transcraniële Magnetische Stimulatie
- MRI Acquisition
- MRI Data Processing
- Statistische analyse
- Resultaten
- TMS Resultaten
- Groepsverschillen in Fractionele Anisotropie en Gemiddelde Diffusiviteit
- Correlatie van Klinische Parameter, TMS Parameters, en DTI metingen
- Discussie
- Data Availability Statement
- Ethics Statement
- Bijdragen van auteurs
- Conflict of Interest
Introduction
Amyotrofische Laterale Sclerose (ALS) is een progressieve neurodegeneratieve ziekte die voornamelijk gekenmerkt wordt door een motorisch syndroom met variabele expressie van lagere (LMN) en hogere (UMN) motor neuron dysfunctie. De El Escorial-criteria (1) vereisen UMN- en LMN-betrokkenheid in één of meer lichaamsregio’s om de diagnose ALS definitief te stellen. UMN tekenen kunnen spasticiteit, versterkte of behouden peesreflexen en extensor plantaire respons zijn. Spiegelbewegingen (MMs) zijn herhaaldelijk gerapporteerd bij ALS (2-4), maar maken nog geen deel uit van de diagnostische criteria. MM’s zijn onwillekeurige bewegingen contralateraal aan een bedoelde vingerbeweging. MMs kunnen worden gezien bij normale kinderen tot de leeftijd van 10 jaar, maar hun prevalentie en intensiteit neemt af na deze leeftijd (5-7), waarschijnlijk als gevolg van rijping van het corpus callosum (8). Persisterende of nieuwe manifestatie van MMs bij volwassenen kunnen het gevolg zijn van een verscheidenheid aan etiologieën. Persisterende congenitale MMs zijn beschreven bij verschillende aandoeningen variërend van de afwezigheid van andere neurologische afwijkingen tot ernstige congenitale hemiparese bij cerebrale parese (9). MMs zijn ook gerapporteerd in een verscheidenheid van andere verworven aandoeningen, zoals de ziekte van Parkinson (PD) (10, 11) of beroerte (12, 13). Twee belangrijke hypothesen voor het ontstaan van MM’s werden besproken: abnormale ontwikkeling van het primaire motorische systeem, waarbij de ipsilaterale corticospinale tractus betrokken is, en gebrek aan contralaterale remmende mechanismen van de motorische cortex, voornamelijk via het corpus callosum (9, 14). De pathofysiologische basis van MMs in al deze verworven klinische condities wordt verondersteld het resultaat te zijn van een predominante verandering van callosale projecterende paden. Niettemin lijkt een bijkomende of reeds bestaande corticale of pyramidale storing noodzakelijk te zijn voor de ontwikkeling van MMs (2). Bovendien zijn MMs geassocieerd met verminderde transcallosale inhibitie (TI) zoals gemeten door transcraniële magnetische stimulatie (TMS) in ALS, PD, en beroerte (3, 4, 15-17). Ongeacht het precieze pathofysiologische mechanisme van MMs, is het belangrijkste klinische aspect dat zij de betrokkenheid van het CZS door de onderliggende pathologische aandoening weerspiegelen. Diffusie MRI technieken, zoals diffusie tensor imaging (DTI) zijn ontwikkeld om de integriteit van neuronale tracten in vivo in de menselijke hersenen te bestuderen. DTI studies vonden veranderingen in de integriteit van vezelkanalen bij neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer en ALS (18-21), met inbegrip van callosale betrokkenheid (22-24). Een observationele studie vond een consistente vermindering in fractionele anisotropie in het corpus callosum van ALS patiënten, die zich rostraal en bilateraal uitstrekte tot het gebied van de primaire motor cortices (23). In een recentere studie werden DTI en TMS gebruikt voor de karakterisering van neurodegeneratie bij ALS en werd geconcludeerd dat zij elkaar aanvullen als diagnostische biomarkers van UMN disfunctie (25). Ellis en collega’s vonden een significante toename van de gemiddelde diffusiviteit en vermindering van de fractionele anisotropie langs de corticospinale tractus bij ALS patiënten met correlatie tot de ernst van de ziekte en UMN betrokkenheid (26). Geen van deze studies richtte zich op MMs of functionele connectiviteit in ALS.
Daarom bestudeerden wij associaties van functionele TMS metingen met diffusie markers van structurele integriteit van het corpus callosum en cerebrospinale tractus in een prospectieve steekproef van ALS patiënten die MMs vertoonden om de pathofysiologische concepten van MMs in ALS op te helderen. Onze hypothese was dat ALS patiënten met MMs een verminderde functionele integriteit van het corpus callosum zouden vertonen, geassocieerd met een afname van structurele integriteitsmerkers. Dergelijke bevindingen zouden de rol van callosale disfunctie en structurele beschadiging voor MMs in ALS ondersteunen.
Patiënten en Methoden
Onderwerpen
Negentien patiënten met ALS en 20 gezonde controlepersonen ondergingen een klinische beoordeling, en MRI-onderzoeken, waaronder DTI. Gedetailleerde demografische gegevens en klinische karakteristieken van het gehele studiecohort zijn weergegeven in tabel 1. Alle proefpersonen waren rechtshandig zoals beoordeeld met de Edinburgh handedness inventory (27). Op het moment van onderzoek vertoonden 4 patiënten definitieve ALS, 8 waarschijnlijke ALS en 4 mogelijke ALS volgens de herziene El Escorial criteria (1). Drie patiënten vertoonden een lagere motorische neuron variant. De gemiddelde ziekteduur was 34,8 ± 34,8 maanden. De klinische beoordeling bestond uit neurologisch onderzoek met speciale aandacht voor de handfunctie; MMs werden geëvalueerd door sequentiële vingertikken van één hand zonder optische controle en observatie van MMs volgens de procedure van Woods en Teuber (28), en de evaluatie van de herziene ALS functionele waarderingsschaal (-R) (29). Bovendien werd, om de betrokkenheid van de bovenste motorische neuronen (UMN) te onderzoeken, een UMN “last” (UMNB) berekend door het optellen van het aantal pathologische UMN tekenen bij onderzoek (maximum score 16) (30). Voor de cognitieve screening werd gebruik gemaakt van de “Montreal Cognitive assessment” (MOCA) (31). De MOCA score varieerde tussen 18 en 29 met een gemiddelde van 24,5 ± 4 voor de ALS patiënten, en tussen 27 en 29 met een gemiddelde van 27,6 ± 0,7 voor de controles (P = 0,006). De controles hadden geen cognitieve klachten en scoorden binnen 1,5 standaarddeviaties van de voor leeftijd en opleiding gecorrigeerde normwaarde van de MOCA.
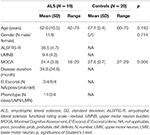
Tabel 1. Demografische en klinische gegevens van alle proefpersonen.
Patiënten en controlepersonen werden alleen in de studie opgenomen als schriftelijke toestemming was gegeven. De studie werd goedgekeurd door de Institutional Review Board van de Medische Faculteit, Universiteit van Rostock (A-2011-0026, A 2012-0083).
Transcraniële Magnetische Stimulatie
We voerden TMS uit bij alle patiënten en bij 10 van de 20 gezonde controles. Centrale motor geleidingstijd (CMCT), motor evoked potentials (MEP) amplitudes, en contralaterale stille periode (cSP) werden bepaald bij alle ALS patiënten en controlepersonen. MEP’s werden opgenomen van de eerste dorsale interosseus spier (FDI) en van de anterieure tibialis spier (TA) met behulp van een standaard cirkelvormige spoel (buitendiameter 9 cm) aangesloten op een Magstim 200 stimulator (Magstim Co, Whitland, Dyfeld, UK). Voor het verzamelen van gegevens een commercieel beschikbare MEP-systeem werd gebruikt (Brain Quick System Plus, Inomed, Erlangen, Duitsland). Onderzoek van de ipsilaterale stille periode (iSP) werd uitgevoerd met een focale spoel (externe lus diameter 7 cm). De spoel was gericht op een posterior-anteriorly gerichte stroom te induceren om de hand gebied van de motorische cortex, het punt van optimale prikkelbaarheid (POE) van de FDI spier werd bepaald over de contralaterale motorische cortex, TMS werd toegepast op de POE met 1,5 keer rust motor drempel (RMT), terwijl proefpersonen voerde een maximale tonische activering van de ipsilaterale FDI spier en terwijl ze hield de contralaterale FDI spier ontspannen zoals eerder gepubliceerd in detail (3). Voor de bepaling van iSP latentie en duur 10 proeven voor elke hemisfeer werden gebruikt. Na offline rectificatie en middeling van EMG-signalen, werden iSP parameters geanalyseerd.
MRI Acquisition
MRI-acquisities van de hersenen werden uitgevoerd met behulp van een 3-Tesla MRI-scanner met een 32-kanaals phased-array hoofdspoel en parallelle beeldvormingsmogelijkheden (Magnetom Verio, Siemens, Erlangen, Duitsland, software syngo MR B17). De proefpersonen werden in een enkele sessie gescand zonder hun positie in de scanner te veranderen. De volgende sequenties werden gebruikt: We verwierven een sagittale hoge-resolutieT1-gewogen magnetisatie geprepareerde snel verworven gradiënt-echo (MP-RAGE) 3D-sequentie, matrixgrootte van 256 × 256 × 192, isometrische voxelgrootte 1,0 mm3), TE/TI/TR van 4,82 ms/1.100 ms/2.500 ms, fliphoek 7°. Om witte stof laesies te identificeren werd een twee-dimensionale T2-gewogen sequentie uitgevoerd (fluid attenuation inversion recovery FLAIR, matrixgrootte van 384 × 187, 24 doorsneden met een plakdikte van 5,0 mm, TE/TI/TR van 94 ms/2.500 ms/9.000 ms, fliphoek 150°). Diffusie-gewogen beeldvorming werd uitgevoerd met een echoplanaire beeldvormingssequentie (TE/TR 81 ms/12.700 ms). Diffusie gradiënten werden toegepast in 30 verschillende ruimtelijke richtingen. De b-waarden waren 0 en 1.000 s/mm2. De beelden hadden een matrix grootte van 128 × 128 mm, slice dikte van 2 mm, de resulterende voxel grootte was 2,0 × 2,0 × 2,0 mm2.
MRI Data Processing
DTI gegevens werden voorbewerkt met behulp van de DTI tool box van de FSL software (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, UK, versie 4.1) (32). We hebben eerst correcties toegepast voor wervelstromen en hoofd beweging. De schedel werd gestript met behulp van Brain Extraction Tool voor differentiatie van hersenweefsel en niet-hersenweefsel met behulp van een binair masker (drempel 0,15-0,3) en de diffusie tensoren werden gemonteerd op de gegevens met DTI fit (FMRIB Image Analysis Group, Oxford, UK). Fractionele anisotropie (FA), en de gemiddelde diffusiviteit (MD) kaarten, alsmede axiale diffusiviteit (AD) en radiale diffusiviteit (RD) kaarten werden gecreëerd.
TBSS analyse (tract gebaseerd ruimtelijke statistieken) werden uitgevoerd met behulp van FMRIB software (versie 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSS maakt ruimtelijke heroriëntatie van FA kaarten in een standaard ruimte zonder systematische effecten van ruimtelijke transformatie op vezelkanaal directionaliteit en zonder de noodzaak om een ruimtelijke afvlakking kernel die van invloed kunnen zijn op de gewenste effecten (22) te selecteren. Verwerking van diffusiviteit kaarten bestond uit de volgende stappen: FA kaarten werden omgezet naar MNI (Montreal Neurologic Institute) ruimte. Genormaliseerde FA-kaarten van alle onderwerpen werden gemiddeld en geskeletonneerd met een gestandaardiseerde drempel van 0,2. Op basis van de studie specifieke met materie skeletten een individueel skelet voor elk onderwerp werd gecreëerd.
Voor specifieke analyse van de veranderingen in diffusiviteit van individuele vezels traktaten voerden we een regio van belang (ROI) analyse. De selectie van ROI’s van JHU werd gedaan zoals eerder beschreven (34). Op basis van de JHU witte stof atlas (35) definieerden we zeven regio’s: corpus callosum met subregio’s genu, truncus, en splenium, corticospinale tractus, en crus posterior van de interne capsula aan beide zijden. Gegevensverwerking werd gedaan door Matlab software 2013a (MathWorks Inc, MA, Natrick, USA) (figuur 1).
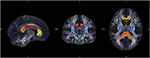
Figuur 1. De figuur toont de overlap van de gemiddelde FA skelet kaart van ons monster (blauw) en de genormaliseerde MNI-FA sjabloon en de gedefinieerde regio’s van belang op basis van JHU Witte stof atlas: genu (geel), lichaam (rood), en Splenium (oranje) van Corpus callosum, CST beide sites (groen) en crus posterior van de interne capsula aan beide zijden (lichtblauw).
Voor de analyse van de correlatie tussen TMS waarden en DTI maatregelen voerden we een regio van belang (ROI) analyse met behulp van MarsBaR (36) om de gemiddelde waarden van corpus callosum en links en rechts corticospinale tractus, respectievelijk extract.
Statistische analyse
Statistische analyse werd uitgevoerd voor de klinische scores, TMS metingen en ROI gegevens in SPSS (versie IBM SPSS statistieken 20). Voor de analyse van de gehele hersenen werd gebruik gemaakt van de tool box “Randomize” onder TBSS in FMRIB (versie 4.1 www.fmrib.ox.ac.uk/fsl). Alle klinische scores en TMS parameters toonden een normale verdeling, die werd getest met behulp van Kolmogorov Smirnov test (P > 0,1). Verschillen in TMS parameters werden vergeleken tussen groepen met behulp van Student’s t-test. De resultaten van iSP metingen werden gedichotomiseerd in pathologische vs. niet-pathologische, en geanalyseerd met behulp van Chi2 test.
Voor ROI analyse, werden groep vergelijkingen van FA van patiënten en controles uitgevoerd op basis van de bevindingen van pathologische iSP en niet-pathologische iSP in een univariate variantie analyse en daaropvolgende post-hoc tests. Bovendien werden correlaties tussen iSP bevindingen en ALSFRS en FA parameters van alle onderzochte ROIs berekend. Voor correlatieanalyse werd Spearman-Rank-correlatie gebruikt en significantie werd gesteld op P < 0.05.Voor analyse van de gehele hersenen onderzochten wij groepsverschillen in fractionele anisotropie en gemiddelde diffusiviteit met behulp van het algemene lineaire model op een voxel basis. Analyse van de gehele hersenen werd uitgevoerd voor alle diffusieparameters. FA, MD, RD, en AD kaarten werden vergeleken door univariate variantie analyse (factor: groep, covariaat: ALSFRS-R en UMNB). Om overschatting van significantie te vermijden, werd een test van meervoudige vergelijkingen toegepast (family wise error methode) en significantie werd gesteld op P < 0,05.
Resultaten
TMS Resultaten
TMS onderzoek bij ALS patiënten toonde een gemiddelde iSP latentie van 41.3 ± 5.4 ms/40.9 ± 5.7 ms (rechts/links), die langer was dan die van de gezonde controles 39.0 ± 4.6/37.7 ± 6.3 (rechts/links) (p = 0.006/0.012). Er werden geen verschillen gevonden voor de iSP-duur tussen de ALS-patiënten en de controlepersonen. Twaalf ALS-patiënten (63,2%), maar geen van de controles vertoonden verlies van iSP. cSP was numeriek korter bij ALS-patiënten dan bij controles zonder significantie te bereiken. ALS-patiënten hadden een significant lager gemiddeld RMT vergeleken met controles (TMS-resultaten worden gedetailleerd weergegeven in tabel 2 en figuur 2).

Tabel 2. TMS bevindingen bij ALS patiënten en controles.
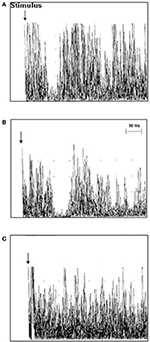
Figuur 2. Ipsilaterale spierresponsen (10 gerectificeerde en gesuperponeerde EMG-traces) opgenomen van de eerste dorsale interosseus spier (FDI) bij individuele ALS-patiënten en controles. (A) De latentie van de iSP was normaal in controlegeval 3 (37,8 ms), (B) de latentie van de iSP was verlengd in ALS-patiënt geval 11 (51 ms), en (C) ALS-patiënt geval 18 vertoonde een verlies van de iSP.
Groepsverschillen in Fractionele Anisotropie en Gemiddelde Diffusiviteit
Bij de analyses van de vooraf gespecificeerde ROIs waren FA waarden van de CST significant lager bij ALS patiënten vergeleken met controles. FA waarden van de verschillende ROIs van het corpus callosum (genu, splenium, en lichaam) verschilden niet tussen beide groepen (Tabel 3). AD en RD waarden toonden vergelijkbare bevindingen. Analyse van de gehele hersenen toonde geen verschillen in FA, MD, RD, en AD tussen ALS patiënten en controles op een FWE gecorrigeerd niveau van significantie.

Tabel 3. DTI bevindingen bij ALS patiënten en controles.
Correlatie van Klinische Parameter, TMS Parameters, en DTI metingen
We vonden significante negatieve correlaties van FA waarden van de CST met RMT waarden aan beide zijden bij ALS patiënten, maar niet bij controles (Tabel 4). Er was geen significante correlatie tussen FA waarden en iSP parameters (Tabel 4). Daarentegen was er een significante correlatie van ALS-FRS-R scores met FA waarden van de CST aan beide zijden (r CST-rechts, ALS-FRS-R = 0,58, p = 0,009 en r CST-links, LS-FRS-R = 0,05, p = 0,02), maar niet met FA waarden van het corpus callosum.
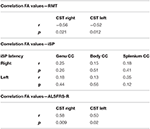
Tabel 4. Correlaties tussen TMS en DTI.
Discussie
Stoornissen van de onderste en bovenste motorische neuronen is een klinisch kenmerk van ALS. Naast betrokkenheid van de primaire motorische gebieden, is ook een vroege callosale disfunctie gesuggereerd in ALS (37). MMs kunnen een klinisch teken zijn van disfunctionele transcallosale paden en kunnen worden waargenomen bij ~30% van de ALS patiënten. Verder bewijs voor de interpretatie van MMs als markers van callosale disfunctie komt van een reeks TMS studies die callosale disfunctie aantonen als aangegeven door verminderde transcallosale inhibitie (2-4, 15) in combinatie met de aanwezigheid van MMs bij ALS en andere aandoeningen zoals de ziekte van Parkinson (16). Bovendien hebben verschillende DTI studies microstructurele veranderingen aangetoond, niet alleen in de piramidale tractus, maar ook in het corpus callosum bij ALS (22, 23, 38). Callosale betrokkenheid is aangetoond als een relatief consistent kenmerk van ALS, zelfs zonder klinische UMN betrokkenheid, en kan interhemisferische verspreiding van pathologie en een verminderde structurele motorische connectiviteit weerspiegelen (23, 24).
In de huidige studie verwachtten we een significante correlatie van DTI metingen en TMS bevindingen die transcallosale inhibitie weerspiegelen bij ALS patiënten met MMs. In overeenstemming met onze verwachting vonden we een verminderde transcallosale inhibitie in tot 68% van de gevallen, wat in lijn is met eerder gepubliceerde gegevens van onafhankelijke cohorten (3, 4). Daarentegen vertoonden ALS patiënten met MMs in de huidige steekproef geen microstructurele betrokkenheid van het corpus callosum, wat in tegenstelling is met sommige (22, 34), maar niet alle eerdere studies (39). Eén interpretatie van het ontbreken van veranderingen in het corpus callosum in onze studie kan zijn dat onze patiënten een eerdere functionele stoornis vertoonden die mogelijk voorafging aan de microstructurele bevindingen in de transcallosale paden. De twee eerdere studies die veranderingen in de diffusie van het corpus callosum vonden (23, 41) includeerden functioneel meer gevorderde gevallen (gemiddelde ALSFRS-R score respectievelijk 33,1 en 36,5, vergeleken met 38,5 in de huidige studie). Een recente studie toonde een verhoogde AD in het corpus callosum en vermindering van FA in het rechter CST in ALS zonder rekening te houden met MMs (25). De studie van Geraldo et al. had geen focus op elektrofysiologische veranderingen in de transcallosaal projecterende paden, maar corticale exciteerbaarheid en CST geleidingseigenschappen werden getest door onderzoek van de resting motor threshold (RMT) als maat voor corticale exciteerbaarheid en de centrale motor geleidingstijd (CMCT). Rekening houdend met het feit dat Geraldo en zijn collega’s een andere kleine handspier als target spier gebruikten (abductor digiti minimi vs. eerste dorsale interosseus spier in onze studie) was de RMT iets lager in onze studie hetgeen een grotere corticale exciteerbaarheid weerspiegelt in onze cohort die MMs vertoont. CMCT metingen toonden vergelijkbare waarden als in onze studie. Uitbreiding van deze eerdere bevindingen naar ALS patiënten met MMs, konden we FA vermindering van de CST geassocieerd met TMS veranderingen in ALS repliceren, zonder effecten in het corpus callosum. Een andere verklaring voor het gebrek aan significantie van DTI bevindingen in het corpus callosum in onze steekproef zou de relatief grote heterogeniteit van de patiënten kunnen zijn, wat een beperking van onze studie is. Een andere beperking is het geringe aantal patiënten. Een belangrijke reden hiervoor zou de relatieve zeldzaamheid van MMs kunnen zijn, die slechts bij ongeveer 30% van de ALS patiënten kunnen worden waargenomen. Door beperkingen in de beschikbare personele middelen kon de studieperiode niet worden verlengd.
Concluderend, dit is de eerste studie die een cohort ALS patiënten onderzoekt die allen MMs vertoonden. De huidige studie repliceert en breidt eerdere bevindingen over verminderde vezelkanaal integriteit bij ALS patiënten met MMs uit, maar liet geen microstructurele veranderingen zien die gepaard gaan met spiegelbewegingen en gestoorde transcallosale inhibitie. De aantasting van de pyramidale tractus lijkt een belangrijke voorwaarde te zijn voor de ontwikkeling van MMs. Deze studie voegt verder bewijs toe voor het begrijpen van verminderde connectiviteit bij ALS patiënten. Daarom zijn verdere studies in grotere en meer homogene cohorten nodig.
Data Availability Statement
Geïdentificeerde gegevens van deelnemers zullen worden gedeeld, evenals het studieprotocol en statistische analyses, op redelijk verzoek.
Ethics Statement
De studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de Institutional Review Board van de Medische Faculteit, Universiteit van Rostock (A-2011-0026, A267 2012-0083). De patiënten/deelnemers gaven hun schriftelijke toestemming om deel te nemen aan deze studie.
Bijdragen van auteurs
MW: concept, ontwerp, opstellen van het manuscript, verzamelen van gegevens, en uiteindelijke goedkeuring van het manuscript. NW, AG, en EK: verwerving van gegevens, herziening van het manuscript, en de uiteindelijke goedkeuring van het manuscript. ST: concept, ontwerp, analyse en interpretatie van gegevens, opstellen van het manuscript, revisie van het manuscript, en uiteindelijke goedkeuring van het manuscript.
Conflict of Interest
ST heeft de hieronder genoemde werkzaamheden verricht (alle in Duitsland): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Quality circle for physicians in Kühlungsborn, Talk: “Dementia and Diabetes-current report”
14.11.2018-MSD Expert-forum: NAB Alzheimer in München, deelnemer als consultant
13.08.2019-Event “Diabetes en Dementie” in Rostock, Talk: “Dementie en Diabetes-current report” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board in Frankfurt am Main, deelname als consultant
27.09.2019-ROCHE Symposium op het DGN Congres in Stuttgart, Talk: “Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
De overige auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotrofe Laterale Scler Andere Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Spiegelbewegingen en ipsilaterale motor evoked potentials in ALS. Amyotrofe Laterale Scler Andere Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/14660820410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Spiegelbewegingen in amyotrofe laterale sclerose. Amyotrofe Laterale Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Verschillen tussen ‘congenitale spiegelbewegingen’ en ‘geassocieerde bewegingen’ bij normale kinderen: een neurofysiologische casestudy. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. Een neurofysiologische studie van spiegelbewegingen bij volwassenen en kinderen. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mirror movements in healthy humans across the lifespan: effects of development and ageing. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurophysiology of unimanual motor control and mirror movements. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Coordination disorders in patients with Parkinson’s disease: a study of paced rhythmic forearm movements. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Spiegelbewegingen bij parkinsonisme: evaluatie van een nieuw klinisch teken. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Individual patterns of functional reorganization in the human cerebral cortex after capsular infarction. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganisatie van de motorische output in de niet-aangedane hemisfeer na een beroerte. Hersenen. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical subrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impaired interhemispheric inhibition in amyotrophic lateral sclerosis. Amyotrofe Laterale Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemispheric and ipsilateral connections in Parkinson’s disease: relation to mirror movements. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistentie van congenitale spiegelbewegingen na hemiplegische beroerte. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group. anatomical MRI and DTI in the diagnosis of Alzheimer’s disease: a European multicenter study. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. Eerste neuroimaging symosium in ALS (NISALS). Op weg naar een neuroimaging biomarker voor amyotrofe laterale sclerose. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Hersenen. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Corpus callosum involvement is a consistent feature of amyotrophic lateral sclerosis. Neurology. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Impaired structural motor connectome in amyotrophic lateral sclerosis. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiologie. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusion tensor MRI assesses corticospinal tract damage in ALS. Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. De beoordeling en analyse van handvaardigheid: de Edinburgh inventaris. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Spiegelbewegingen na hemiparese bij kinderen. Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. BDNF ALS studiegroep (Fase III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Evidence of widespread cerebral microglial activation in amyotrophic lateral sclerosis: an (R)-PK11195 positron emission tomography study. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Vooruitgang in functionele en structurele MR beeldanalyse en implementatie als FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum: association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces: analyses van witte stof anatomie en tract-specifieke kwantificering. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Region of interest analysis using SPM toolbox (abstract). Gepresenteerd op de 8e internationale conferentie over functionele kartering van het menselijk brein, 2-6 juni 2002, Sendai, Japan. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Callosal dysfunction in amyotrophic lateral sleosis correlates with diffusion tensor imaging of the central motor system. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Microstructurele witte stof veranderingen die ten grondslag liggen aan cognitieve en gedragsmatige stoornissen in ALS- een in vivo studie met behulp van DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar