Introduction
<3718>筋萎縮性側索硬化症(ALS)は、下部(LMN)と上部(UMN)の運動ニューロンの機能障害が多様に発現する運動症候群が主徴の進行性神経変性疾患である。 El Escorial基準(1)では、1つ以上の部位にUMNとLMNの病変があればALSと確定診断される。 UMNの症状としては、痙性、腱反射の増強または維持、足底伸筋の反応などがある。 ALSでは鏡映機転(MM)が繰り返し報告されているが(2-4)、まだ診断基準には含まれていない。 鏡視体操は、意図した指の動きと反対方向の不随意運動である。 鏡映現象は10歳までの健常児にみられますが、この年齢を過ぎるとその頻度と強度は減少します(5-7)。 成人におけるMMの持続性または新規発現は、様々な病因から生じる可能性がある。 先天性MMの持続は、他の神経学的異常がない場合から、脳性まひにおける重度の先天性片麻痺まで、様々な条件下で報告されている(9)。 また、パーキンソン病(PD)(10、11)や脳卒中(12、13)のような他の様々な後天性疾患においても、MMが報告されている。 すなわち、同側の皮質脊髄路が関与する一次運動系の異常発達と、主に脳梁を介した対側運動野の抑制機構の欠如である(9, 14)。 これらすべての後天性臨床疾患におけるMMの病態生理学的基盤は、脳梁投射経路の優勢な変化の結果であると考えら れる。 しかしながら、MMの発症には、皮質または錐体の機能不全が追加的または既存的に必要であるように思われる(2)。 さらに、MMはALS、PD、脳卒中において経頭蓋磁気刺激(TMS)により測定される経カローサル抑制(TI)の低下と関連していることが分かっている(3、4、15-17)。 MMの正確な病態生理学的メカニズムにかかわらず、最も重要な臨床的側面は、MMが基礎となる病態に よるCNSの関与を反映していることである。 拡散テンソル画像(DTI)のような拡散MRI技術は、ヒトの脳の生体内における神経細胞路の完全性を研究するために確立されたものである。 DTIの研究では、アルツハイマー病やALSのような神経変性疾患において、脳梁の病変を含む神経線維路の統合性の変化が見出されています(18-21)(22-24)。 ある観察研究では、ALS患者の脳梁で分数異方性の一貫した減少が認められ、それは吻側と一次運動野の領域まで両側性に及んでいた(23)。 さらに最近の研究では、ALSの神経変性の特徴づけにDTIとTMSを用い、UMN機能障害の診断バイオマーカーとして補完的な役割を果たすと結論づけている(25)。 Ellisらは、ALS患者の皮質脊髄路に沿った平均拡散率の有意な上昇と分画異方性の減少を見出し、病気の重症度とUMNの関与との相関を示した(26)。 そこで、ALSにおけるMMの病態生理学的概念を解明するために、MMを示すALS患者の前向きサンプルにおいて、TMSの機能的測定値と脳梁と脳脊髄路の構造的完全性の拡散マーカーとの関連性を検討した。 MMを有するALS患者では、脳梁の機能的完全性が損なわれ、それに伴って構造的完全性マーカーが低下していると仮定した。 2553><9561>患者と方法<6391><8625>被験者<261><3718>ALS患者19名と健常対照者20名に臨床評価とDTIを含むMRI検査を実施した。 研究対象者全体の詳細な人口統計学的データおよび臨床的特徴を表1に示す。 すべての被験者はEdinburgh handedness inventory (27)で評価したように右利きであった。 検査時点では、改訂版El Escorial基準(1)に従って、4名が確定的なALS、8名がprobable ALS、4名が可能性のあるALSであった。 3名の患者は下部運動ニューロン変種を示した。 平均罹病期間は34.8±34.8カ月であった。 臨床評価は、手指の不自由さを特に尊重した神経学的検査、視神経制御なしに片手を順次指で叩くことによるMMの評価、Woods and Teuberの手順によるMMの観察(28)、改訂版ALS機能評価尺度(-R)の評価(29)から構成されていた。 さらに、上部運動ニューロン(UMN)の関与に対処するため、検査における病理学的UMN徴候の数を合計することでUMN「負担」(UMNB)を算出した(最大スコア16)(30)。 認知機能スクリーニングには、「モントリオール認知機能評価」(MOCA) を用いた(31)。 MOCAスコアは、ALS患者では18から29の間で平均24.5±4、対照群では27から29の間で平均27.6±0.7であった(P = 0.006)。 対照群には認知機能の訴えはなく、MOCAの年齢・学歴調整済み標準値から1.5標準偏差以内のスコアだった。
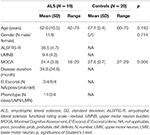
Table 1. 全研究対象者の人口統計学的および臨床的データ。
患者および対照個人は、書面による同意が得られた場合のみ研究に参加させた。 本研究は、ロストック大学医学部の施設審査委員会の承認を得た(A-2011-0026、A 2012-0083)。
Transcranial Magnetic Stimulation
我々は、すべての患者と20人中10人の健常対照者にTMSを実施した。 中枢運動伝導時間(CMCT)、運動誘発電位(MEP)振幅、対側無声期間(cSP)をALS患者全員と対照被験者で測定した。 MEPはMagstim 200刺激装置(Magstim Co., Whitland, Dyfeld, UK)に接続した標準円形コイル(外径9cm)を用いて第一背側骨間筋(FDI)および前脛骨筋(TA)から記録した. データ取得には市販のMEPシステム(Brain Quick System Plus, Inomed, Erlangen, Germany)を使用した。 同側無音期間(iSP)の調査は、焦点式コイル(外部ループ径7cm)を用いて行った。 同側FDI筋の最適興奮点(POE)を対側運動野の上に決定し、同側FDI筋の最大緊張性活性化を行い、対側FDI筋をリラックスさせた状態で、POEにおいて安静時運動閾値(RMT)の1.5倍でTMSを適用した(詳細既報(3))。 iSPの潜時および持続時間の測定には、各半球で10回の試行を行った。 MRIは、32chフェーズドアレイヘッドコイルとパラレルイメージング機能を備えた3テスラMRIスキャナー(Magnetom Verio, Siemens, Erlangen, Germany, software syngo MR B17)を用いて脳を撮影し、MRI画像データを収集した。 被験者はスキャナー内での位置を変えることなく、1回のセッションでスキャンされた。 以下のシーケンスを使用した。 高分解能T1強調磁化準備高速収集グラディエントエコー(MP-RAGE)3D-シーケンス、マトリックスサイズ256 × 256 × 192、等尺ボクセルサイズ 1.0 mm3)、TE/TI/TR 4.82 ms/1,100 ms/2,500 ms、フリップ角7°を取得した。 白質病変を同定するために2次元T2強調シーケンスを行った(fluid attenuation inversion recovery FLAIR、マトリックスサイズ384×187、24スライス、スライス厚5.0 mm、TE/TI/TR 94 ms/2,500 ms/9,000 ms、フリップ角度 150°)。 Diffusion-weighted imagingはecho-planar-imaging sequence(TE/TR 81 ms/12,700 ms)で行い、Diffusion gradientsは30種類の空間方向で適用した。 b値は0と1,000 s/mm2である。 画像はマトリクスサイズ128×128mm、スライス厚2mm、ボクセルサイズ2.0×2.0mm2であった。 まず、渦電流と頭部の動きの補正を施した。 脳組織と非脳組織の区別のためにBrain Extraction Toolを用いて頭蓋骨をバイナリマスク(閾値0.15-0.3)でストリップし、DTI fit(FMRIB Image Analysis Group, Oxford, UK)で拡散テンソルをデータにフィッティングした。 Fractional Anisotropy (FA), and mean diffusivity (MD) maps as well as axial diffusivity (AD) and radial diffusivity (RD) maps were created.
TBSS analysis (tract based spatial statistics) was performed using FMRIB software (version 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSSは、繊維路の方向性に対する空間変換の系統的な影響なしに、また所望の効果に影響を与える可能性のある空間平滑化カーネルを選択する必要なしに、FAマップを標準空間に再方向付けすることを可能にする(22)。 拡散性マップの処理は以下のステップで構成される。 FAマップはMNI(Montreal Neurologic Institute)空間へ変換された。 全被験者の正規化FAマップを平均化し、0.2の標準化閾値でスケルトン化した。 また、個々の繊維路の拡散性の変化を具体的に解析するために、関心領域(ROI)解析を行った。 JHUからのROIの選択は、以前に述べたように行った(34)。 JHU白質アトラス(35)に基づき、genu、truncus、spleniumのサブ領域を持つ脳梁、皮質脊髄路、両側の内被殻の後方のcrusの7つの領域を定義した。 データ処理はMatlabソフトウェア2013a(MathWorks Inc.、MA、Natrick、USA)により行った(図1)
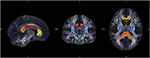
Figure 1.図1.図1. 図は、我々のサンプルの平均FAスケルトンマップ(青)と正規化MNI-FAテンプレートとJHU White matter atlasに基づいて定義した関心領域:Corpus callosumのgenu(黄色)、body(赤)、Splenium(オレンジ)、CST両サイト(緑)、両側の内被殻のcrus posterior(ライトブルー)を重ね合わせたものである。
TMS値とDTI測定値の相関を解析するために、MarsBaR(36)を用いて関心領域(ROI)解析を行い、脳梁と左右の皮質脊髄路からそれぞれ平均値を抽出した。
統計解析
臨床スコア、TMS測定、ROIデータについてSPSS(バージョンIBM SPSS statistics 20)で統計解析が実施された。 全脳解析にはFMRI(バージョン4.1 www.fmrib.ox.ac.uk/fsl)のTBSS下のツールボックス “Randomize “を使用した。 すべての臨床スコアとTMSパラメータは正規分布を示し、これはKolmogorov Smirnov検定を用いて検定された(P > 0.1)。 TMSパラメータの差はスチューデントのt検定を用いて群間で比較された。 iSPの測定結果は病的と非病的で二分化し、Chi2検定を用いて解析した。
ROI解析については、一変量分散分析とその後のポストホックテストで病的iSPと非病的iSPの所見に応じて患者と対照者のFAの群間比較を行った。 さらに、iSP所見とALSFRSおよび全調査ROIのFAパラメータとの相関を算出した。 相関分析には Spearman-Rank-correlation を用い、有意性は P < 0.05 とした。全脳分析では、ボクセル単位で一般線形モデルを用いて分数異方性と平均拡散率の群間差を検討した。 全脳解析は、すべての拡散パラメータについて実施した。 FA、MD、RD、ADマップは単変量分散分析(因子:群、共変量:ALSFRS-R、UMNB)により比較された。 有意性の過大評価を避けるため、多重比較の検定を適用し(family wise error method)、有意性はP < 0.05とした。
結果
TMS結果
ALS患者におけるTMS調査の結果、iSP潜時は平均41.3 ± 5.4 ms/40.9 ± 5.7 ms(右/左)、健常対照者のそれ 39.0 ± 4.6/37.7 ± 6.3 (右/左)より長かった(p = 0.006/0.012). ALS患者と対照者のiSPの持続時間には差がなかった。 ALS患者12名(63.2%)にiSPの消失がみられたが、対照群にはみられなかった。cSPはALS患者において対照群よりも数値的に短かったが、有意差には至らなかった。 ALS患者は対照群と比較して平均RMTが有意に低かった(TMSの結果は表2および図2に詳細を示す)

Table 2. ALS患者と対照者のTMS所見。
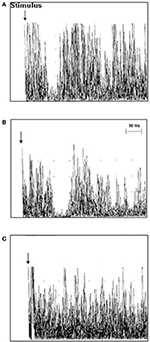
Figure 2.ALS患者と対照者のTMS所見。 ALS患者と対照者の第1背側骨間筋(FDI)から記録された同側の筋反応(10個の整流され重ねられたEMG-トレース)。 (A)対照例3ではiSPの潜時は正常(37.8ms)、(B)ALS患者11ではiSPの潜時が延長(51ms)、(C)ALS患者18ではiSPが消失していた。
フラクショナルアニソトロピーと平均拡散率のグループ差
事前に指定したROIの分析について、CSTのFA値は対照と比較してALS患者で有意に低かった。 脳梁の異なるROI(genu,splenium,body)のFA値には両群間で差はなかった(表3)。 AD値とRD値も同様の所見を示した。 全脳解析では、FA、MD、RD、ADについて、FWE補正した有意水準でALS患者と対照群との間に差は見られなかった。

Table 3. ALS患者と対照者のDTI所見 .
Correlation of Clinical Parameter, TMS Parameters, and DTI Measures
ALS患者ではCSTのFA値と両側のRMT値には有意な負の相関が認められたが、対照者では認められなかった(表4)。 FA値とiSPパラメータとの間には有意な相関は認められなかった(表4)。 一方,ALS-FRS-Rスコアと左右のCSTのFA値には有意な相関が見られたが(r CST-right, ALS-FRS-R = 0.58, p = 0.009 and r CST-left, LS-FRS-R = 0.05, p = 0.02),脳梁のFA値には相関がなかった
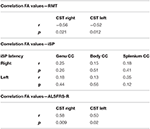
Table 4. TMSとDTIの相関
Discussion
下部および上部運動ニューロン機能障害はALSの臨床的特徴である. ALSでは一次運動野の病変の他に、早期のカローサル機能障害も示唆されている(37)。 ALS患者の30%に見られるMMは,allosal経路の機能不全を示す臨床的徴候である可能性がある。 ALSやパーキンソン病のような他の疾患におけるMMの存在と関連して、TMSによる様々な研究により経脳梁抑制の障害によって示される脳梁機能障害(2-4、15)から、MMを脳梁機能障害のマーカーと解釈する根拠がさらに得られている(16)。 さらに、いくつかのDTI研究では、ALSでは錐体路だけでなく脳梁の微細構造の変化も示されている(22, 23, 38)。 本研究では,MMを有するALS患者において,DTI測定値とTMS所見が経脳梁抑制を反映して有意に相関することを期待した。 このことは、以前に発表された独立したコホートのデータ(3, 4)と一致している。 しかし、今回のサンプルでは、MMを持つALS患者には脳梁の微細構造の侵襲が見られなかった。これは、すべてではないが、いくつかの先行研究(22、34)とは対照的である(39)。 我々の研究で脳梁の変化が見られなかったことの一つの解釈として、我々の患者は、脳梁経路の微細構造所見に先行して、潜在的に初期の機能障害を示していたことが考えられる。 したがって,脳梁の拡散変化を認めた2件の先行研究(23,41)は,より機能的に進行した症例(平均ALSFRS-Rスコア33.1,36.5,本研究では38.5)であった. 最近の研究では、MMを考慮することなく、ALSにおける脳梁のADの増加と右CSTのFAの減少が証明された(25)。 Geraldoらの研究では、脳梁投射経路の電気生理学的変化には焦点が当てられていないが、皮質の興奮性の指標である安静時運動閾値(RMT)と中心運動伝導時間(CMCT)を調査することによって、皮質の興奮性とCST伝導特性が検証されている。 Geraldo 氏と共同研究者らは、標的筋として異なる小手筋(我々の研究では第一背側骨間筋に対し て、第四指側頭外転筋)を用いたことを考慮すると、我々の研究で RMT は若干低く、MM を示す我々のコホートでは皮質の興奮 性が高いことが反映されている。 CMCT測定値は我々の研究と同程度の値を示した。 これらの先行研究結果をMMのあるALS患者に拡張すると、ALSのTMS変化に伴うCSTのFA減少を再現することができたが、脳梁には影響がなかった。 また、本研究の限界として、患者の異質性が挙げられる。 もう一つの限界は、患者数の少なさである。 このような状況の主な理由は、MMがALS患者の約30%にしか観察されないという相対的な希少性にあるのかもしれない。 2553>
結論として、本研究は、全員がMMを有するALS患者のコホートを調査した最初の研究である。 本研究は、MMを有するALS患者において繊維路の完全性が低下しているというこれまでの知見を再現・拡張するものであるが、鏡像運動を伴う微細構造の変化や経allosal抑制の障害を示すことはできなかった。 錐体路の障害はMMの発症の重要な前提条件であるように思われる。 本研究は、ALS患者における結合障害についての理解を深めるためのさらなる証拠となる。 そのため、より大規模で均質なコホートでのさらなる研究が必要である。
Data Availability Statement
Deidentified participant data, as well as the study protocol and statistical analyses is shared upon reasonable requests.
Ethics Statement
The studies involving human participate has reviewed and approved by Institutional Review Board of the Medical Faculty, University of Rostock (A-2011-0026, A267 2012-0083).Inciental Review Board for the Study with the human participant.
Author Contributions
MW: 発想、デザイン、原稿作成、データ取得、原稿の最終承認。 NW、AG、EK:データ取得、原稿の修正、原稿の最終承認。
Conflict of Interest
ST は、以下の研究を行っている(すべてドイツ)。 MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Quality circle for physicians in Kühlungsborn, Talk: “Dementia and Diabetes-current report”
14.11.2018-MSD Expert-forum: NAB Alzheimer in Munich、コンサルタントとして参加
2019.08.13-Event “Diabetes and Dementia” in Rostock、Talk: “Dementia and Diabetes-current report” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
2019.09.12–3. National Advisory-Board in Frankfurt am Main, participation as consultant
27.09.2019-ROCHE Symposium at the DGN Congress in Stuttgart, Talk: “Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
The remaining authors is disclosed in the research was taken out any commercial or financial relationships that could be construed as potential conflict of interest.
1.Brooks BR, Miller RG, Swash M, Munsat TL.「アルツハイマー病の診断と治療のターゲットとして、アルツハイマー病を治療する」
2. El escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2.筋萎縮性側索硬化症の診断基準。 Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. ALSにおける鏡像運動と同側運動誘発電位. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/14660820410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis.Net サイト。 Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4.筋委縮の抑制。 Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mirror movements in amyotrophic lateral sclerosis(筋萎縮性側索硬化症における鏡像運動). 筋萎縮性側索硬化症。 (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. ライツM、ミュラーK.健常児における「先天性ミラー運動」と「関連運動」の違い:神経生理学的ケーススタディー. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6.先天性鏡像運動の違い。 メイストンMJ、ハリソンLM、スティーブンスJA。 成人と小児における鏡像運動の神経生理学的研究。 Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7.鏡像運動と鏡像の神経生理学的研究。 また、”Mirror movement in healthy humans across the lifespan: effects of development and ageing “と題した論文も発表している。 Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8.鏡像運動について。 Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation(同側皮質脊髄投射の発生過程:経頭蓋磁気刺激による研究)。 Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9.同側皮質脊髄投射の発生:経頭蓋磁気刺激を用いた発達研究。 Cincotta M, Ziemann U. 一躁運動制御と鏡像運動の神経生理学。 臨床神経生理学。 (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10.神経生理学(Neuropean Neurophysiol). Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. このような場合、「己の信念を貫く」ことが重要である。 Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11.協調運動障害(パーキンソン病)。 Espay AJ, Li JY, Johnston L, Chen R, Lang AE. パーキンソン病における鏡像運動:新しい臨床的徴候の評価。 J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12.鏡像運動:パーキンソン病の新しい臨床的徴候の評価。 Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. 大脳皮質における機能的再編成の個別パターン(梗塞後). Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13.大脳皮質における機能的再編成。 Netz J, Lammers T, Hömberg V. 脳卒中後の非罹患半球における運動出力の再組織化。 Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14.脳卒中後の非遺症性半球の運動出力の再編成。 Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Kallmann症候群におけるミラー運動の脳解剖学的基質. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15.カルマン・シンドロームにおける鏡像運動の脳内基質. 筋萎縮性側索硬化症における半球間抑制の障害。 筋萎縮性側索硬化症。 (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16.筋萎縮性側索硬化症における大脳半球間抑制の障害。 李JY、Espay AJ、Gunraj CA、Pal PK、Cunic DI、Lang AE、他 パーキンソン病における半球間および同側の接続:鏡像運動との関連。 Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. 片麻痺性脳卒中後の先天性鏡像運動の持続性。 AJNR Am J Neuroradiol。 (2005) 26:831-4.
PubMed Abstract | Google Scholar
18.脳卒中後の先天性鏡像運動の持続。 Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group.anatomical MRI and DTI in the diagnosis of Alzheimer’s disease: a European multicenter study.アルツハイマー病の診断における解剖学的MRIとDTIの有用性. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19.アルツハイマー病の診断。 Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS)。 筋萎縮性側索硬化症の神経画像バイオマーカーに向けて。 Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging Society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis.筋萎縮性側索硬化症における脳拡散テンソル画像の大規模多施設共同研究.NiSALS研究会(Neuroimaging Society in ALS)DTI study group. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21.筋萎縮性側索硬化症における脳拡散テンソル画像に関する大規模多施設共同研究(NiSALS研究グループ). Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker.筋萎縮性側索硬化症の生体内病変のイメージング:伝播に基づく生物学的マーカーを標的とする。 J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22.筋萎縮性側索硬化症の病態のイメージング:伝播に基づく生物学的マーカーを標的とする. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis.筋萎縮性側索硬化症における早期上部運動ニューロン病変の拡散テンソルMRI。 Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23.筋萎縮性側索硬化症における早期上部運動ニューロン病変の拡散テンソルMRI。 Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. 筋萎縮性側索硬化症の一貫した特徴として、脳梁の侵襲がある。 神経学。 (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24.筋委縮性側索硬化症は筋萎縮性側索硬化症の一貫した特徴である。 Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. 筋萎縮性側索硬化症における構造的運動コネクトームの障害。 PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25.筋萎縮性側索硬化症における構造的運動コネクトームの障害. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes.筋萎縮性側索硬化症の症例における分数異方性を超えた拡散係数と電気生理学的伝導度変化との相関。 Neuroradiology. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26.筋萎縮性側索硬化症:平均軸方向および半径方向拡散率と電気生理学的伝導度変化との相関。 エリスCM、シモンズA、ジョーンズDK、ブランドJ、ドーソンJM、ホースフィールドMA、他。 拡散テンソルMRIはALSにおける皮質脊髄路の損傷を評価する。 Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27.ALSにおける大脳皮質脊髄路の損傷を評価する。 オールドフィールドRC. 手指の評価と分析:エジンバラ式インベントリ。 Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28.手指の評価と分析:エジンバラ・インベントリー。 ウッズBT、テイバーHL. 小児半身不随後の鏡像運動。 Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29.小児半身不随後のミラー運動。 Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. ALSFRS-R: a revised ALS functional rating scale that incorporates a assessment of respiratory function(呼吸機能の評価を取り入れた改訂版ALS機能評価尺度)。 BDNF ALS研究グループ(第III相)。 J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. 筋萎縮性側索硬化症における広範囲の脳ミクログリア活性化の証拠: (R)-PK11195 positron emission tomography study. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@uline@
CrossRef Full Text | Google Scholar
31.筋萎縮性側索硬化症における脳ミクログリア活性化のエビデンス。 Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment.モントリオール認知機能評価(MoCA):軽度認知障害の簡易スクリーニングツール。 J Am. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32.認知機能評価(MoCA):軽度認知障害の簡易スクリーニングツール。 Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Functional and Structural MR image analysis and implementation as FSLにおける進歩. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33.機能的・構造的MR画像解析の進歩(FSL). Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data.(トラクトベースの空間統計:多被験者の拡散データのボクセル単位の解析)。 Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34.空間統計学(Tract-based spatial statistics):ボクセル単位の拡散データ解析。 DELCODE研究会:多施設共同トラクトに基づくアルツハイマー病スペクトル内の微細構造病変の解析:アミロイド病理との関連性と診断的有用性。 J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35.邦訳:「アルツハイマー病における微小構造病変の多施設共同解析:アミロイド病理との関連と診断上の有用性」(日本経済新聞出版社)。 また、”Tract probability maps in stereotaxic spaces: analyses of white matter anatomy and tract-specific quantification”(脳定位空間におけるトラクト確率マップ:白質解剖とトラクト別定量化の解析)。 NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36.脳梗塞は、脳卒中である。 Brett M, Anton JL, Valabregue R, Poline JB. SPM toolboxを用いた関心領域解析(抄訳)。 このような場合、「脳機能マッピングの研究会」での発表となる。 NeuroImage. 16:253-62.
Google Scholar
37. また、このような場合、「鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと。 J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38.筋萎縮性側索硬化症における脳梗塞の病変の分布。 Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. 筋萎縮性側索硬化症における小丘機能障害は、中枢運動系の拡散テンソル画像と相関している。 Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39.筋萎縮性側索硬化症のカローサル機能障害は、中枢運動系の拡散テンソル画像と相関している。 ALSの認知・行動障害の根底にある微細な白質変化-DTIを用いたin vivo研究-. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar