- Indledning
- Patienter og metoder
- Folk
- Transcranial Magnetic Stimulation
- MRI-optagelse
- MRI-databehandling
- Statistisk analyse
- Resultater
- TMS Resultater
- Gruppeforskelle i fraktionel anisotropi og gennemsnitlig diffusivitet
- Korrelation mellem kliniske parametre, TMS-parametre og DTI-målinger
- Diskussion
- Datatilgængelighedserklæring
- Ethisk erklæring
- Author Contributions
- Interessekonflikt
Indledning
Amyotrofisk lateralsklerose (ALS) er en progressiv neurodegenerativ sygdom, der hovedsageligt er karakteriseret ved et motorisk syndrom med varierende udtryk for dysfunktion af nedre (LMN) og øvre (UMN) motoriske neuroner. El Escorial-kriterierne (1) kræver UMN- og LMN-involvering i en eller flere kropsregioner for at stille diagnosen definitiv ALS. UMN-tegn kan være spasticitet, forstærkede eller bevarede senereflekser og ekstensorplantarrespons. Der er gentagne gange blevet rapporteret om spejlbevægelser (MM) i ALS (2-4), men de er stadig ikke en del af de diagnostiske kriterier. MM’er er ufrivillige bevægelser kontralateralt i forhold til en tilsigtet fingerbevægelse. MM’er kan ses hos normale børn op til 10-årsalderen, men deres prævalens og intensitet falder efter denne alder (5-7), hvilket sandsynligvis afspejler modningen af corpus callosum (8). Vedvarende eller ny manifestation af MMs hos voksne kan skyldes en række forskellige etiologier. Persisterende medfødte MM’er er blevet beskrevet i forskellige tilstande, der spænder fra fravær af andre neurologiske abnormiteter til alvorlig medfødt hemiparese i forbindelse med cerebral parese (9). MM’er er også blevet rapporteret i forbindelse med en række andre erhvervede tilstande såsom Parkinsons sygdom (10, 11) eller slagtilfælde (12, 13). To hovedhypoteser for udviklingen af MM’er blev diskuteret: unormal udvikling af det primære motoriske system, der involverer den ipsilaterale kortikospinale bane, og mangel på contralaterale motoriske cortex-hæmningsmekanismer, hovedsagelig gennem corpus callosum (9, 14). Det patofysiologiske grundlag for MM’er i alle disse erhvervede kliniske tilstande menes at være resultatet af en fremherskende ændring af de callosale projektionsveje. Ikke desto mindre synes en yderligere eller allerede eksisterende kortikal eller pyramidal funktionsfejl at være nødvendig for udviklingen af MMs (2). Desuden har MM’er vist sig at være forbundet med nedsat transcallosal hæmning (TI) som målt ved transkraniel magnetisk stimulation (TMS) i ALS, PD og slagtilfælde (3, 4, 15-17). Uanset den nøjagtige patofysiologiske mekanisme for MM’er er det vigtigste kliniske aspekt, at de afspejler CNS-involvering af den underliggende patologiske tilstand. Diffusions-MRI-teknikker som f.eks. diffusionstensorbilleddannelse (DTI) er blevet etableret til at undersøge integriteten af neuronale baner in vivo i den menneskelige hjerne. DTI-undersøgelser har fundet ændringer i fiberbanernes integritet ved neurodegenerative sygdomme som Alzheimers sygdom og ALS (18-21), herunder callosal involvering (22-24). I en observationsundersøgelse blev der fundet en konsekvent reduktion i den fraktionelle anisotropi i corpus callosum hos ALS-patienter, der strækker sig rostralt og bilateralt til regionen for de primære motoriske cortexer (23). En nyere undersøgelse, der anvender DTI og TMS til karakterisering af neurodegeneration i ALS og konkluderede en komplementær rolle som diagnostiske biomarkører for UMN-dysfunktion (25). Ellis og kolleger fandt en signifikant stigning i den gennemsnitlige diffusivitet og reduktion af den fraktionelle anisotropi langs den kortikospinale bane hos ALS-patienter med korrelation til sygdommens sværhedsgrad og UMN-involvering (26). Ingen af disse undersøgelser fokuserede på MMs eller funktionel konnektivitet i ALS.
Derfor undersøgte vi foreninger af funktionelle TMS-målinger med diffusionsmarkører for strukturel integritet af corpus callosum og cerebrospinal tractus i en prospektiv prøve af ALS-patienter, der viser MMs, for at belyse de patofysiologiske koncepter af MMs i ALS. Vi antog, at ALS-patienter med MMs ville vise nedsat funktionel integritet af corpus callosum, der er forbundet med nedgang af strukturelle integritetsmarkører. Sådanne fund ville understøtte den rolle, som callosal dysfunktion og strukturel svækkelse spiller for MMs i ALS.
Patienter og metoder
Folk
Nitten patienter med ALS og 20 sunde kontrolpersoner gennemgik en klinisk vurdering og MR-undersøgelser, herunder DTI. Detaljerede demografiske data og kliniske karakteristika for hele undersøgelseskohorten er vist i tabel 1. Alle forsøgspersoner var højrehåndede som vurderet ved Edinburgh Handedness Inventory (27). På undersøgelsestidspunktet viste 4 patienter decideret ALS, 8 sandsynlige ALS og 4 mulige ALS i henhold til de reviderede El Escorial-kriterier (1). Tre patienter udviste en variant af nedre motoriske neuroner. Den gennemsnitlige sygdomsvarighed var 34,8 ± 34,8 måneder. Den kliniske vurdering bestod af en neurologisk undersøgelse med særlig hensyntagen til håndledighed; MM’erne blev evalueret ved sekventielt fingertapping af den ene hånd uden optisk kontrol og observation af MM’erne i henhold til Woods og Teuber’s procedure (28) og evaluering af den reviderede ALS-funktionsskala (-R) (29). For at tage hensyn til involveringen af det øvre motoriske neuron (UMN) blev der desuden beregnet en UMN-“byrde” (UMNB) ved at summere antallet af patologiske UMN-tegn ved undersøgelsen (maksimal score 16) (30). Til kognitiv screening anvendte vi “Montreal Cognitive assessment” (MOCA) (31). MOCA-scoren varierede mellem 18 og 29 med et gennemsnit på 24,5 ± 4 for ALS-patienterne og mellem 27 og 29 med et gennemsnit på 27,6 ± 0,7 for kontrolpersonerne (P = 0,006). Kontrollerne havde ingen kognitive klager og scorede inden for 1,5 standardafvigelser af den MOCA-alders- og uddannelsesjusterede normværdi.
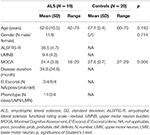
Tabel 1. Demografiske og kliniske data for alle undersøgelsespersoner.
Patienter og kontrolpersoner blev kun inkluderet i undersøgelsen, hvis der var givet skriftligt samtykke. Undersøgelsen blev godkendt af Institutional Review Board of the Medical Faculty, University of Rostock (A-2011-0026, A 2012-0083).
Transcranial Magnetic Stimulation
Vi udførte TMS hos alle patienter og hos 10 af 20 raske kontroller. Central motorisk ledningstid (CMCT), amplitutter af motorisk fremkaldte potentialer (MEP) og contralateral silent period (cSP) blev bestemt hos alle ALS-patienter og kontrolpersoner. MEP’er blev optaget fra den første dorsale interosseusmuskel (FDI) og fra den forreste tibialmuskel (TA) ved hjælp af en standard cirkulær spole (udvendig diameter 9 cm), der var forbundet med en Magstim 200-stimulator (Magstim Co., Whitland, Dyfeld, UK). Til dataindsamling blev der anvendt et kommercielt tilgængeligt MEP-system (Brain Quick System Plus, Inomed, Erlangen, Tyskland). Undersøgelse af den ipsilaterale tavse periode (iSP) blev udført med en fokal spole (ekstern loopdiameter 7 cm). Spolen blev orienteret for at inducere en posteriort-anteriorrettet strømstrøm til håndområdet i den motoriske cortex; punktet for optimal excitabilitet (POE) af FDI-musklen blev bestemt over den kontralaterale motoriske cortex; TMS blev anvendt ved POE med 1,5 gange hvilemotorisk tærskel (RMT), mens forsøgspersoner udførte en maksimal tonisk aktivering af den ipsilaterale FDI-muskel, og mens de holdt den kontralaterale FDI-muskel afslappet som offentliggjort i detaljer tidligere (3). Til bestemmelse af iSP-latens og varighed blev der anvendt 10 forsøg for hver hemisfære. Efter offline retskrivning og midling af EMG-signalerne blev iSP-parametre analyseret.
MRI-optagelse
MRI-optagelser af hjernen blev udført ved hjælp af en 3-Tesla MRI-skanner med en 32-kanals phased-array hovedspole og parallelle billeddannelsesmuligheder (Magnetom Verio, Siemens, Erlangen, Tyskland, software syngo MR B17). Forsøgspersonerne blev scannet i en enkelt session uden at ændre deres position i scanneren. Følgende sekvenser blev anvendt: Vi erhvervede en sagittal højopløsningsT1-vægtet magnetiseringsforberedt hurtigt erhvervet gradienteko (MP-RAGE) 3D-sekvens, matrixstørrelse 256 × 256 × 192, isometrisk voxelstørrelse 1,0 mm3), TE/TI/TR på 4,82 ms/1.100 ms/2.500 ms, flipvinkel 7°. For at identificere læsioner i den hvide substans blev der udført en todimensionel T2-vægtet sekvens (Fluid Attenuation Inversion Recovery FLAIR, matrixstørrelse 384 × 187, 24 skiver med en skivetykkelse på 5,0 mm, TE/TI/TR på 94 ms/2 500 ms/9 000 ms, flipvinkel 150°). Diffusionsvægtet billeddannelse blev udført med en ekkoplanar billeddannelsessekvens (TE/TR 81 ms/12 700 ms) Diffusionsgradienter blev anvendt i 30 forskellige rumlige retninger. b-værdierne var 0 og 1.000 s/mm2. Billederne havde en matrixstørrelse på 128 × 128 mm, skivetykkelse på 2 mm, den resulterende voxelstørrelse var 2,0 × 2,0 × 2,0 × 2,0 mm2.
MRI-databehandling
DTI-data blev forbehandlet ved hjælp af DTI-værktøjskassen i FSL-softwaren (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, UK, version 4.1) (32). Vi anvendte først korrektioner for hvirvelstrømme og hovedbevægelse. Kraniet blev fjernet ved hjælp af Brain Extraction Tool til differentiering af hjernevæv og ikke-hjernevæv ved hjælp af en binær maske (tærskel 0,15-0,3), og diffusionstensorerne blev tilpasset til dataene med DTI fit (FMRIB Image Analysis Group, Oxford, UK). Fraktionel anisotropi (FA) og gennemsnitlig diffusivitet (MD) kort samt axial diffusivitet (AD) og radial diffusivitet (RD) kort blev oprettet.
TBSS-analyse (tract based spatial statistics) blev udført ved hjælp af FMRIB-software (version 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSS muliggør rumlig reorientering af FA-kort til et standardrum uden systematiske virkninger af rumlig transformation på fiberbanens retningsbestemthed og uden behov for at vælge en rumlig udglatningskerne, der kan påvirke de ønskede virkninger (22). Behandlingen af diffusivitetskort bestod af følgende trin: FA-kort blev transformeret til MNI-rum (Montreal Neurologic Institute). Normaliserede FA-kort for alle forsøgspersoner blev gennemsnitliggjort og skeletoniseret med en standardiseret tærskelværdi på 0,2. Baseret på undersøgelsen specifik med stofskeletter blev der oprettet et individuelt skelet for hvert emne.
For specifik analyse af ændringer i diffusivitet af individuelle fiberbaner udførte vi en region of interest (ROI) analyse. Udvælgelsen af ROI’er fra JHU blev udført som beskrevet tidligere (34). Baseret på JHU-atlaset for hvidt stof (35) definerede vi syv regioner: corpus callosum med subregioner genu, truncus og splenium, corticospinalbane og crus posterior af den indre kapsel på begge sider. Databehandlingen blev udført ved hjælp af Matlab-software 2013a (MathWorks Inc., MA, Natrick, USA) (figur 1) (figur 1).
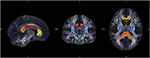
Figur 1. Figuren viser overlapningen af det gennemsnitlige FA-skeletkort for vores prøve (blå) og den normaliserede MNI-FA-skabelon og de definerede interesseområder baseret på JHU White matter atlas: genu (gul), krop (rød) og Splenium (orange) af Corpus callosum, CST begge steder (grøn) og crus posterior af den interne capsula på begge sider (lyseblå).
For analyse af korrelation mellem TMS-værdier og DTI-målinger udførte vi en region of interest (ROI)-analyse ved hjælp af MarsBaR (36) for at udtrække middelværdier fra henholdsvis corpus callosum og venstre og højre corticospinal tractus.
Statistisk analyse
Statistisk analyse blev udført for de kliniske scorer, TMS-målinger og ROI-data i SPSS (version IBM SPSS statistics 20). Til analysen af hele hjernen blev der anvendt værktøjskassen “Randomize” under TBSS i FMRIB (version 4.1 www.fmrib.ox.ac.uk/fsl). Alle kliniske scorer og TMS-parametre viste en normalfordeling, hvilket blev testet ved hjælp af Kolmogorov Smirnov-test (P > 0,1). Forskelle i TMS-parametre blev sammenlignet mellem grupperne ved hjælp af Student’s t-test. Resultaterne af iSP-målinger blev dikotomiseret i patologisk vs. ikke-patologisk og analyseret ved hjælp af Chi2-test.
For ROI-analyse blev gruppesammenligninger af FA for patienter og kontroller udført i henhold til resultaterne af patologisk iSP og ikke-patologisk iSP i en univariat variansanalyse og efterfølgende post-hoc-test. Endvidere blev der beregnet korrelationer mellem iSP-fund og ALSFRS og FA-parametre for alle undersøgte ROI’er. Til korrelationsanalyse blev Spearman-Rank-korrelation anvendt, og signifikans blev fastsat til P < 0,05. Til analyse af hele hjernen undersøgte vi gruppeforskelle i fraktionel anisotropi og gennemsnitlig diffusivitet ved hjælp af den generelle lineære model på voxelbasis. Der blev udført analyser af hele hjernen for alle diffusionsparametre. FA-, MD-, RD- og AD-kort blev sammenlignet ved univariat variansanalyse (faktor: gruppe, covariat: ALSFRS-R og UMNB). For at undgå overvurdering af signifikansen blev der anvendt en test af multiple sammenligninger (familievis fejlmetode), og signifikansen blev fastsat til P < 0,05.
Resultater
TMS Resultater
TMS-undersøgelse hos ALS-patienter afslørede en gennemsnitlig iSP-latens på 41,3 ± 5,4 ms/40,9 ± 5,7 ms (højre/venstre), hvilket var længere end hos de raske kontroller 39,0 ± 4,6/37,7 ± 6,3 (højre/venstre) (p = 0,006/0,012). Der blev ikke fundet nogen forskelle for iSP-varigheden mellem ALS-patienterne og kontrolpersonerne. Tolv ALS-patienter (63,2 %), men ingen af kontrolpersonerne viste tab af iSP. cSP var numerisk kortere hos ALS-patienter end hos kontrolpersoner uden at nå signifikans. ALS-patienterne havde en signifikant lavere gennemsnitlig RMT sammenlignet med kontrollerne (TMS-resultaterne er vist i detaljer i tabel 2 og figur 2).

Tabel 2. TMS-resultater hos ALS-patienter og kontroller.
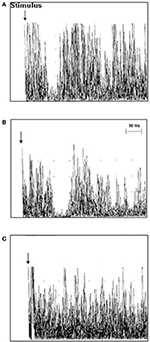
Figur 2. Ipsilaterale muskelsvar (10 rektificerede og overlejrede EMG-spor) optaget fra den første dorsale interosseusmuskel (FDI) hos individuelle ALS-patienter og kontroller. (A) latenstiden for iSP var normal i kontroltilfælde 3 (37,8 ms), (B) latenstiden for iSP var forlænget i ALS-patienttilfælde 11 (51 ms), og (C) ALS-patienttilfælde 18 udviste et tab af iSP.
Gruppeforskelle i fraktionel anisotropi og gennemsnitlig diffusivitet
Med hensyn til analyserne af præspecificerede ROI’er var FA-værdierne af CST signifikant lavere hos ALS-patienter sammenlignet med kontroller. FA-værdierne af de forskellige ROI’er i corpus callosum (genu, splenium og krop) var ikke forskellige mellem de to grupper (tabel 3). AD- og RD-værdier viste lignende resultater. Helhjerneanalyser viste ingen forskelle i FA, MD, RD og AD mellem ALS-patienter og kontroller på et FWE-korrigeret signifikansniveau.

Tabel 3. DTI-fund hos ALS-patienter og kontroller .
Korrelation mellem kliniske parametre, TMS-parametre og DTI-målinger
Vi fandt signifikante negative korrelationer af FA-værdier af CST med RMT-værdier på begge sider hos ALS-patienter, men ikke hos kontroller (Tabel 4). Der var ingen signifikant korrelation mellem FA-værdier og iSP-parametre (Tabel 4). Derimod var der en signifikant korrelation mellem ALS-FRS-R-scoringer og FA-værdier af CST på begge sider (r CST-højre, ALS-FRS-R = 0,58, p = 0,009 og r CST-venstre, LS-FRS-R = 0,05, p = 0,02), men ikke med FA-værdier af corpus callosum.
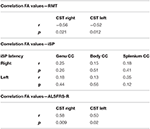
Tabel 4. Korrelationer mellem TMS og DTI.
Diskussion
Dysfunktion af de nedre og øvre motoriske neuroner er et klinisk kendetegn for ALS. Udover involvering af primære motoriske områder er der også blevet foreslået en tidlig callosal dysfunktion i ALS (37). MM’er kan være et klinisk tegn på dysfunktionelle transcallosale veje og kunne observeres hos ~30% af ALS-patienterne. Yderligere beviser for fortolkningen af MMs som markører for callosal dysfunktion kommer fra en række TMS-undersøgelser, der viser callosal dysfunktion som indikeret af nedsat transcallosal hæmning (2-4, 15) i forbindelse med tilstedeværelsen af MMs i ALS og andre tilstande som Parkinsons sygdom (16). Desuden har flere DTI-undersøgelser vist mikrostrukturelle ændringer ikke kun i pyramidalbanen, men også i corpus callosum i ALS (22, 23, 38). Callosal involvering er blevet vist at være et relativt konsekvent træk ved ALS, selv uden klinisk UMN-involvering, og kan afspejle interhemisfærisk spredning af patologi og en forringet strukturel motorisk konnektivitet (23, 24).
I den aktuelle undersøgelse forventede vi en signifikant korrelation mellem DTI-målinger og TMS-fund, der afspejler transcallosal hæmning hos ALS-patienter med MM’er. I overensstemmelse med vores forventning fandt vi en forringet transcallosal hæmning i op til 68% af tilfældene, hvilket er i overensstemmelse med tidligere offentliggjorte data fra uafhængige kohorter (3, 4). I modsætning hertil viste ALS-patienter med MM’er i den nuværende prøve imidlertid ikke mikrostrukturel involvering af corpus callosum, hvilket er i modsætning til nogle (22, 34), men ikke alle tidligere undersøgelser (39). En fortolkning af manglen på corpus callosum-forandringer i vores undersøgelse kan være, at vores patienter udviste en tidligere funktionel forstyrrelse, der potentielt gik forud for de mikrostrukturelle fund i transcallosale veje. Således omfattede de to tidligere undersøgelser, der fandt diffusionsændringer i corpus callosum (23, 41), funktionelt mere avancerede tilfælde (gennemsnitlig ALSFRS-R score henholdsvis 33,1 og 36,5 sammenlignet med 38,5 i den aktuelle undersøgelse). En nyere undersøgelse påviste øget AD i corpus callosum og reduktion af FA i højre CST i ALS uden hensyntagen til MM’er (25). Undersøgelsen af Geraldo et al. havde ikke fokus på elektrofysiologiske ændringer i de transcallosalt projicerende baner, men kortikal excitabilitet og CST-ledningsegenskaber blev testet ved undersøgelse af den hvilemotoriske tærskel (RMT) som mål for kortikal excitabilitet og den centrale motoriske ledningstid (CMCT). I betragtning af at Geraldo og kolleger brugte en anden lille håndmuskel som målmuskel (abductor digiti minimi vs. første dorsale interosseus-muskel i vores undersøgelse), var RMT lidt lavere i vores undersøgelse, hvilket afspejler en større kortikal excitabilitet i vores kohorte med MM’er. CMCT-målinger viste sammenlignelige værdier som i vores undersøgelse. Ved at udvide disse tidligere resultater til ALS-patienter med MM’er kunne vi replikere FA-reduktion af CST i forbindelse med TMS-ændringer i ALS uden virkninger i corpus callosum. En anden forklaring på den manglende signifikans af DTI-fund i corpus callosum i vores prøve kan være den relativt store heterogenitet af patienterne, som udgør en begrænsning af vores undersøgelse. En anden begrænsning er det lave antal patienter. En væsentlig årsag til denne omstændighed kan være den relative sjældenhed af MM’er, som kun kunne observeres hos ca. 30 % af ALS-patienterne. På grund af begrænsninger i de tilgængelige personaleressourcer kunne undersøgelsesperioden ikke forlænges.
Det kan konkluderes, at dette er den første undersøgelse, der undersøger en kohorte af ALS-patienter, som alle udviste MM’er. Den foreliggende undersøgelse replikerer og udvider tidligere resultater om reduceret fiberbanearbejdseintegritet hos patienter med ALS med MMs, men undlod at vise mikrostrukturelle ændringer, der ledsager spejlbevægelser og forstyrret transcallosal inhibition. Affektion af de pyramidale baner synes at være en vigtig forudsætning for udvikling af MMs. Denne undersøgelse tilføjer yderligere beviser til forståelsen af forringet konnektivitet hos ALS-patienter. Derfor er der behov for yderligere undersøgelser i større og mere homogene kohorter.
Datatilgængelighedserklæring
Deidentificerede deltagerdata vil blive delt, såvel som undersøgelsesprotokollen og de statistiske analyser, efter rimelige anmodninger.
Ethisk erklæring
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af Institutional Review Board of the Medical Faculty, University of Rostock (A-2011-0026, A267 2012-0083). Patienterne/deltagerne gav deres skriftlige samtykke til at deltage i denne undersøgelse.
Author Contributions
MW: konception, design, udarbejdelse af manuskript, indsamling af data og endelig godkendelse af manuskriptet. NW, AG og EK: Indsamling af data, revision af manuskriptet og endelig godkendelse af manuskriptet. ST: koncept, design, analyse og fortolkning af data, udarbejdelse af manuskript, revision af manuskript og endelig godkendelse af manuskriptet.
Interessekonflikt
ST har udført nedenstående anførte arbejder (alle i Tyskland): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Kvalitetscirkel for læger i Kühlungsborn, Foredrag: “Demens og diabetes-aktuel rapport”
14.11.2018-MSD Expert-forum: NAB Alzheimer i München, deltager som konsulent
13.08.2019-Event “Diabetes og demens” i Rostock, Foredrag: “Demens og diabetes-aktuel rapport” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board i Frankfurt am Main, deltagelse som konsulent
27.09.2019-ROCHE Symposium på DGN-kongressen i Stuttgart, Talk: “Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
De resterende forfattere erklærer, at forskningen blev udført uden kommercielle eller økonomiske forbindelser, der kunne opfattes som en potentiel interessekonflikt.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited: reviderede kriterier for diagnosticering af amyotrofisk lateralsklerose. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Spejlbevægelser og ipsilaterale motorisk fremkaldte potentialer i ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/1466082020410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Spejlbevægelser i amyotrofisk lateralsklerose. Amyotroph Lateral Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Forskelle mellem “medfødte spejlbevægelser” og “associerede bevægelser” hos normale børn: et neurofysiologisk casestudie. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. En neurofysiologisk undersøgelse af spejlbevægelser hos voksne og børn. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Spejlbevægelser hos sunde mennesker gennem hele levetiden: virkninger af udvikling og aldring. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeni af ipsilaterale corticospinale projektioner: en udviklingsundersøgelse med transkraniel magnetisk stimulation. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurofysiologi af unimanual motorisk kontrol og spejlbevægelser. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Koordineringsforstyrrelser hos patienter med Parkinsons sygdom: en undersøgelse af paced rytmiske underarmsbevægelser. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s00222210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Spejlbevægelser i parkinsonisme: evaluering af et nyt klinisk tegn. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Individuelle mønstre af funktionel reorganisering i den menneskelige hjernebark efter kapselinfarkt. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganisering af motorisk output i den ikke-ramte hemisfære efter slagtilfælde. Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Hjernens anatomiske substrater af spejlbevægelser i Kallmann syndrom. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Svækket interhemisfærisk hæmning i amyotrofisk lateralsklerose. Amyotroph Lateral Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemispheric and ipsilateral connections in Parkinson’s disease: relation to mirror movements. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistens af medfødte spejlbevægelser efter hemiplegisk slagtilfælde. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD-studiegruppe. anatomisk MRI og DTI i forbindelse med diagnosticering af Alzheimers sygdom: en europæisk multicenterundersøgelse. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). På vej mod en neuroimaging-biomarkør for amyotrofisk lateralsklerose. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusionstensor-MRI af tidlig involvering af øvre motoriske neuroner i amyotrofisk lateralsklerose. Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Corpus callosum-involvering er et konsekvent træk ved amyotrofisk lateralsklerose. Neurology. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Forringet strukturelt motorisk connectom i amyotrofisk lateralsklerose. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: værdien af gennemsnitlig, aksial og radial diffusivitet og dens korrelation med elektrofysiologiske konduktivitetsændringer. Neuroradiologi. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusionstensor-MRI vurderer skader på kortikospinalbanerne i ALS. Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. Vurdering og analyse af håndledighed: Edinburgh-inventariet. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Spejlbevægelser efter hemiparese i barndommen. Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. ALSFRS-R: en revideret ALS-funktionsvurderingsskala, der inkorporerer vurderinger af respiratorisk funktion. BDNF ALS-studiegruppen (fase III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Bevis for udbredt cerebral mikroglial aktivering i amyotrofisk lateralsklerose: en (R)-PK11195 positronemissionstomografiundersøgelse. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Fremskridt inden for funktionel og strukturel MR-billedanalyse og implementering som FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelvis analyse af diffusionsdata fra flere emner. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum: association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces: analyser af anatomi af hvidt stof og tract-specifik kvantificering. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Region of interest-analyse ved hjælp af SPM-værktøjskassen (resumé). Præsenteret på den 8. internationale konference om funktionel kortlægning af den menneskelige hjerne, 2.-6. juni 2002, Sendai, Japan. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Callosal dysfunktion i amyotrofisk lateral sleose korrelerer med diffusionstensorafbildning af det centrale motoriske system. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Mikrostrukturelle ændringer i den hvide substans, der ligger til grund for kognitiv og adfærdsmæssig svækkelse i ALS-en in vivo undersøgelse ved hjælp af DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar