- Introduktion
- Patienter och metoder
- Subjekt
- Transkraniell magnetisk stimulering
- MRI-köp
- MRI-databehandling
- Statistisk analys
- Resultat
- TMS-resultat
- Gruppskillnader i fraktionell anisotropi och genomsnittlig diffusivitet
- Korrelation mellan kliniska parametrar, TMS-parametrar och DTI-mått
- Diskussion
- Data Availability Statement
- Ethics Statement
- Författarnas bidrag
- Intressekonflikt
Introduktion
Amyotrofisk lateralskleros (ALS) är en progressiv neurodegenerativ sjukdom som huvudsakligen kännetecknas av ett motoriskt syndrom med varierande uttryck av dysfunktion i nedre (LMN) och övre (UMN) motoriska neuroner. El Escorial-kriterierna (1) kräver UMN- och LMN-inblandning i en eller flera kroppsregioner för att ställa diagnosen definitiv ALS. UMN-tecken kan vara spasticitet, förstärkta eller bevarade senreflexer och extensor plantarrespons. Spegelrörelser (MM) har upprepade gånger rapporterats vid ALS (2-4), men ingår fortfarande inte i diagnoskriterierna. MMs är ofrivilliga rörelser kontralateralt till en avsedd fingerrörelse. MMs kan ses hos normala barn upp till 10 års ålder, men deras prevalens och intensitet minskar efter denna ålder (5-7), vilket sannolikt återspeglar mognaden av corpus callosum (8). Persistens eller nya manifestationer av MMs hos vuxna kan bero på en mängd olika etiologier. Persisterande medfödda MMs har beskrivits i olika tillstånd som sträcker sig från avsaknad av andra neurologiska avvikelser till allvarlig medfödd hemipares i samband med cerebral pares (9). MM har också rapporterats i en rad andra förvärvade tillstånd som Parkinsons sjukdom (10, 11) eller stroke (12, 13). Två huvudhypoteser för utvecklingen av MM har diskuterats: onormal utveckling av det primära motoriska systemet, som involverar den ipsilaterala kortikospinalbanan, och avsaknad av kontralaterala inhibitionsmekanismer i motorcortex, huvudsakligen genom corpus callosum (9, 14). Den patofysiologiska grunden för MMs i alla dessa förvärvade kliniska tillstånd tros vara resultatet av en dominerande förändring av callosala projicerande vägar. Det tycks dock krävas ytterligare eller redan existerande kortikala eller pyramidala funktionsstörningar för att MMs ska kunna utvecklas (2). Dessutom har MM konstaterats vara förknippade med minskad transkallosal hämning (TI) som mäts med transkraniell magnetstimulering (TMS) vid ALS, PD och stroke (3, 4, 15-17). Oavsett den exakta patofysiologiska mekanismen för MMs är den viktigaste kliniska aspekten att de återspeglar CNS-inblandning av det underliggande patologiska tillståndet. Diffusions-MRI-tekniker, t.ex. diffusionstensorbildning (DTI), har etablerats för att studera integriteten hos neuronala banor in vivo i den mänskliga hjärnan. I DTI-studier har man funnit förändringar av fiberbanornas integritet vid neurodegenerativa sjukdomar som Alzheimers sjukdom och ALS (18-21), inklusive callosal involvering (22-24). I en observationsstudie fann man en konsekvent minskning av den fraktionella anisotropin i corpus callosum hos ALS-patienter, som sträckte sig rostralt och bilateralt till regionen för de primära motoriska kortiklarna (23). I en nyare studie användes DTI och TMS för karakterisering av neurodegeneration vid ALS och man kom fram till en kompletterande roll som diagnostiska biomarkörer för UMN-dysfunktion (25). Ellis och medarbetare fann en signifikant ökning av den genomsnittliga diffusiviteten och en minskning av den fraktionella anisotropin längs kortikospinalbanan hos ALS-patienter med korrelation till sjukdomens svårighetsgrad och UMN-inblandning (26). Ingen av dessa studier fokuserade på MMs eller funktionell konnektivitet i ALS.
Därför studerade vi associationer av funktionella TMS-mått med diffusionsmarkörer för strukturell integritet i corpus callosum och cerebrospinalbanan i ett prospektivt urval av ALS-patienter som uppvisar MMs för att belysa de patofysiologiska koncepten för MMs i ALS. Vi antog att ALS-patienter med MMs skulle visa försämrad funktionell integritet i corpus callosum, i samband med försämring av strukturella integritetsmarkörer. Sådana fynd skulle stödja rollen av callosal dysfunktion och strukturell försämring för MMs i ALS.
Patienter och metoder
Subjekt
Nitton patienter med ALS och 20 friska kontrollpersoner genomgick en klinisk bedömning och MRT-undersökningar, inklusive DTI. Detaljerade demografiska data och kliniska egenskaper för hela studiekohorten visas i tabell 1. Alla försökspersoner var högerhänta enligt bedömning med Edinburgh handedness inventory (27). Vid undersökningstillfället uppvisade 4 patienter definitiv ALS, 8 sannolika ALS och 4 möjliga ALS enligt de reviderade El Escorial-kriterierna (1). Tre patienter uppvisade en variant av nedre motorneuron. Den genomsnittliga sjukdomsdurationen var 34,8 ± 34,8 månader. Den kliniska bedömningen bestod av en neurologisk undersökning med särskild hänsyn till handledarskap; MMs utvärderades genom sekventiell fingertoppning med en hand utan optisk kontroll och observation av MMs enligt Woods och Teubers förfarande (28) samt utvärdering av den reviderade ALS-funktionsskattningsskalan (-R) (29). För att ta hänsyn till involveringen av övre motorneuron (UMN) beräknades dessutom en UMN-”börda” (UMNB) genom att summera antalet patologiska UMN-tecken vid undersökningen (maxpoäng 16) (30). För kognitiv screening använde vi ”Montreal Cognitive assessment” (MOCA) (31). MOCA-poängen varierade mellan 18 och 29 med ett genomsnitt på 24,5 ± 4 för ALS-patienterna och mellan 27 och 29 med ett genomsnitt på 27,6 ± 0,7 för kontrollerna (P = 0,006). Kontrollerna hade inga kognitiva besvär och fick poäng inom 1,5 standardavvikelser från det ålders- och utbildningsjusterade normvärdet för MOCA.
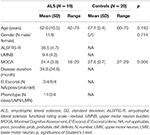
Tabell 1. Demografiska och kliniska data för alla studiedeltagare.
Patienter och kontrollindivider ingick endast i studien om skriftligt samtycke gavs. Studien godkändes av Institutional Review Board of the Medical Faculty, University of Rostock (A-2011-0026, A 2012-0083).
Transkraniell magnetisk stimulering
Vi utförde TMS på alla patienter och på 10 av 20 friska kontroller. Central motorisk ledningstid (CMCT), amplituder för motoriskt framkallade potentialer (MEP) och contralateral silent period (cSP) bestämdes hos alla ALS-patienter och kontrollpersoner. MEP registrerades från den första dorsala interosseusmuskeln (FDI) och från den främre tibialmuskeln (TA) med hjälp av en cirkulär standardspole (ytterdiameter 9 cm) ansluten till en Magstim 200-stimulator (Magstim Co., Whitland, Dyfeld, Storbritannien). För datainsamling användes ett kommersiellt tillgängligt MEP-system (Brain Quick System Plus, Inomed, Erlangen, Tyskland). Undersökning av den ipsilaterala tysta perioden (iSP) utfördes med en fokal spole (extern loopdiameter 7 cm). Spolen orienterades för att inducera ett posterior-anterioriskt riktat strömflöde till handområdet i den motoriska cortexen; punkten för optimal excitabilitet (POE) för FDI-muskeln bestämdes över den kontralaterala motoriska cortexen; TMS applicerades vid POE med 1,5 gånger vilomotorisk tröskel (RMT) medan försökspersonerna utförde en maximal tonisk aktivering av den ipsilaterala FDI-muskeln och medan de höll den kontralaterala FDI-muskeln avslappnad, enligt vad som tidigare har publicerats i detalj (3). För bestämning av iSP-latens och varaktighet användes 10 försök för varje hemisfär. Efter offlinekorrigering och medelvärdesbildning av EMG-signalerna analyserades iSP-parametrarna.
MRI-köp
MRI-köp av hjärnan genomfördes med hjälp av en 3-Tesla MRI-skanner med en 32-kanalig phased-array-huvudspole och parallella avbildningsmöjligheter (Magnetom Verio, Siemens, Erlangen, Tyskland, programvara syngo MR B17). Försökspersonerna skannades i en enda session utan att byta position i skannern. Följande sekvenser användes: Vi förvärvade en sagittal högupplöstT1-viktad magnetiseringsförberedd snabbt förvärvad gradienteko (MP-RAGE) 3D-sekvens, matrisstorlek 256 × 256 × 192, isometrisk voxelstorlek 1,0 mm3), TE/TI/TR 4,82 ms/1 100 ms/2 500 ms, flipvinkel 7°. För att identifiera lesioner i den vita substansen utfördes en tvådimensionell T2-viktad sekvens (fluid attenuation inversion recovery FLAIR, matrisstorlek 384 × 187, 24 skikt med en skivtjocklek på 5,0 mm, TE/TI/TR 94 ms/2 500 ms/9 000 ms, flipvinkel 150°). Diffusionsviktad avbildning utfördes med en ekoplanär avbildningssekvens (TE/TR 81 ms/12 700 ms) Diffusionsgradienter tillämpades i 30 olika rumsliga riktningar. Värdena för b var 0 och 1 000 s/mm2. Bilderna hade en matrisstorlek på 128 × 128 mm, skivtjocklek på 2 mm, den resulterande voxelstorleken var 2,0 × 2,0 × 2,0 mm2.
MRI-databehandling
DTI-data förbehandlades med hjälp av DTI-verktygslådan i FSL-mjukvaran (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, Storbritannien, version 4.1) (32). Vi tillämpade först korrigeringar för virvelströmmar och huvudrörelser. Skallen strippades med hjälp av Brain Extraction Tool för differentiering av hjärnvävnad och icke-hjärnvävnad med hjälp av en binär mask (tröskelvärde 0,15-0,3) och diffusionstensorerna anpassades till data med DTI fit (FMRIB Image Analysis Group, Oxford, UK). Fraktionell anisotropi (FA) och kartor över genomsnittlig diffusivitet (MD) samt kartor över axiell diffusivitet (AD) och radiell diffusivitet (RD) skapades.
TBSS-analyser (traktbaserad rumslig statistik) utfördes med hjälp av FMRIB-programvaran (version 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSS möjliggör rumslig omorientering av FA-kartor till ett standardutrymme utan systematiska effekter av den rumsliga transformationen på fiberbanans riktning och utan att behöva välja en rumslig utjämningskärna som kan påverka de önskade effekterna (22). Behandlingen av diffusivitetskartor bestod av följande steg: FA-kartor transformerades till MNI-rymd (Montreal Neurologic Institute). Normaliserade FA-kartor för alla försökspersoner medelvärdesbildades och skeletoniserades med ett standardiserat tröskelvärde på 0,2. Baserat på studien specifik med materieskelett skapades ett individuellt skelett för varje försöksperson.
För specifik analys av förändringar i diffusivitet hos enskilda fiberbanor genomförde vi en region of interest (ROI)-analys. Urvalet av ROI:er från JHU gjordes enligt tidigare beskrivning (34). Baserat på JHU:s atlas för vit substans (35) definierade vi sju regioner: corpus callosum med subregionerna genu, truncus och splenium, kortikospinalbanan och crus posterior av den inre kapseln på båda sidor. Databehandlingen gjordes med hjälp av Matlab-programvaran 2013a (MathWorks Inc., MA, Natrick, USA) (figur 1).
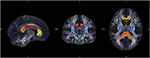
Figur 1. Figuren visar överlappningen mellan den genomsnittliga FA-skelettkartan för vårt prov (blått) och den normaliserade MNI-FA-mallen och de definierade intresseområdena baserade på JHU White matter atlas: genu (gult), body (rött) och Splenium (orange) av Corpus callosum, CST båda sidorna (grönt) och crus posterior av den inre kapseln på båda sidorna (ljusblått).
För analys av korrelation mellan TMS-värden och DTI-mått utförde vi en region of interest (ROI)-analys med MarsBaR (36) för att extrahera medelvärden från corpus callosum respektive vänster och höger kortikospinalbana.
Statistisk analys
Statistisk analys utfördes för de kliniska värdena, TMS-mätningarna och ROI-data i SPSS (version IBM SPSS statistics 20). För analysen av hela hjärnan användes verktygslådan ”Randomize” under TBSS i FMRIB (version 4.1 www.fmrib.ox.ac.uk/fsl). Alla kliniska poäng och TMS-parametrar uppvisade en normalfördelning, vilket testades med hjälp av Kolmogorov Smirnov-testet (P > 0,1). Skillnader i TMS-parametrar jämfördes mellan grupperna med hjälp av Students t-test. Resultaten av iSP-mätningar dikotomiserades i patologisk vs. icke-patologisk och analyserades med hjälp av Chi2-test.
För ROI-analys utfördes gruppjämförelser av FA hos patienter och kontroller i enlighet med fynden av patologisk iSP och icke-patologisk iSP i en univariat variansanalys och efterföljande post-hoc-tester. Dessutom beräknades korrelationer mellan iSP-fynd och ALSFRS och FA-parametrar för alla undersökta ROI:er. För korrelationsanalys användes Spearman-Rank-korrelation och signifikans sattes till P < 0,05. För analys av hela hjärnan undersökte vi gruppskillnader i fraktionell anisotropi och genomsnittlig diffusivitet med hjälp av den allmänna linjära modellen på voxelbasis. Analyser av hela hjärnan utfördes för alla diffusionsparametrar. FA-, MD-, RD- och AD-kartor jämfördes genom univariat variansanalys (faktor: grupp, kovariat: ALSFRS-R och UMNB). För att undvika överskattning av signifikans tillämpades ett test av multipla jämförelser (familjevis felmetod) och signifikans fastställdes till P < 0,05.
Resultat
TMS-resultat
TMS-undersökning hos ALS-patienter visade en genomsnittlig iSP-latens på 41,3 ± 5,4 ms/40,9 ± 5,7 ms (höger/vänster), vilket var längre än hos de friska kontrollerna 39,0 ± 4,6/37,7 ± 6,3 (höger/vänster) (p = 0,006/0,012). Inga skillnader hittades för iSP-varaktigheten mellan ALS-patienterna och kontrollpersonerna. Tolv ALS-patienter (63,2 %), men ingen av kontrollerna uppvisade förlust av iSP. cSP var numeriskt kortare hos ALS-patienter än hos kontrollerna utan att nå signifikans. ALS-patienterna hade en signifikant lägre genomsnittlig RMT jämfört med kontrollerna (TMS-resultaten visas i detalj i tabell 2 och figur 2).

Tabell 2. TMS-resultat hos ALS-patienter och kontroller.
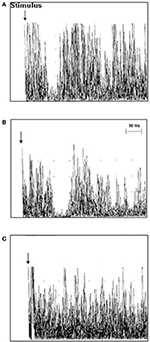
Figur 2. Ipsilaterala muskelsvar (10 rektifierade och överlagrade EMG-spår) som registrerats från den första dorsala interosseösa muskeln (FDI) hos enskilda ALS-patienter och kontroller. (A) Latency för iSP var normal i kontrollfall 3 (37,8 ms), (B) iSP-latency var förlängd i ALS-patientfall 11 (51 ms), och (C) ALS-patientfall 18 uppvisade en förlust av iSP.
Gruppskillnader i fraktionell anisotropi och genomsnittlig diffusivitet
Vid analyser av förspecificerade ROI:er var FA-värdena i CST signifikant lägre hos ALS-patienter jämfört med kontroller. FA-värdena för de olika ROIs i corpus callosum (genu, splenium och body) skiljde sig inte åt mellan de båda grupperna (tabell 3). AD- och RD-värdena visade liknande resultat. Analysen av hela hjärnan visade inga skillnader i FA, MD, RD och AD mellan ALS-patienter och kontroller på en FWE-korrigerad signifikansnivå.

Tabell 3. DTI-fynd hos ALS-patienter och kontroller .
Korrelation mellan kliniska parametrar, TMS-parametrar och DTI-mått
Vi fann signifikanta negativa korrelationer mellan FA-värdena i CST och RMT-värdena på båda sidor hos ALS-patienter, men inte hos kontrollerna (tabell 4). Det fanns ingen signifikant korrelation mellan FA-värden och iSP-parametrar (tabell 4). Däremot fanns det en signifikant korrelation mellan ALS-FRS-R-poäng och FA-värden för CST på båda sidor (r CST-högre, ALS-FRS-R = 0,58, p = 0,009 och r CST-vänster, LS-FRS-R = 0,05, p = 0,02), men inte med FA-värdena för corpus callosum.
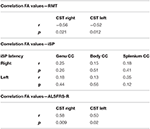
Tabell 4. Korrelationer mellan TMS och DTI.
Diskussion
Dysfunktion av nedre och övre motoriska neuroner är ett kliniskt kännetecken för ALS. Förutom involvering av primära motoriska områden har en tidig callosal dysfunktion också föreslagits vid ALS (37). MMs kan vara ett kliniskt tecken på dysfunktionella transkallosala vägar och skulle kunna observeras hos ~30 % av ALS-patienterna. Ytterligare bevis för tolkningen av MMs som markörer för callosal dysfunktion kommer från en rad TMS-studier som visar callosal dysfunktion som indikeras av försämrad transcallosal hämning (2-4, 15) i samband med förekomsten av MMs i ALS och andra tillstånd som Parkinsons sjukdom (16). Dessutom har flera DTI-studier visat mikrostrukturella förändringar inte bara i pyramidalbanan utan även i corpus callosum vid ALS (22, 23, 38). Callosal involvering har visat sig vara ett relativt konsekvent kännetecken för ALS, även utan klinisk UMN-inblandning, och kan återspegla interhemisfärisk spridning av patologi och en försämrad strukturell motorisk konnektivitet (23, 24).
I den aktuella studien förväntade vi oss en signifikant korrelation mellan DTI-mått och TMS-fynd som reflekterar transkallosal hämning hos ALS-patienter med MMs. I enlighet med vår förväntan fann vi en försämrad transcallosal hämning i upp till 68 % av fallen, vilket är i linje med tidigare publicerade data från oberoende kohorter (3, 4). Däremot uppvisade dock ALS-patienter med MMs i det aktuella urvalet ingen mikrostrukturell involvering av corpus callosum, vilket står i kontrast till vissa (22, 34), men inte alla tidigare studier (39). En tolkning av avsaknaden av förändringar i corpus callosum i vår studie kan vara att våra patienter uppvisade en tidigare funktionell störning som eventuellt föregick de mikrostrukturella fynden i transcallosala banor. Således omfattade de två tidigare studier som fann diffusionsförändringar i corpus callosum (23, 41) funktionellt mer avancerade fall (genomsnittlig ALSFRS-R-poäng 33,1 respektive 36,5, jämfört med 38,5 i den aktuella studien). I en nyligen genomförd studie påvisades ökad AD i corpus callosum och minskning av FA i höger CST vid ALS utan hänsyn till MMs (25). Studien av Geraldo et al. hade inget fokus på elektrofysiologiska förändringar i de transkallosalt projicerade banorna, men kortikal excitabilitet och CST:s ledningsegenskaper testades genom undersökning av resting motor threshold (RMT) som mått på kortikal excitabilitet och central motorisk ledningstid (CMCT). Med tanke på att Geraldo och medarbetare använde en annan liten handmuskel som målmuskel (abductor digiti minimi jämfört med första dorsala interosseusmuskeln i vår studie) var RMT något lägre i vår studie, vilket återspeglar en större kortikal excitabilitet i vår kohort som uppvisar MM. CMCT-mätningar uppvisade jämförbara värden som i vår studie. Genom att utvidga dessa tidigare resultat till ALS-patienter med MMs kunde vi replikera FA-reduktion av CST i samband med TMS-förändringar i ALS, utan effekter i corpus callosum. En annan förklaring till bristen på betydelse av DTI-fynd i corpus callosum i vårt urval kan vara den relativt stora heterogeniteten hos patienterna, vilket utgör en begränsning i vår studie. En annan begränsning är det låga antalet patienter. En viktig orsak till denna omständighet kan vara den relativa sällsyntheten av MMs, som kunde observeras hos endast cirka 30 % av ALS-patienterna. På grund av begränsningar i tillgänglig personalresurs kunde studieperioden inte förlängas.
Sammanfattningsvis är detta den första studien som undersöker en kohort av ALS-patienter som alla uppvisade MMs. Den aktuella studien replikerar och utökar tidigare fynd om minskad fiberbanksintegritet hos patienter med ALS med MMs, men misslyckades med att visa mikrostrukturella förändringar som åtföljer spegelrörelser och störd transcallosal hämning. Affektion av pyramidalbanan verkar vara en viktig förutsättning för utveckling av MMs. Denna studie ger ytterligare bevis för förståelsen av nedsatt konnektivitet hos ALS-patienter. Därför behövs ytterligare studier i större och mer homogena kohorter.
Data Availability Statement
Deidentifierade deltagardata kommer att delas, liksom studieprotokollet och de statistiska analyserna, på rimliga förfrågningar.
Ethics Statement
Studierna som involverar mänsklig deltagare granskades och godkändes av institutionell granskningsnämnd vid den medicinska fakulteten vid Rostocks universitet (A-2011-0026, A267 2012-0083). Patienterna/deltagarna gav sitt skriftliga samtycke till att delta i denna studie.
Författarnas bidrag
MW: idé, design, utarbetande av manuskriptet, insamling av data och slutligt godkännande av manuskriptet. NW, AG och EK: insamling av data, revidering av manuskriptet och slutligt godkännande av manuskriptet. ST: koncept, design, analys och tolkning av data, utarbetande av manuskriptet, revidering av manuskriptet och slutligt godkännande av manuskriptet.
Intressekonflikt
ST har utfört nedanstående listade arbeten (alla i Tyskland): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-kvalitetscirkel för läkare i Kühlungsborn, föredrag: ”Dementia and Diabetes-current report”
14.11.2018-MSD Expert-forum: NAB Alzheimer i München, deltar som konsult
13.08.2019-Event ”Diabetes och demens” i Rostock, Föredrag: ”Demens och diabetes-aktuell rapport” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board i Frankfurt am Main, deltagande som konsult
27.09.2019-ROCHE Symposium vid DGN-kongressen i Stuttgart, Föredrag: ”Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
Restande författare förklarar att forskningen har utförts i avsaknad av kommersiella eller ekonomiska förbindelser som skulle kunna uppfattas som en potentiell intressekonflikt.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited: reviderade kriterier för diagnos av amyotrofisk lateralskleros. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Mirror movements and ipsilateral motor evoked potentials in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/1466082020410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mirror movements in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Skillnader mellan ”medfödda spegelrörelser” och ”associerade rörelser” hos normala barn: en neurofysiologisk fallstudie. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. En neurofysiologisk studie av spegelrörelser hos vuxna och barn. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mirror movements in healthy humans across the lifespan: effects of development and ageing. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurofysiologi för unimanuell motorisk kontroll och spegelrörelser. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Koordinationsstörningar hos patienter med Parkinsons sjukdom: en studie av paced rytmiska underarmsrörelser. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Spegelrörelser vid parkinsonism: utvärdering av ett nytt kliniskt tecken. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Individuella mönster av funktionell reorganisering i den mänskliga hjärnbarken efter kapselinfarkt. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganisering av motorisk output i den icke påverkade hemisfären efter stroke. Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical substrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impaired interhemispheric inhibition in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemisfäriska och ipsilaterala förbindelser vid Parkinsons sjukdom: relation till spegelrörelser. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistens av medfödda spegelrörelser efter hemiplegisk stroke. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD-studiegruppen. anatomisk MRT och DTI vid diagnos av Alzheimers sjukdom: en europeisk multicenterstudie. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). Mot en neuroimaging biomarkör för amyotrofisk lateralskleros. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusionstensor MRI av tidig involvering av övre motoriska neuron vid amyotrofisk lateralskleros. Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Corpus callosum involvement is a consistent feature of amyotrophic lateral sclerosis. Neurologi. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Försämrad strukturell motorisk connectom vid amyotrofisk lateralskleros. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiologi. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusionstensor MRI bedömer skador på kortikospinalbanan vid ALS. Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. Bedömning och analys av handledarskap: Edinburgh inventory. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Spegelrörelser efter hemipares i barndomen. Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. BDNF ALS-studiegruppen (fas III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Bevis på utbredd cerebral mikroglial aktivering vid amyotrofisk lateralskleros: en (R)-PK11195 positronemissionstomografiundersökning. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Framsteg inom funktionell och strukturell MR-bildanalys och genomförande som FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum: association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces: analyses of white matter anatomy and tract-specific quantification. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Region of interest analysis using SPM toolbox (sammanfattning). Presenterat vid den 8:e internationella konferensen om funktionell kartläggning av den mänskliga hjärnan, 2-6 juni 2002, Sendai, Japan. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Callosal dysfunktion i amyotrofisk lateral sleosis korrelerar med diffusionstensorbild av det centrala motoriska systemet. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Mikrostrukturella förändringar i den vita substansen som ligger till grund för kognitiv och beteendemässig försämring vid ALS-an in vivo study using DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar