- Introduction
- Patients et méthodes
- Sujets
- Stimulation magnétique transcrânienne
- Acquisition IRM
- Traitement des données IRM
- Analyse statistique
- Résultats
- Résultats TMS
- Différences de groupe dans l’anisotropie fractionnelle et la diffusivité moyenne
- Corrélation des paramètres cliniques, des paramètres TMS et des mesures DTI
- Discussion
- Data Availability Statement
- Ethics Statement
- Contributions des auteurs
- Conflit d’intérêt
Introduction
La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative progressive principalement caractérisée par un syndrome moteur avec une expression variable du dysfonctionnement des motoneurones inférieurs (LMN) et supérieurs (UMN). Les critères d’El Escorial (1) requièrent une atteinte des UMN et LMN dans une ou plusieurs régions du corps pour poser le diagnostic de SLA définitif. Les signes de l’UMN peuvent être une spasticité, des réflexes tendineux renforcés ou préservés et une réponse plantaire des extenseurs. Les mouvements miroirs (MM) ont été rapportés à plusieurs reprises dans la SLA (2-4), mais ne font toujours pas partie des critères diagnostiques. Les MM sont des mouvements involontaires contralatéraux à un mouvement de doigt prévu. Les MM peuvent être observés chez des enfants normaux jusqu’à l’âge de 10 ans, mais leur prévalence et leur intensité diminuent après cet âge (5-7), reflétant très probablement la maturation du corps calleux (8). La persistance ou la nouvelle manifestation des MM chez les adultes peut provenir de diverses étiologies. Des MM congénitaux persistants ont été décrits dans différentes conditions allant de l’absence d’autres anomalies neurologiques à une hémiparésie congénitale sévère en cas de paralysie cérébrale (9). Les MM ont également été signalés dans une variété d’autres conditions acquises telles que la maladie de Parkinson (10, 11) ou les accidents vasculaires cérébraux (12, 13). Deux hypothèses principales pour le développement des MM ont été discutées : un développement anormal du système moteur primaire, impliquant le tractus corticospinal ipsilatéral, et l’absence de mécanismes inhibiteurs du cortex moteur controlatéral, principalement par le corps calleux (9, 14). On pense que la base physiopathologique des MM dans toutes ces conditions cliniques acquises est le résultat d’une altération prédominante des voies de projection du corps calleux. Néanmoins, un dysfonctionnement cortical ou pyramidal supplémentaire ou préexistant semble être nécessaire pour le développement des MM (2). De plus, on a constaté que les MM sont associés à une réduction de l’inhibition transcallosale (IT) mesurée par stimulation magnétique transcrânienne (SMT) dans la SLA, la MP et les accidents vasculaires cérébraux (3, 4, 15-17). Quel que soit le mécanisme physiopathologique exact des MM, l’aspect clinique le plus important est qu’ils reflètent l’implication du SNC par l’état pathologique sous-jacent. Les techniques d’IRM de diffusion, comme l’imagerie du tenseur de diffusion (ITD), ont été établies pour étudier l’intégrité des trajets neuronaux in vivo dans le cerveau humain. Les études DTI ont révélé des altérations de l’intégrité des trajets des fibres dans les maladies neurodégénératives comme la maladie d’Alzheimer et la SLA (18-21), y compris l’atteinte des callosités (22-24). Une étude d’observation a révélé une réduction constante de l’anisotropie fractionnelle dans le corps calleux de patients atteints de SLA, s’étendant rostralement et bilatéralement à la région des cortex moteurs primaires (23). Une étude plus récente a utilisé la DTI et la TMS pour la caractérisation de la neurodégénérescence dans la SLA et a conclu à un rôle complémentaire en tant que biomarqueurs diagnostiques du dysfonctionnement de l’UMN (25). Ellis et ses collègues ont constaté une augmentation significative de la diffusivité moyenne et une réduction de l’anisotropie fractionnelle le long du tractus corticospinal chez les patients atteints de SLA, avec une corrélation avec la gravité de la maladie et l’implication des UMN (26). Aucune de ces études ne s’est intéressée aux MM ou à la connectivité fonctionnelle dans la SLA.
Nous avons donc étudié les associations entre les mesures fonctionnelles de la SMT et les marqueurs de diffusion de l’intégrité structurelle du corps calleux et du tractus cérébro-spinal dans un échantillon prospectif de patients atteints de SLA présentant des MM afin d’élucider les concepts physiopathologiques des MM dans la SLA. Nous avons émis l’hypothèse que les patients atteints de SLA présentant des MM présenteraient une intégrité fonctionnelle altérée du corps calleux, associée à un déclin des marqueurs d’intégrité structurelle. De tels résultats soutiendraient le rôle du dysfonctionnement callosal et de l’altération structurelle pour les MM dans la SLA.
Patients et méthodes
Sujets
Dix-neuf patients atteints de SLA et 20 sujets témoins sains ont subi une évaluation clinique, et des examens IRM, y compris DTI. Les données démographiques détaillées et les caractéristiques cliniques de l’ensemble de la cohorte d’étude sont présentées dans le tableau 1. Tous les sujets étaient droitiers, selon l’inventaire de la main d’Édimbourg (27). Au moment de l’examen, 4 patients présentaient une SLA définitive, 8 une SLA probable et 4 une SLA possible selon les critères révisés d’El Escorial (1). Trois patients présentaient une variante du motoneurone inférieur. La durée moyenne de la maladie était de 34,8 ± 34,8 mois. L’évaluation clinique a consisté en un examen neurologique avec un respect particulier de la main ; les MM ont été évaluées par le tapotement séquentiel des doigts d’une main sans contrôle optique et l’observation des MM selon la procédure de Woods et Teuber (28), et l’évaluation de l’échelle d’évaluation fonctionnelle révisée de la SLA (-R) (29). De plus, pour aborder l’implication des motoneurones supérieurs (UMN), une » charge » UMN (UMNB) a été calculée en totalisant le nombre de signes pathologiques UMN à l’examen (score maximum 16) (30). Pour le dépistage cognitif, nous avons utilisé le « Montreal Cognitive assessment » (MOCA) (31). Le score MOCA était compris entre 18 et 29 avec une moyenne de 24,5 ± 4 pour les patients atteints de SLA, et entre 27 et 29 avec une moyenne de 27,6 ± 0,7 pour les témoins (P = 0,006). Les témoins ne présentaient pas de plaintes cognitives et ont obtenu un score se situant dans un écart-type de 1,5 de la valeur de la norme ajustée en fonction de l’âge et de l’éducation du MOCA.
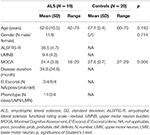
Tableau 1. Données démographiques et cliniques de tous les sujets de l’étude.
Les patients et les individus témoins n’ont été inclus dans l’étude que si un consentement écrit a été donné. L’étude a été approuvée par le conseil d’examen institutionnel de la faculté de médecine de l’Université de Rostock (A-2011-0026, A 2012-0083).
Stimulation magnétique transcrânienne
Nous avons effectué une TMS chez tous les patients et chez 10 des 20 témoins sains. Le temps de conduction motrice centrale (TMC), les amplitudes des potentiels évoqués moteurs (PEM) et la période silencieuse controlatérale (PSC) ont été déterminés chez tous les patients atteints de SLA et les sujets témoins. Les PEM ont été enregistrés à partir du premier muscle interosseux dorsal (FDI) et du muscle tibial antérieur (TA) à l’aide d’une bobine circulaire standard (diamètre extérieur de 9 cm) connectée à un stimulateur Magstim 200 (Magstim Co., Whitland, Dyfeld, UK). Pour l’acquisition des données, un système MEP disponible dans le commerce a été utilisé (Brain Quick System Plus, Inomed, Erlangen, Allemagne). L’investigation de la période silencieuse ipsilatérale (iSP) a été réalisée avec une bobine focale (diamètre de la boucle externe 7 cm). La bobine a été orientée de manière à induire un flux de courant dirigé de manière postéro-antérieure vers la zone de la main du cortex moteur ; le point d’excitabilité optimale (POE) du muscle FDI a été déterminé sur le cortex moteur controlatéral ; la TMS a été appliquée au POE avec 1,5 fois le seuil moteur au repos (RMT) pendant que les sujets effectuaient une activation tonique maximale du muscle FDI ipsilatéral et pendant qu’ils gardaient le muscle FDI controlatéral détendu, comme publié en détail précédemment (3). Pour déterminer la latence et la durée de l’iSP, 10 essais ont été utilisés pour chaque hémisphère. Après rectification hors ligne et moyennage des signaux EMG, les paramètres iSP ont été analysés.
Acquisition IRM
Les acquisitions IRM du cerveau ont été réalisées à l’aide d’un scanner IRM 3-Tesla avec une bobine de tête à 32 canaux en réseau phasé et des capacités d’imagerie parallèle (Magnetom Verio, Siemens, Erlangen, Allemagne, logiciel syngo MR B17). Les sujets ont été scannés en une seule session sans changer de position dans le scanner. Les séquences suivantes ont été utilisées : Nous avons acquis une séquence 3D sagittale à haute résolution, pondérée par le T1 et préparée par magnétisation, avec un écho de gradient rapidement acquis (MP-RAGE), une matrice de 256 × 256 × 192, une taille de voxel isométrique de 1,0 mm3), un TE/TI/TR de 4,82 ms/1 100 ms/2 500 ms, un angle de bascule de 7°. Pour identifier les lésions de la substance blanche, une séquence bidimensionnelle pondérée en T2 a été réalisée (récupération par inversion de l’atténuation des fluides FLAIR, matrice de 384 × 187, 24 tranches d’une épaisseur de 5,0 mm, TE/TI/TR de 94 ms/2 500 ms/9 000 ms, angle de bascule de 150°). L’imagerie pondérée en diffusion a été réalisée avec une séquence d’imagerie écho-planaire (TE/TR 81 ms/12 700 ms). Des gradients de diffusion ont été appliqués dans 30 directions spatiales différentes. Les valeurs b étaient de 0 et 1 000 s/mm2. Les images avaient une taille de matrice de 128 × 128 mm, une épaisseur de tranche de 2 mm, la taille du voxel résultant était de 2,0 × 2,0 × 2,0 mm2.
Traitement des données IRM
Les données DTI ont été prétraitées à l’aide de la boîte à outils DTI du logiciel FSL (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, UK, version 4.1) (32). Nous avons d’abord appliqué des corrections pour les courants de Foucault et le mouvement de la tête. Le crâne a été dépouillé à l’aide de l’outil Brain Extraction Tool pour différencier le tissu cérébral et le tissu non cérébral à l’aide d’un masque binaire (seuil 0,15-0,3) et les tenseurs de diffusion ont été ajustés aux données avec DTI fit (FMRIB Image Analysis Group, Oxford, UK). Des cartes d’anisotropie fractionnelle (FA) et de diffusivité moyenne (MD) ainsi que des cartes de diffusivité axiale (AD) et radiale (RD) ont été créées.
L’analyse TBSS (tract based spatial statistics) a été réalisée à l’aide du logiciel FMRIB (version 4.1 www.fmrib.ox.ac.uk/fsl) (33). L’analyse TBSS permet la réorientation spatiale des cartes FA dans un espace standard sans effets systématiques de la transformation spatiale sur la directionnalité des fibres et sans avoir à sélectionner un noyau de lissage spatial qui peut avoir un impact sur les effets désirés (22). Le traitement des cartes de diffusivité a consisté en les étapes suivantes : Les cartes FA ont été transformées en espace MNI (Institut neurologique de Montréal). Les cartes FA normalisées de tous les sujets ont été moyennées et squelettisées avec un seuil standardisé de 0,2. Sur la base de l’étude spécifique avec des squelettes de matière, un squelette individuel pour chaque sujet a été créé.
Pour une analyse spécifique des changements dans la diffusivité des trajets de fibres individuelles, nous avons effectué une analyse de la région d’intérêt (ROI). La sélection des ROIs de JHU a été faite comme décrit précédemment (34). Sur la base de l’atlas de la matière blanche du JHU (35), nous avons défini sept régions : le corps calleux avec les sous-régions genu, truncus et splenium, le tractus corticospinal et les crus postérieures de la capsula interne des deux côtés. Le traitement des données a été effectué par le logiciel Matlab 2013a (MathWorks Inc., MA, Natrick, USA) (Figure 1).
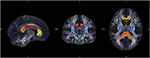
Figure 1. La figure montre le chevauchement de la carte moyenne du squelette FA de notre échantillon (bleu) et du modèle normalisé MNI-FA et les régions d’intérêt définies sur la base de l’atlas de la matière blanche JHU : genu (jaune), corps (rouge) et Splenium (orange) du Corpus callosum, CST des deux sites (vert) et écrasement postérieur de la capsula interne des deux côtés (bleu clair).
Pour l’analyse de la corrélation entre les valeurs TMS et les mesures DTI, nous avons effectué une analyse de région d’intérêt (ROI) en utilisant MarsBaR (36) pour extraire les valeurs moyennes du corps calleux et des tractus corticospinaux gauche et droit, respectivement.
Analyse statistique
L’analyse statistique a été réalisée pour les scores cliniques, les mesures TMS et les données ROI dans SPSS (version IBM SPSS statistics 20). Pour l’analyse du cerveau entier, on a utilisé la boîte à outils « Randomize » sous TBSS dans FMRIB (version 4.1 www.fmrib.ox.ac.uk/fsl). Tous les scores cliniques et les paramètres TMS ont montré une distribution normale, qui a été testée par l’utilisation du test de Kolmogorov Smirnov (P > 0.1). Les différences entre les paramètres TMS ont été comparées entre les groupes à l’aide du test t de Student. Les résultats des mesures de l’iSP ont été dichotomisés en pathologique et non pathologique, et analysés à l’aide du test du Chi2.
Pour l’analyse ROI, des comparaisons de groupe de l’AF des patients et des contrôles ont été effectuées selon les résultats de l’iSP pathologique et de l’iSP non pathologique dans une analyse de variance univariée et des tests post-hoc ultérieurs. En outre, les corrélations entre les résultats de l’iSP et les paramètres ALSFRS et FA de toutes les ROIs étudiées ont été calculées. Pour l’analyse de corrélation, la corrélation de Spearman-Rank a été utilisée et la signification a été fixée à P < 0,05. Pour l’analyse du cerveau entier, nous avons étudié les différences de groupe dans l’anisotropie fractionnelle et la diffusivité moyenne en utilisant le modèle linéaire général sur une base voxel. Les analyses du cerveau entier ont été effectuées pour tous les paramètres de diffusion. Les cartes FA, MD, RD et AD ont été comparées par une analyse de variance univariée (facteur : groupe, covariable : ALSFRS-R et UMNB). Pour éviter une surestimation de la signification, un test de comparaisons multiples a été appliqué (méthode de l’erreur familiale) et la signification a été fixée à P < 0,05.
Résultats
Résultats TMS
L’investigation TMS chez les patients atteints de SLA a révélé une latence iSP moyenne de 41,3 ± 5,4 ms/40,9 ± 5,7 ms (droite/gauche), plus longue que celle des témoins sains 39,0 ± 4,6/37,7 ± 6,3 (droite/gauche) (p = 0,006/0,012). Aucune différence n’a été trouvée pour la durée de l’iSP entre les patients atteints de SLA et les sujets témoins. Douze patients atteints de SLA (63,2 %), mais aucun des sujets témoins n’a présenté de perte de l’iSP. Le cSP était numériquement plus court chez les patients atteints de SLA que chez les sujets témoins, sans atteindre le seuil de signification. Les patients atteints de SLA présentaient un RMT moyen significativement plus faible par rapport aux témoins (les résultats TMS sont présentés en détail dans le tableau 2 et la figure 2).

Tableau 2. Résultats de la TMS chez les patients SLA et les témoins.
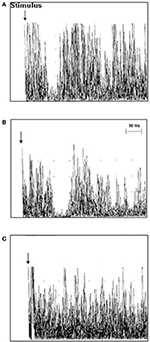
Figure 2. Réponses musculaires ipsilatérales (10 tracés EMG rectifiés et superposés) enregistrées à partir du premier muscle interosseux dorsal (FDI) chez des patients individuels atteints de SLA et des témoins. (A) La latence de l’iSP était normale chez le cas témoin 3 (37,8 ms), (B) la latence de l’iSP était prolongée chez le cas 11 du patient SLA (51 ms), et (C) le cas 18 du patient SLA présentait une perte de l’iSP.
Différences de groupe dans l’anisotropie fractionnelle et la diffusivité moyenne
Concernant les analyses des ROIs pré-spécifiés, les valeurs FA du CST étaient significativement plus faibles chez les patients SLA par rapport aux contrôles. Les valeurs FA des différentes ROIs du corps calleux (genu, splenium et corps) ne différaient pas entre les deux groupes (tableau 3). Les valeurs de l’AF et de la RD ont montré des résultats similaires. L’analyse du cerveau entier n’a pas montré de différences en FA, MD, RD et AD entre les patients atteints de SLA et les témoins à un niveau de signification corrigé par FWE.

Tableau 3. Résultats DTI chez les patients atteints de SLA et les contrôles .
Corrélation des paramètres cliniques, des paramètres TMS et des mesures DTI
Nous avons trouvé des corrélations négatives significatives des valeurs FA du CST avec les valeurs RMT des deux côtés chez les patients atteints de SLA, mais pas chez les contrôles (tableau 4). Il n’y avait pas de corrélation significative entre les valeurs FA et les paramètres iSP (tableau 4). En revanche, il y avait une corrélation significative des scores ALS-FRS-R avec les valeurs FA du CST des deux côtés (r CST-droit, ALS-FRS-R = 0,58, p = 0,009 et r CST-gauche, LS-FRS-R = 0,05, p = 0,02), mais pas avec les valeurs FA du corps calleux.
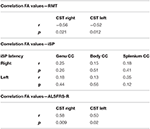
Tableau 4. Corrélations entre TMS et DTI.
Discussion
Le dysfonctionnement des motoneurones inférieurs et supérieurs est une caractéristique clinique de la SLA. Outre l’atteinte des zones motrices primaires, un dysfonctionnement précoce des callosités a également été suggéré dans la SLA (37). Les MM peuvent être un signe clinique de dysfonctionnement des voies transcallosales et peuvent être observés chez ~30% des patients atteints de SLA. D’autres preuves de l’interprétation des MM en tant que marqueurs de dysfonctionnement des callosités proviennent d’une série d’études TMS montrant un dysfonctionnement des callosités comme indiqué par une inhibition transcallosale altérée (2-4, 15) en conjonction avec la présence de MM dans la SLA et d’autres conditions comme la maladie de Parkinson (16). En outre, plusieurs études d’ITD ont montré des changements microstructuraux non seulement dans le tractus pyramidal, mais aussi dans le corps calleux dans la SLA (22, 23, 38). Il a été démontré que l’implication du corps calleux est une caractéristique relativement cohérente de la SLA, même sans implication clinique de l’UMN, et peut refléter la propagation interhémisphérique de la pathologie et une connectivité motrice structurelle altérée (23, 24).
Dans l’étude actuelle, nous nous attendions à une corrélation significative des mesures DTI et des résultats TMS reflétant l’inhibition transcallosale chez les patients SLA avec MM. Conformément à nos attentes, nous avons trouvé une inhibition transcallosale altérée dans jusqu’à 68% des cas, ce qui est en accord avec les données précédemment publiées par des cohortes indépendantes (3, 4). En revanche, les patients SLA atteints de MM dans l’échantillon actuel n’ont pas montré d’implication microstructurale du corps calleux, ce qui est en contraste avec certaines (22, 34), mais pas toutes les études précédentes (39). Une interprétation de l’absence de changements du corps calleux dans notre étude peut être que nos patients ont présenté une perturbation fonctionnelle antérieure qui a potentiellement précédé les résultats microstructuraux dans les voies transcallosales. Ainsi, les deux études précédentes qui ont mis en évidence des changements de diffusion dans le corps calleux (23, 41) comprenaient des cas fonctionnellement plus avancés (score ALSFRS-R moyen de 33,1 et 36,5, respectivement, contre 38,5 dans l’étude actuelle). Une étude récente a démontré une augmentation de la DA dans le corps calleux et une réduction de la FA dans le CST droit dans la SLA sans considérer les MM (25). L’étude de Geraldo et al. ne s’est pas concentrée sur les changements électrophysiologiques dans les voies de projection transcallosale mais l’excitabilité corticale et les propriétés de conduction du CST ont été testées par l’investigation du seuil moteur au repos (RMT) comme mesure de l’excitabilité corticale et du temps de conduction moteur central (CMCT). En gardant à l’esprit que Geraldo et ses collègues ont utilisé un petit muscle de la main différent comme muscle cible (abducteur digiti minimi contre le premier muscle interosseux dorsal dans notre étude), le RMT était légèrement inférieur dans notre étude, reflétant une plus grande excitabilité corticale dans notre cohorte présentant des MM. Les mesures CMCT ont affiché des valeurs comparables à celles de notre étude. En étendant ces résultats précédents aux patients atteints de SLA présentant des MM, nous avons pu reproduire la réduction de l’AF du CST associée aux modifications de la SMT dans la SLA, sans effets dans le corps calleux. Une autre explication du manque de signification des résultats de l’ITD dans le corps calleux dans notre échantillon pourrait être la grande hétérogénéité relative des patients, qui représente une limitation de notre étude. Une autre limite est le faible nombre de patients. Une raison majeure de cette circonstance pourrait être la rareté relative des MM, qui ne peuvent être observés que chez environ 30% des patients atteints de SLA. En raison de la limitation des ressources humaines disponibles, la période d’étude n’a pas pu être prolongée.
En conclusion, il s’agit de la première étude portant sur une cohorte de patients atteints de SLA qui présentaient tous des MM. La présente étude reproduit et étend les résultats précédents sur l’intégrité réduite des tractus fibreux chez les patients atteints de SLA avec MMs, mais n’a pas réussi à montrer des changements microstructuraux accompagnant les mouvements en miroir et l’inhibition transcallosale perturbée. L’affection du tractus pyramidal semble être une condition préalable importante au développement des MM. Cette étude apporte des preuves supplémentaires pour la compréhension de l’altération de la connectivité chez les patients atteints de SLA. Par conséquent, d’autres études dans des cohortes plus grandes et plus homogènes sont nécessaires.
Data Availability Statement
Les données désidentifiées des participants seront partagées, ainsi que le protocole de l’étude et les analyses statistiques, sur demande raisonnable.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le conseil d’examen institutionnel de la faculté de médecine de l’Université de Rostock (A-2011-0026, A267 2012-0083). Les patients/participants ont fourni leur consentement écrit pour participer à cette étude.
Contributions des auteurs
MW : conception, design, rédaction du manuscrit, acquisition des données et approbation finale du manuscrit. NW, AG, et EK : acquisition des données, révision du manuscrit, et approbation finale du manuscrit. ST : concept, conception, analyse et interprétation des données, rédaction du manuscrit, révision du manuscrit et approbation finale du manuscrit.
Conflit d’intérêt
ST a effectué les travaux listés ci-dessous (tous en Allemagne) : MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Cercle de qualité pour les médecins à Kühlungsborn, conférence : « Démence et diabète-rapport actuel »
14.11.2018-MSD Expert-forum : NAB Alzheimer à Munich, participant en tant que consultant
13.08.2019-Event « Diabète et démence » à Rostock, Exposé : « Démence et diabète – rapport actuel » ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board à Francfort-sur-le-Main, participation en tant que consultant
27.09.2019-ROCHE Symposium au congrès DGN à Stuttgart, Exposé : « Amyloïde comme cible pour le diagnostic et le traitement dans la maladie d’Alzheimer. »
Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited : critères révisés pour le diagnostic de la sclérose latérale amyotrophique. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi : 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Mirror movements and ipsilateral motor evoked potentials in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi : 10.1080/14660820410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi : 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mirror movements in amyotrophic lateral sclerosis. Sclérose latérale amyotrophique. (2011) 6:393-7. doi : 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Différences entre les « mouvements miroir congénitaux » et les « mouvements associés » chez les enfants normaux : une étude de cas neurophysiologique. Neurosci Lett. (1998) 256:69-72. doi : 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. Une étude neurophysiologique des mouvements de miroir chez les adultes et les enfants. Ann Neurol. (1999) 45:583-94. doi : 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mirror movements in healthy humans across the lifespan : effects of development and ageing. Dev Med Child Neurol. (2010) 52:1106-12. doi : 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections : a developmental study with transcranial magnetic stimulation. Ann Neurol. (1997) 42:705-71. doi : 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurophysiologie du contrôle moteur unimanuel et des mouvements en miroir. Clin Neurophysiol. (2008) 119:744-62. doi : 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Troubles de la coordination chez les patients atteints de la maladie de Parkinson : une étude des mouvements rythmiques cadencés de l’avant-bras. Exp Brain Res. (2000) 134:174-86. doi : 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Mouvements miroirs dans le parkinsonisme : évaluation d’un nouveau signe clinique. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi : 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Individual patterns of functional reorganization in the human cerebral cortex after capsular infarction. Ann Neurol. (1993) 33:181-9. doi : 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Réorganisation de la sortie motrice dans l’hémisphère non affecté après un accident vasculaire cérébral. Cerveau. (1997) 120:1579-86. doi : 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical substrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi : 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impaired interhemispheric inhibition in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2007) 8:112-8. doi : 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemispheric and ipsilateral connections in Parkinson’s disease : relation to mirror movements. Mov Disord. (2007) 22:813-21. doi : 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistance de mouvements miroir congénitaux après un accident vasculaire cérébral hémiplégique. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group. anatomical MRI and DTI in the diagnosis of Alzheimer’s disease : a European multicenter study. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi : 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). Vers un biomarqueur de neuroimagerie pour la sclérose latérale amyotrophique. Lancet Neurol. (2011) 10:400-3. doi : 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi : 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imagerie de la patho-anatomie de la sclérose latérale amyotrophique in vivo : ciblage d’un marqueur biologique basé sur la propagation. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi : 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Brain. (2004) 127:340-50. doi : 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. L’implication du corps calleux est une caractéristique constante de la sclérose latérale amyotrophique. Neurologie. (2010) 75:1645-52. doi : 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Connectome moteur structurel altéré dans la sclérose latérale amyotrophique. PLoS ONE. (2011) 6:e24239. doi : 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis : the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiologie. (2018) 60:505-15. doi : 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusion tensor MRI assesses corticospinal tract damage in ALS. Neurology. (1999) 53:1051-8. doi : 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. L’évaluation et l’analyse de la main : l’inventaire d’Édimbourg. Neuropsychologia. (1971) 9:97-113. doi : 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Mouvements miroirs après une hémiparésie infantile. Neurology. (1978) 28:1152-7. doi : 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R : a revised ALS functional rating scale that incorporates assessments of respiratory function. Groupe d’étude BDNF ALS (Phase III). J Neurol Sci. (1999) 169:13-21. doi : 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Evidence of widespread cerebral microglial activation in amyotrophic lateral sclerosis : an (R)-PK11195 positron emission tomography study. Neurobiol Dis. (2004) 15:601-9. doi : 10.1016/j.nbd.2003.12.012@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA : a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi : 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. (2004) 23:208-19. doi : 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics : voxelwise analysis of multi-subject diffusion data. Neuroimage. (2006) 31:1487-505. doi : 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum : association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi : 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces : analyses of white matter anatomy and tract-specific quantification. NeuroImage. (2008) 39:336-47. doi : 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Analyse de la région d’intérêt à l’aide de la boîte à outils SPM (résumé). Présenté à la 8e conférence internationale sur la cartographie fonctionnelle du cerveau humain, 2-6 juin 2002, Sendai, Japon. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis : a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi : 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Le dysfonctionnement callosal dans la sleose latérale amyotrophique est en corrélation avec l’imagerie du tenseur de diffusion du système moteur central. Neuromusc Disord. (2008) 18:398-407. doi : 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Microstructural white matter changes underlying cognitive and behavioural impairment in ALS-an in vivo study using DTI. PLoS ONE. (2014) 9:e114543. doi : 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar
.