- Introduction
- Patienten und Methoden
- Probanden
- Transkranielle Magnetstimulation
- MRT-Akquisition
- MRI-Datenverarbeitung
- Statistische Analyse
- Ergebnisse
- TMS-Ergebnisse
- Gruppenunterschiede in der fraktionellen Anisotropie und der mittleren Diffusivität
- Korrelation von klinischen Parametern, TMS-Parametern und DTI-Messungen
- Diskussion
- Datenverfügbarkeitserklärung
- Ethikerklärung
- Beiträge der Autoren
- Interessenkonflikt
Introduction
Amyotrophe Lateralsklerose (ALS) ist eine fortschreitende neurodegenerative Erkrankung, die hauptsächlich durch ein motorisches Syndrom mit variabler Ausprägung der Dysfunktion der unteren (LMN) und oberen (UMN) Motoneuronen gekennzeichnet ist. Nach den El-Escorial-Kriterien (1) müssen UMN und LMN in einer oder mehreren Körperregionen betroffen sein, um eine definitive ALS-Diagnose zu stellen. UMN-Anzeichen können Spastizität, verstärkte oder erhaltene Sehnenreflexe und Streckreaktionen der Fußsohle sein. Spiegelbewegungen (MM) wurden wiederholt bei der ALS beobachtet (2-4), gehören aber noch nicht zu den Diagnosekriterien. MMs sind unwillkürliche Bewegungen kontralateral zu einer beabsichtigten Fingerbewegung. MMs können bei normalen Kindern bis zum Alter von 10 Jahren beobachtet werden, aber ihre Prävalenz und Intensität nimmt nach diesem Alter ab (5-7), was wahrscheinlich die Reifung des Corpus callosum widerspiegelt (8). Persistierende oder neu auftretende MMs im Erwachsenenalter können verschiedene Ursachen haben. Persistierende kongenitale MMs wurden bei verschiedenen Erkrankungen beschrieben, die vom Fehlen anderer neurologischer Anomalien bis hin zu schwerer kongenitaler Hemiparese bei zerebraler Lähmung reichen (9). Auch bei einer Reihe anderer erworbener Erkrankungen wie der Parkinson-Krankheit (10, 11) oder einem Schlaganfall (12, 13) wurde über MMs berichtet. Es wurden zwei Haupthypothesen für die Entstehung von MM diskutiert: eine abnorme Entwicklung des primären motorischen Systems, an der der ipsilaterale kortikospinale Trakt beteiligt ist, und das Fehlen kontralateraler Hemmungsmechanismen des motorischen Kortex, vor allem durch den Corpus callosum (9, 14). Es wird angenommen, dass die pathophysiologische Grundlage der MM bei all diesen erworbenen klinischen Zuständen das Ergebnis einer vorherrschenden Veränderung der kallosalen Projektionsbahnen ist. Dennoch scheint eine zusätzliche oder vorbestehende kortikale oder pyramidale Fehlfunktion für die Entwicklung von MMs erforderlich zu sein (2). Darüber hinaus wurde festgestellt, dass MMs bei ALS, Parkinson und Schlaganfall mit einer verminderten transkallosalen Inhibition (TI) einhergehen, die mittels transkranieller Magnetstimulation (TMS) gemessen wurde (3, 4, 15-17). Unabhängig vom genauen pathophysiologischen Mechanismus der MMs ist der wichtigste klinische Aspekt, dass sie eine ZNS-Beteiligung durch die zugrunde liegende pathologische Erkrankung widerspiegeln. Diffusions-MRT-Techniken wie die Diffusions-Tensor-Bildgebung (DTI) wurden zur Untersuchung der Integrität neuronaler Bahnen in vivo im menschlichen Gehirn entwickelt. In DTI-Studien wurden Veränderungen der Integrität der Faserbahnen bei neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit und ALS (18-21), einschließlich der Beteiligung der Hornhaut, festgestellt (22-24). In einer Beobachtungsstudie wurde eine konsistente Verringerung der fraktionierten Anisotropie im Corpus callosum von ALS-Patienten festgestellt, die sich rostral und bilateral bis in die Region der primären motorischen Kortexe erstreckt (23). Eine neuere Studie, in der DTI und TMS zur Charakterisierung der Neurodegeneration bei ALS eingesetzt wurden, kam zu dem Schluss, dass sie als diagnostische Biomarker für UMN-Dysfunktion eine ergänzende Rolle spielen (25). Ellis und Kollegen fanden einen signifikanten Anstieg der mittleren Diffusivität und eine Verringerung der fraktionierten Anisotropie entlang des kortikospinalen Trakts bei ALS-Patienten, die mit dem Schweregrad der Erkrankung und der Beteiligung der UMN korrelierten (26). Keine dieser Studien konzentrierte sich auf MMs oder funktionelle Konnektivität bei ALS.
Daher untersuchten wir Assoziationen von funktionellen TMS-Messungen mit Diffusionsmarkern der strukturellen Integrität des Corpus callosum und des zerebrospinalen Trakts in einer prospektiven Stichprobe von ALS-Patienten, die MMs aufwiesen, um die pathophysiologischen Konzepte von MMs bei ALS zu klären. Wir stellten die Hypothese auf, dass ALS-Patienten mit MMs eine beeinträchtigte funktionelle Integrität des Corpus callosum aufweisen würden, die mit einer Abnahme der strukturellen Integritätsmarker einhergeht. Diese Befunde würden die Rolle der kallosalen Dysfunktion und der strukturellen Beeinträchtigung für MMs bei ALS unterstützen.
Patienten und Methoden
Probanden
Neunzehn Patienten mit ALS und 20 gesunde Kontrollpersonen unterzogen sich einer klinischen Beurteilung und MRT-Untersuchungen, einschließlich DTI. Detaillierte demografische Daten und klinische Merkmale der gesamten Studienkohorte sind in Tabelle 1 aufgeführt. Alle Probanden waren Rechtshänder, wie anhand des Edinburgh Handness Inventory (27) festgestellt wurde. Zum Zeitpunkt der Untersuchung wiesen 4 Patienten eine definitive ALS, 8 eine wahrscheinliche ALS und 4 eine mögliche ALS gemäß den überarbeiteten El-Escorial-Kriterien (1) auf. Drei Patienten wiesen eine Variante der unteren Motoneuronen auf. Die durchschnittliche Krankheitsdauer betrug 34,8 ± 34,8 Monate. Die klinische Beurteilung bestand aus einer neurologischen Untersuchung unter besonderer Berücksichtigung der Händigkeit; die MMs wurden durch sequenzielles Fingertippen einer Hand ohne optische Kontrolle und Beobachtung der MMs nach dem Verfahren von Woods und Teuber (28) sowie der Auswertung der revidierten ALS functional rating scale (-R) (29) bewertet. Um die Beteiligung der oberen motorischen Neuronen (UMN) zu erfassen, wurde außerdem eine UMN-Belastung“ (UMNB) berechnet, indem die Anzahl der pathologischen UMN-Zeichen bei der Untersuchung summiert wurde (maximale Punktzahl 16) (30). Für das kognitive Screening verwendeten wir das „Montreal Cognitive Assessment“ (MOCA) (31). Der MOCA-Score lag bei den ALS-Patienten zwischen 18 und 29 mit einem Durchschnittswert von 24,5 ± 4 und bei den Kontrollen zwischen 27 und 29 mit einem Durchschnittswert von 27,6 ± 0,7 (P = 0,006). Die Kontrollpersonen hatten keine kognitiven Beschwerden und lagen innerhalb von 1,5 Standardabweichungen des alters- und bildungsbereinigten MOCA-Normwertes.
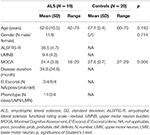
Tabelle 1. Demografische und klinische Daten aller Studienteilnehmer.
Patienten und Kontrollpersonen wurden nur in die Studie aufgenommen, wenn eine schriftliche Zustimmung vorlag. Die Studie wurde vom Institutional Review Board der Medizinischen Fakultät der Universität Rostock genehmigt (A-2011-0026, A 2012-0083).
Transkranielle Magnetstimulation
Wir führten TMS bei allen Patienten und bei 10 von 20 gesunden Kontrollpersonen durch. Die zentrale motorische Leitungszeit (CMCT), die Amplituden der motorisch evozierten Potenziale (MEP) und die kontralaterale stille Periode (cSP) wurden bei allen ALS-Patienten und Kontrollpersonen bestimmt. Die MEP wurden vom ersten dorsalen Interosseus-Muskel (FDI) und vom vorderen Tibiamuskel (TA) mit Hilfe einer kreisförmigen Standardspule (Außendurchmesser 9 cm) aufgezeichnet, die an einen Magstim 200-Stimulator (Magstim Co., Whitland, Dyfeld, UK) angeschlossen war. Zur Datenerfassung wurde ein handelsübliches MEP-System verwendet (Brain Quick System Plus, Inomed, Erlangen, Deutschland). Die Untersuchung der ipsilateralen stillen Periode (iSP) wurde mit einer fokalen Spule (Durchmesser der externen Schleife 7 cm) durchgeführt. Die Spule wurde so ausgerichtet, dass ein posterior-anterior gerichteter Stromfluss zum Handbereich des motorischen Kortex induziert wurde; der Punkt der optimalen Erregbarkeit (POE) des FDI-Muskels wurde über dem kontralateralen motorischen Kortex bestimmt; TMS wurde am POE mit dem 1,5-fachen der motorischen Ruheschwelle (RMT) appliziert, während die Probanden eine maximale tonische Aktivierung des ipsilateralen FDI-Muskels durchführten und den kontralateralen FDI-Muskel entspannt hielten, wie zuvor ausführlich veröffentlicht (3). Für die Bestimmung der iSP-Latenz und -Dauer wurden 10 Versuche für jede Hemisphäre verwendet. Nach Offline-Gleichrichtung und Mittelwertbildung der EMG-Signale wurden die iSP-Parameter analysiert.
MRT-Akquisition
MRT-Akquisitionen des Gehirns wurden mit einem 3-Tesla-MRT-Scanner mit einer 32-Kanal-Phased-Array-Kopfspule und parallelen Bildgebungsmöglichkeiten durchgeführt (Magnetom Verio, Siemens, Erlangen, Deutschland, Software syngo MR B17). Die Probanden wurden in einer einzigen Sitzung gescannt, ohne ihre Position im Scanner zu verändern. Es wurden die folgenden Sequenzen verwendet: Wir akquirierten eine sagittale hochauflösende T1-gewichtete Magnetisierungs-präparierte schnell akquirierte Gradientenecho (MP-RAGE) 3D-Sequenz, Matrixgröße 256 × 256 × 192, isometrische Voxelgröße 1,0 mm3), TE/TI/TR von 4,82 ms/1.100 ms/2.500 ms, Flipwinkel 7°. Zur Identifizierung von Läsionen der weißen Substanz wurde eine zweidimensionale T2-gewichtete Sequenz durchgeführt (Fluid Attenuation Inversion Recovery FLAIR, Matrixgröße 384 × 187, 24 Schichten mit einer Schichtdicke von 5,0 mm, TE/TI/TR von 94 ms/2.500 ms/9.000 ms, Flip-Winkel 150°). Die diffusionsgewichtete Bildgebung wurde mit einer echoplanaren Bildgebungssequenz (TE/TR 81 ms/12.700 ms) durchgeführt. Es wurden Diffusionsgradienten in 30 verschiedenen Raumrichtungen angelegt. Die b-Werte waren 0 und 1.000 s/mm2. Die Bilder hatten eine Matrixgröße von 128 × 128 mm, eine Schichtdicke von 2 mm, die resultierende Voxelgröße betrug 2,0 × 2,0 × 2,0 mm2.
MRI-Datenverarbeitung
DTI-Daten wurden mit der DTI-Toolbox der FSL-Software (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, UK, Version 4.1) (32) vorverarbeitet. Zunächst wurden Korrekturen für Wirbelströme und Kopfbewegungen vorgenommen. Der Schädel wurde mit dem Brain Extraction Tool zur Unterscheidung von Hirngewebe und Nicht-Hirngewebe mit einer binären Maske (Schwellenwert 0,15-0,3) entfernt, und die Diffusionstensoren wurden mit DTI-Fit (FMRIB Image Analysis Group, Oxford, UK) an die Daten angepasst. Es wurden Karten der fraktionellen Anisotropie (FA) und der mittleren Diffusivität (MD) sowie Karten der axialen Diffusivität (AD) und der radialen Diffusivität (RD) erstellt.
TBSS-Analysen (traktbasierte räumliche Statistiken) wurden mit der FMRIB-Software (Version 4.1 www.fmrib.ox.ac.uk/fsl) (33) durchgeführt. TBSS ermöglicht die räumliche Neuausrichtung von FA-Karten in einen Standardraum ohne systematische Auswirkungen der räumlichen Transformation auf die Richtung der Faserbahnen und ohne die Notwendigkeit, einen räumlichen Glättungskern zu wählen, der sich auf die gewünschten Effekte auswirken kann (22). Die Verarbeitung der Diffusivitätskarten umfasste die folgenden Schritte: Die FA-Karten wurden in den MNI-Raum (Montreal Neurologic Institute) transformiert. Die normalisierten FA-Karten aller Probanden wurden gemittelt und mit einem standardisierten Schwellenwert von 0,2 skelettiert. Auf der Grundlage der studienspezifischen Materieskelette wurde für jeden Probanden ein individuelles Skelett erstellt.
Für die spezifische Analyse von Veränderungen der Diffusivität einzelner Faserbahnen wurde eine Region of Interest (ROI) Analyse durchgeführt. Die Auswahl der ROIs aus der JHU erfolgte wie zuvor beschrieben (34). Auf der Grundlage des JHU-Atlas der weißen Substanz (35) definierten wir sieben Regionen: Corpus callosum mit den Unterregionen genu, truncus und splenium, kortikospinaler Trakt und Crus posterior der inneren Kapsel auf beiden Seiten. Die Datenverarbeitung erfolgte mit der Software Matlab 2013a (MathWorks Inc., MA, Natrick, USA) (Abbildung 1).
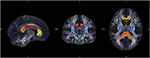
Abbildung 1. Die Abbildung zeigt die Überlappung der mittleren FA-Skelettkarte unserer Stichprobe (blau) mit der normalisierten MNI-FA-Schablone und den definierten Regionen von Interesse auf der Grundlage des JHU-Atlas der weißen Substanz: Genu (gelb), Body (rot) und Splenium (orange) des Corpus callosum, CST beide Seiten (grün) und Crus posterior der inneren Kapsel auf beiden Seiten (hellblau).
Für die Analyse der Korrelation zwischen den TMS-Werten und den DTI-Messungen führten wir eine Region-of-Interest-Analyse (ROI) mit MarsBaR (36) durch, um die Mittelwerte des Corpus callosum und des linken bzw. rechten kortikospinalen Trakts zu extrahieren.
Statistische Analyse
Die statistische Analyse wurde für die klinischen Scores, die TMS-Messungen und die ROI-Daten in SPSS (Version IBM SPSS Statistics 20) durchgeführt. Für die Analyse des gesamten Gehirns wurde die Toolbox „Randomize“ unter TBSS in FMRIB (Version 4.1 www.fmrib.ox.ac.uk/fsl) verwendet. Alle klinischen Scores und TMS-Parameter wiesen eine Normalverteilung auf, die mit dem Kolmogorov-Smirnov-Test getestet wurde (P > 0,1). Die Unterschiede in den TMS-Parametern wurden zwischen den Gruppen mit dem Student’s t-Test verglichen. Die Ergebnisse der iSP-Messungen wurden dichotomisiert (pathologisch vs. nicht-pathologisch) und mit dem Chi2-Test analysiert.
Für die ROI-Analyse wurden Gruppenvergleiche der FA von Patienten und Kontrollen entsprechend den Ergebnissen der pathologischen iSP und nicht-pathologischen iSP in einer univariaten Varianzanalyse und anschließenden Post-hoc-Tests durchgeführt. Außerdem wurden Korrelationen zwischen iSP-Befunden und ALSFRS sowie FA-Parametern aller untersuchten ROIs berechnet. Für die Korrelationsanalyse wurde die Spearman-Rank-Korrelation verwendet, und die Signifikanz wurde auf P < 0,05 festgelegt. Für die Ganzhirnanalyse untersuchten wir Gruppenunterschiede in der fraktionierten Anisotropie und der mittleren Diffusivität unter Verwendung des allgemeinen linearen Modells auf Voxelbasis. Ganzhirnanalysen wurden für alle Diffusionsparameter durchgeführt. FA-, MD-, RD- und AD-Karten wurden mittels univariater Varianzanalyse verglichen (Faktor: Gruppe, Kovariate: ALSFRS-R und UMNB). Um eine Überschätzung der Signifikanz zu vermeiden, wurde ein Test auf multiple Vergleiche angewandt (familienweise Fehlermethode), und die Signifikanz wurde auf P < 0,05 festgelegt.
Ergebnisse
TMS-Ergebnisse
TMS-Untersuchungen bei ALS-Patienten ergaben eine mittlere iSP-Latenz von 41,3 ± 5,4 ms/40,9 ± 5,7 ms (rechts/links), die länger war als die der gesunden Kontrollen 39,0 ± 4,6/37,7 ± 6,3 (rechts/links) (p = 0,006/0,012). Bei der iSP-Dauer wurden keine Unterschiede zwischen den ALS-Patienten und den Kontrollpersonen festgestellt. Zwölf ALS-Patienten (63,2 %), aber keiner der Kontrollpersonen, wiesen einen Verlust von iSP auf. cSP war bei ALS-Patienten numerisch kürzer als bei Kontrollpersonen, ohne jedoch Signifikanz zu erreichen. ALS-Patienten wiesen im Vergleich zu den Kontrollpersonen eine signifikant niedrigere mittlere RMT auf (die TMS-Ergebnisse sind im Einzelnen in Tabelle 2 und Abbildung 2 dargestellt).

Tabelle 2. TMS-Befunde bei ALS-Patienten und Kontrollen.
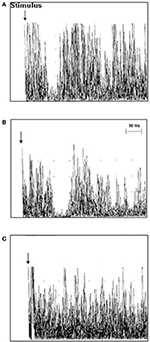
Abbildung 2. Ipsilaterale Muskelreaktionen (10 gleichgerichtete und überlagerte EMG-Kurven), aufgezeichnet vom ersten dorsalen interossären Muskel (FDI) bei einzelnen ALS-Patienten und Kontrollen. (A) Die Latenz der iSP war bei Kontrollfall 3 normal (37,8 ms), (B) die iSP-Latenz war bei ALS-Patient Fall 11 verlängert (51 ms), und (C) ALS-Patient Fall 18 zeigte einen Verlust der iSP.
Gruppenunterschiede in der fraktionellen Anisotropie und der mittleren Diffusivität
Bei den Analysen der vordefinierten ROIs waren die FA-Werte der CST bei ALS-Patienten im Vergleich zu den Kontrollen signifikant niedriger. Die FA-Werte der verschiedenen ROIs des Corpus callosum (Genu, Splenium und Body) unterschieden sich nicht zwischen beiden Gruppen (Tabelle 3). Die AD- und RD-Werte zeigten ähnliche Ergebnisse. Die Analyse des gesamten Gehirns zeigte keine Unterschiede in FA, MD, RD und AD zwischen ALS-Patienten und Kontrollen auf einem FWE-korrigierten Signifikanzniveau.

Tabelle 3. DTI-Befunde bei ALS-Patienten und Kontrollen.
Korrelation von klinischen Parametern, TMS-Parametern und DTI-Messungen
Wir fanden signifikante negative Korrelationen von FA-Werten der CST mit RMT-Werten auf beiden Seiten bei ALS-Patienten, aber nicht bei Kontrollen (Tabelle 4). Es gab keine signifikante Korrelation zwischen FA-Werten und iSP-Parametern (Tabelle 4). Im Gegensatz dazu gab es eine signifikante Korrelation der ALS-FRS-R-Scores mit den FA-Werten des CST auf beiden Seiten (r CST-rechts, ALS-FRS-R = 0,58, p = 0,009 und r CST-links, LS-FRS-R = 0,05, p = 0,02), aber nicht mit den FA-Werten des Corpus callosum.
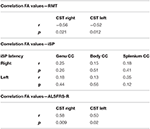
Tabelle 4. Korrelationen zwischen TMS und DTI.
Diskussion
Die Dysfunktion der unteren und oberen Motoneuronen ist ein klinisches Merkmal der ALS. Neben der Beteiligung der primären motorischen Areale wurde auch eine frühe Dysfunktion der Kallosa bei ALS vermutet (37). MMs können ein klinisches Zeichen für dysfunktionale transkallosale Bahnen sein und werden bei ~30 % der ALS-Patienten beobachtet. Weitere Belege für die Interpretation von MMs als Marker einer kallosalen Dysfunktion stammen aus einer Reihe von TMS-Studien, die eine kallosale Dysfunktion als Hinweis auf eine gestörte transkallosale Inhibition (2-4, 15) in Verbindung mit dem Vorhandensein von MMs bei ALS und anderen Erkrankungen wie der Parkinson-Krankheit zeigen (16). Darüber hinaus haben mehrere DTI-Studien mikrostrukturelle Veränderungen nicht nur im Pyramidenbahnsystem, sondern auch im Corpus callosum bei ALS gezeigt (22, 23, 38). Die Beteiligung des Corpus callosum ist nachweislich ein relativ konsistentes Merkmal der ALS, auch ohne klinische UMN-Beteiligung, und kann die interhemisphärische Ausbreitung der Pathologie und eine beeinträchtigte strukturelle motorische Konnektivität widerspiegeln (23, 24).
In der aktuellen Studie erwarteten wir eine signifikante Korrelation von DTI-Messungen und TMS-Befunden, die die transkallosale Hemmung bei ALS-Patienten mit MMs widerspiegeln. In Übereinstimmung mit unserer Erwartung fanden wir in bis zu 68 % der Fälle eine beeinträchtigte transkallosale Hemmung, was im Einklang mit zuvor veröffentlichten Daten aus unabhängigen Kohorten steht (3, 4). Im Gegensatz dazu zeigten die ALS-Patienten mit MM in der aktuellen Stichprobe jedoch keine mikrostrukturelle Beteiligung des Corpus callosum, was im Gegensatz zu einigen (22, 34), aber nicht allen früheren Studien steht (39). Eine Interpretation der fehlenden Veränderungen des Corpus callosum in unserer Studie könnte darin bestehen, dass unsere Patienten eine frühere Funktionsstörung aufwiesen, die möglicherweise den mikrostrukturellen Befunden in den transkallosalen Bahnen vorausging. So wurden in den beiden früheren Studien, in denen Diffusionsveränderungen des Corpus callosum festgestellt wurden (23, 41), funktionell fortgeschrittenere Fälle eingeschlossen (mittlerer ALSFRS-R-Score 33,1 bzw. 36,5 im Vergleich zu 38,5 in der aktuellen Studie). In einer neueren Studie wurde eine erhöhte AD im Corpus callosum und eine Verringerung der FA im rechten CST bei ALS nachgewiesen, ohne dass MMs berücksichtigt wurden (25). Die Studie von Geraldo et al. konzentrierte sich nicht auf elektrophysiologische Veränderungen in den transkallosal projizierenden Bahnen, sondern die kortikale Erregbarkeit und die CST-Leitungseigenschaften wurden durch die Untersuchung der motorischen Ruheschwelle (resting motor threshold, RMT) als Maß für die kortikale Erregbarkeit und der zentralen motorischen Leitungszeit (CMCT) getestet. Unter Berücksichtigung der Tatsache, dass Geraldo und Mitarbeiter einen anderen kleinen Handmuskel als Zielmuskel verwendeten (den Abductor digiti minimi im Vergleich zum ersten dorsalen Interosseus-Muskel in unserer Studie), war die RMT in unserer Studie etwas niedriger, was eine größere kortikale Erregbarkeit in unserer Kohorte mit MMs widerspiegelt. Die CMCT-Messungen zeigten vergleichbare Werte wie in unserer Studie. Indem wir diese früheren Ergebnisse auf ALS-Patienten mit MMs ausdehnten, konnten wir die FA-Reduktion der CST in Verbindung mit TMS-Veränderungen bei ALS replizieren, ohne Auswirkungen auf das Corpus Callosum. Eine andere Erklärung für die fehlende Signifikanz der DTI-Befunde im Corpus callosum in unserer Stichprobe könnte die relativ große Heterogenität der Patienten sein, was eine Einschränkung unserer Studie darstellt. Eine weitere Einschränkung ist die geringe Anzahl der Patienten. Ein Hauptgrund dafür könnte die relative Seltenheit von MMs sein, die nur bei etwa 30 % der ALS-Patienten beobachtet werden konnten. Aufgrund der begrenzten personellen Ressourcen konnte der Studienzeitraum nicht verlängert werden.
Zusammenfassend lässt sich sagen, dass dies die erste Studie ist, in der eine Kohorte von ALS-Patienten untersucht wurde, die alle MMs aufwiesen. Die vorliegende Studie repliziert und erweitert frühere Befunde zur reduzierten Integrität der Faserbahnen bei ALS-Patienten mit MMs, konnte aber keine mikrostrukturellen Veränderungen zeigen, die mit Spiegelbewegungen und gestörter transkallosaler Hemmung einhergehen. Die Beeinträchtigung der Pyramidenbahn scheint eine wichtige Voraussetzung für die Entwicklung von MM zu sein. Diese Studie liefert weitere Belege für das Verständnis der gestörten Konnektivität bei ALS-Patienten. Daher sind weitere Studien in größeren und homogeneren Kohorten erforderlich.
Datenverfügbarkeitserklärung
Deidentifizierte Teilnehmerdaten sowie das Studienprotokoll und statistische Analysen werden auf begründete Anfragen hin weitergegeben.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden vom Institutional Review Board der Medizinischen Fakultät der Universität Rostock geprüft und genehmigt (A-2011-0026, A267 2012-0083). Die Patienten/Teilnehmer gaben ihr schriftliches Einverständnis zur Teilnahme an dieser Studie.
Beiträge der Autoren
MW: Konzeption, Design, Entwurf des Manuskripts, Erfassung der Daten und endgültige Genehmigung des Manuskripts. NW, AG und EK: Erfassung von Daten, Überarbeitung des Manuskripts und endgültige Genehmigung des Manuskripts. ST: Konzept, Design, Analyse und Interpretation der Daten, Entwurf des Manuskripts, Überarbeitung des Manuskripts und endgültige Genehmigung des Manuskripts.
Interessenkonflikt
ST hat die unten aufgeführten Arbeiten durchgeführt (alle in Deutschland): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Qualitätszirkel für Ärzte in Kühlungsborn, Vortrag: „Demenz und Diabetes – aktueller Bericht“
14.11.2018-MSD Expertenforum: NAB Alzheimer in München, Teilnahme als Referent
13.08.2019-Veranstaltung „Diabetes und Demenz“ in Rostock, Vortrag: „Demenz und Diabetes-aktueller Bericht „ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. Nationaler Beirat in Frankfurt am Main, Teilnahme als Berater
27.09.2019-ROCHE-Symposium auf dem DGN-Kongress in Stuttgart, Vortrag: „Amyloid als Ziel für Diagnose und Therapie bei der Alzheimer-Krankheit.“
Die übrigen Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited: überarbeitete Kriterien für die Diagnose der amyotrophen Lateralsklerose. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Mirror movements and ipsilateral motor evoked potentials in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/14660820410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mirror movements in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Unterschiede zwischen „kongenitalen Spiegelbewegungen“ und „assoziierten Bewegungen“ bei normalen Kindern: eine neurophysiologische Fallstudie. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. Eine neurophysiologische Studie über Spiegelbewegungen bei Erwachsenen und Kindern. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mirror movements in healthy humans across the lifespan: effects of development and ageing. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurophysiologie der unimanuellen motorischen Kontrolle und der Spiegelbewegungen. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Koordinationsstörungen bei Patienten mit Morbus Parkinson: eine Studie über getaktete rhythmische Unterarmbewegungen. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Spiegelbewegungen bei Parkinsonismus: Bewertung eines neuen klinischen Zeichens. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Individuelle Muster der funktionellen Reorganisation in der menschlichen Großhirnrinde nach einem Kapselinfarkt. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganisation der motorischen Leistung in der nicht betroffenen Hemisphäre nach Schlaganfall. Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical substrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impaired interhemispheric inhibition in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemisphärische und ipsilaterale Verbindungen bei der Parkinson-Krankheit: Beziehung zu Spiegelbewegungen. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistenz angeborener Spiegelbewegungen nach hemiplegischem Schlaganfall. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group. anatomical MRI and DTI in the diagnosis of Alzheimer’s disease: a European multicenter study. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). Auf dem Weg zu einem Neuroimaging-Biomarker für amyotrophe Lateralsklerose. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Die Beteiligung des Corpus callosum ist ein durchgängiges Merkmal der amyotrophen Lateralsklerose. Neurology. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Impaired structural motor connectome in amyotrophic lateral sclerosis. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiology. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusion tensor MRI assesses corticospinal tract damage in ALS. Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. Die Bewertung und Analyse der Händigkeit: das Edinburgh-Inventar. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Spiegelbewegungen nach Hemiparese im Kindesalter. Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. BDNF ALS Studiengruppe (Phase III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Evidence of widespread cerebral microglial activation in amyotrophic lateral sclerosis: an (R)-PK11195 positron emission tomography study. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum: association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces: analyses of white matter anatomy and tract-specific quantification. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Region of interest analysis using SPM toolbox (abstract). Präsentiert auf der 8. internationalen Konferenz zur funktionellen Kartierung des menschlichen Gehirns, 2. bis 6. Juni 2002, Sendai, Japan. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Callosal dysfunction in amyotrophic lateral sleosis correlates with diffusion tensor imaging of the central motor system. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Microstructural white matter changes underlying cognitive and behavioural impairment in ALS-an in vivo study using DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar