- Introducere
- Pacienți și metode
- Subiecți
- Stimulare magnetică transcraniană
- Achiziții RMN
- Prelucrarea datelor IRM
- Analiză statistică
- Rezultate
- Rezultatele TMS
- Diferențe de grup în ceea ce privește anizotropia fracțională și difuzivitatea medie
- Corelația dintre parametrii clinici, parametrii TMS și măsurile DTI
- Discuție
- Declarație privind disponibilitatea datelor
- Declarație etică
- Contribuții ale autorilor
- Conflict de interese
Introducere
Scleroza laterală amiotrofică (SLA) este o boală neurodegenerativă progresivă caracterizată în principal de un sindrom motor cu expresie variabilă a disfuncției neuronilor motori inferiori (LMN) și superiori (UMN). Criteriile El Escorial (1) necesită implicarea UMN și LMN în una sau mai multe regiuni ale corpului pentru a pune diagnosticul de SLA definitivă. Semnele UMN pot fi spasticitatea, reflexele tendinoase îmbunătățite sau conservate și răspunsul extensor plantar. Mișcările în oglindă (MMs) au fost raportate în mod repetat în SLA (2-4), dar încă nu fac parte din criteriile de diagnostic. MMs sunt mișcări involuntare contralaterale la o mișcare intenționată a degetelor. MM-urile pot fi observate la copiii normali până la vârsta de 10 ani, dar prevalența și intensitatea lor scade după această vârstă (5-7), reflectând cel mai probabil maturizarea corpului calos (8). Persistența sau manifestarea nouă a MM-urilor la adulți poate apărea dintr-o varietate de etiologii. MM congenitale persistente au fost descrise în diferite afecțiuni, variind de la absența altor anomalii neurologice până la hemipareza congenitală severă în paralizia cerebrală (9). MM-urile au fost, de asemenea, raportate într-o varietate de alte afecțiuni dobândite, cum ar fi boala Parkinson (PD) (10, 11) sau accidentul vascular cerebral (12, 13). Au fost discutate două ipoteze principale pentru dezvoltarea MM-urilor: dezvoltarea anormală a sistemului motor primar, implicând tractul corticospinal ipsilateral, și lipsa mecanismelor de inhibare a cortexului motor contralateral, în principal prin corpul calos (9, 14). Baza fiziopatologică a MM în toate aceste condiții clinice dobândite este considerată a fi rezultatul unei alterări predominante a căilor de proiecție a calosului. Cu toate acestea, o disfuncționalitate corticală sau piramidală suplimentară sau preexistentă pare să fie necesară pentru dezvoltarea MM (2). Mai mult, s-a constatat că MM-urile sunt asociate cu o inhibiție transcallosală (TI) redusă, măsurată prin stimulare magnetică transcraniană (TMS) în SLA, PD și accident vascular cerebral (3, 4, 15-17). Indiferent de mecanismul fiziopatologic exact al MM-urilor, cel mai important aspect clinic este faptul că acestea reflectă implicarea SNC de către afecțiunea patologică de bază. Tehnicile RMN de difuzie, cum ar fi imagistica tensorului de difuzie (DTI), au fost stabilite pentru a studia integritatea traiectelor neuronale in vivo în creierul uman. Studiile DTI au constatat modificări ale integrității tractului de fibre în bolile neurodegenerative, cum ar fi boala Alzheimer și SLA (18-21), inclusiv implicarea calosului (22-24). Un studiu observațional a constatat o reducere consistentă a anizotropiei fracționare în corpul calos al pacienților cu ALS, care se extinde rostral și bilateral în regiunea cortexului motor primar (23). Un studiu mai recent care utilizează DTI și TMS pentru caracterizarea neurodegenerării în ALS și a concluzionat un rol complementar ca biomarkeri de diagnosticare a disfuncției UMN (25). Ellis și colegii săi au constatat o creștere semnificativă a difuzivității medii și o reducere a anizotropiei fracționare de-a lungul tractului corticospinal la pacienții cu ALS, cu corelație cu severitatea bolii și implicarea UMN (26). Niciunul dintre aceste studii nu s-a axat pe MMs sau pe conectivitatea funcțională în ALS.
Prin urmare, am studiat asocierile măsurilor funcționale TMS cu markerii de difuzie ai integrității structurale a corpului calos și a tractului cerebrospinal într-un eșantion prospectiv de pacienți cu ALS care prezintă MMs pentru a elucida conceptele fiziopatologice ale MMs în ALS. Am emis ipoteza că pacienții cu ALS cu MM ar prezenta o integritate funcțională afectată a corpului calos, asociată cu declinul markerilor de integritate structurală. Astfel de constatări ar susține rolul disfuncției calosale și al afectării structurale pentru MM în ALS.
Pacienți și metode
Subiecți
Din nouăsprezece pacienți cu ALS și 20 de subiecți de control sănătoși au fost supuși unei evaluări clinice, și examinări RMN, inclusiv DTI. Datele demografice detaliate și caracteristica clinică a întregii cohorte de studiu sunt prezentate în tabelul 1. Toți subiecții au fost dreptaci, așa cum a fost evaluat prin inventarul Edinburgh handedness (27). La momentul examinării, 4 pacienți prezentau ALS definitivă, 8 ALS probabilă și 4 ALS posibilă în conformitate cu criteriile El Escorial revizuite (1). Trei pacienți au prezentat o variantă de neuron motor inferior. Durata medie a bolii a fost de 34,8 ± 34,8 luni. Evaluarea clinică a constat în examenul neurologic cu respectarea specială a handicapaților; MM-urile au fost evaluate prin baterea secvențială cu degetele unei mâini fără control optic și observarea MM-urilor în conformitate cu procedura lui Woods și Teuber (28), precum și evaluarea scalei revizuite de evaluare funcțională a SLA (-R) (29). În plus, pentru a aborda implicarea neuronului motor superior (UMN) a fost calculată o „povară” UMN (UMNB) prin însumarea numărului de semne UMN patologice la examinare (scor maxim 16) (30). Pentru screeningul cognitiv am utilizat „Montreal Cognitive assessment” (MOCA) (31). Scorul MOCA a variat între 18 și 29, cu o medie de 24,5 ± 4 pentru pacienții cu ALS, și între 27 și 29, cu o medie de 27,6 ± 0,7 pentru controale (P = 0,006). Controalele nu au avut plângeri cognitive și au obținut un scor în limita a 1,5 deviații standard față de valoarea normei MOCA ajustată în funcție de vârstă și educație.
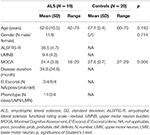
Tabelul 1. Date demografice și clinice ale tuturor subiecților studiului.
Pacienții și indivizii de control au fost incluși în studiu numai dacă au primit consimțământul scris. Studiul a fost aprobat de Comitetul de evaluare instituțională al Facultății de Medicină, Universitatea din Rostock (A-2011-0026, A 2012-0083).
Stimulare magnetică transcraniană
Am efectuat TMS la toți pacienții și la 10 din 20 de controale sănătoase. Timpul de conducere motorie centrală (CMCT), amplitudinile potențialelor evocate motorii (MEP) și perioada tăcută contralaterală (cSP) au fost determinate la toți pacienții cu SLA și la subiecții de control. MEP-urile au fost înregistrate de la primul mușchi interosos dorsal (FDI) și de la mușchiul tibial anterior (TA) folosind o bobină circulară standard (diametru exterior de 9 cm) conectată la un stimulator Magstim 200 (Magstim Co., Whitland, Dyfeld, Marea Britanie). Pentru achiziția de date a fost utilizat un sistem MEP disponibil în comerț (Brain Quick System Plus, Inomed, Erlangen, Germania). Investigarea perioadei silențioase ipsilaterale (iSP) a fost realizată cu o bobină focală (diametrul buclei externe de 7 cm). Bobina a fost orientată pentru a induce un flux de curent direcționat posterior-anterior către zona mâinii din cortexul motor; punctul de excitabilitate optimă (POE) al mușchiului FDI a fost determinat peste cortexul motor contralateral; TMS a fost aplicat la POE cu 1,5 ori pragul motor în repaus (RMT) în timp ce subiecții au efectuat o activare tonică maximă a mușchiului FDI ipsilateral și în timp ce au menținut mușchiul FDI contralateral relaxat, așa cum a fost publicat în detaliu anterior (3). Pentru determinarea latenței și a duratei iSP au fost utilizate 10 încercări pentru fiecare emisferă. După rectificarea offline și medierea semnalelor EMG, au fost analizați parametrii iSP.
Achiziții RMN
Achizițiile RMN ale creierului au fost efectuate cu ajutorul unui scaner RMN 3-Tesla cu o bobină de cap cu 32 de canale phased-array și capacități de imagistică paralelă (Magnetom Verio, Siemens, Erlangen, Germania, software syngo MR B17). Subiecții au fost scanați într-o singură sesiune, fără a-și schimba poziția în scaner. Au fost utilizate următoarele secvențe: Am achiziționat o secvență 3D sagitală de înaltă rezoluțieT1-ponderată cu magnetizare pregătită cu ecou de gradient rapid achiziționat (MP-RAGE), dimensiunea matricei de 256 × 256 × 192, dimensiunea voxelului izometric 1,0 mm3), TE/TI/TR de 4,82 ms/1.100 ms/2.500 ms, unghi de întoarcere 7°. Pentru a identifica leziunile de substanță albă a fost efectuată o secvență bidimensională ponderată T2 (recuperare prin inversiune de atenuare a fluidului FLAIR, dimensiunea matricei de 384 × 187, 24 de felii cu grosimea feliei de 5,0 mm, TE/TI/TR de 94 ms/2.500 ms/9.000 ms, unghi de întoarcere 150°). Imagistica ponderată prin difuzie a fost realizată cu o secvență de imagistică eco-planară (TE/TR 81 ms/12.700 ms) S-au aplicat gradienți de difuzie în 30 de direcții spațiale diferite. Valorile b au fost 0 și 1.000 s/mm2. Imaginile au avut o dimensiune a matricei de 128 × 128 mm, grosimea feliei de 2 mm, dimensiunea voxelului rezultat a fost de 2,0 × 2,0 × 2,0 mm2.
Prelucrarea datelor IRM
Datele DTI au fost preprocesate utilizând caseta de instrumente DTI a software-ului FSL (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, Marea Britanie, versiunea 4.1) (32). Am aplicat mai întâi corecții pentru curenții turbionari și mișcarea capului. Craniul a fost decapat cu ajutorul Brain Extraction Tool pentru diferențierea țesutului cerebral și a țesutului non-cerebral folosind o mască binară (prag 0,15-0,3), iar tensorii de difuzie au fost ajustați la date cu DTI fit (FMRIB Image Analysis Group, Oxford, Marea Britanie). Au fost create hărți de anizotropie fracțională (FA) și de difuzivitate medie (MD), precum și hărți de difuzivitate axială (AD) și de difuzivitate radială (RD).
Analizele TBSS (statistici spațiale bazate pe tract) au fost efectuate cu ajutorul software-ului FMRIB (versiunea 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSS permite reorientarea spațială a hărților FA într-un spațiu standard fără efectele sistematice ale transformării spațiale asupra direcționalității tractului de fibre și fără a fi nevoie de selectarea unui nucleu de netezire spațială care poate avea impact asupra efectelor dorite (22). Prelucrarea hărților de difuzivitate a constat în următoarele etape: Hărțile FA au fost transformate în spațiul MNI (Institutul Neurologic din Montreal). Hărțile FA normalizate ale tuturor subiecților au fost mediate și scheletizate cu un prag standardizat de 0,2. Pe baza studiului specific cu scheletele materiei a fost creat un schelet individual pentru fiecare subiect.
Pentru analiza specifică a modificărilor difuzivității traiectelor de fibre individuale am efectuat o analiză a regiunii de interes (ROI). Selectarea ROI-urilor din JHU a fost realizată așa cum a fost descrisă anterior (34). Pe baza atlasului de substanță albă JHU (35) am definit șapte regiuni: corpul calos cu subregiunile genu, truncus și splenium, tractul cortico-spinal și crus posterioară a capsulei interne pe ambele părți. Prelucrarea datelor a fost realizată cu ajutorul software-ului Matlab 2013a (MathWorks Inc., MA, Natrick, SUA) (Figura 1).
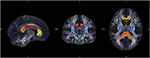
Figura 1. Figura arată suprapunerea hărții scheletului FA mediu al eșantionului nostru (albastru) și a șablonului MNI-FA normalizat și a regiunilor de interes definite pe baza atlasului materiei albe JHU: genu (galben), corpul (roșu) și spleniul (portocaliu) Corpus callosum, CST ambele site-uri (verde) și crus posterior al capsulei interne pe ambele părți (albastru deschis).
Pentru analiza corelației dintre valorile TMS și măsurile DTI, am efectuat o analiză a regiunii de interes (ROI) folosind MarsBaR (36) pentru a extrage valorile medii din corpul calos și tractul corticospinal stâng și, respectiv, drept.
Analiză statistică
Analiza statistică a fost efectuată pentru scorurile clinice, măsurătorile TMS și datele ROI în SPSS (versiunea IBM SPSS statistics 20). Pentru analiza întregului creier s-a folosit caseta de instrumente „Randomize” sub TBSS în FMRIB (versiunea 4.1 www.fmrib.ox.ac.uk/fsl). Toate scorurile clinice și parametrii TMS au prezentat o distribuție normală, care a fost testată prin utilizarea testului Kolmogorov Smirnov (P > 0,1). Diferențele în parametrii TMS au fost comparate între grupuri utilizând testul t al lui Student. Rezultatele măsurătorilor iSP au fost dihotomizate în patologic vs. non-patologic și analizate cu ajutorul testului Chi2.
Pentru analiza ROI, comparațiile de grup ale FA ale pacienților și controalelor au fost efectuate în funcție de rezultatele iSP patologice și iSP non-patologice într-o analiză de varianță univariată și teste post-hoc ulterioare. În plus, au fost calculate corelațiile dintre constatările iSP și ALSFRS și parametrii FA ai tuturor ROI-urilor investigate. Pentru analiza de corelație au fost utilizate corelațiile Spearman-Rank și semnificația a fost stabilită la P < 0,05. Pentru analiza întregului creier, am investigat diferențele de grup în anizotropia fracționată și difuzivitatea medie utilizând modelul liniar general pe bază de voxel. Analizele întregului creier au fost efectuate pentru toți parametrii de difuzie. Hărțile FA, MD, RD și AD au fost comparate prin analiza varianței univariate (factor: grup, covariate: ALSFRS-R și UMNB). Pentru a evita supraestimarea semnificației, s-a aplicat un test de comparații multiple (metoda erorilor familiale) și semnificația a fost stabilită la P < 0,05.
Rezultate
Rezultatele TMS
Investigația TMS la pacienții cu ALS a evidențiat o latență medie a iSP de 41,3 ± 5,4 ms/40,9 ± 5,7 ms (dreapta/stânga), care a fost mai lungă decât cea a controalelor sănătoase 39,0 ± 4,6/37,7 ± 6,3 (dreapta/stânga) (p = 0,006/0,012). Nu s-au constatat diferențe pentru durata iSP între pacienții cu ALS și subiecții de control. Doisprezece pacienți cu ALS (63,2%), dar niciunul dintre martori nu a prezentat pierdere de iSP. cSP a fost numeric mai scurtă la pacienții cu ALS decât la martori, fără a atinge semnificația. Pacienții cu ALS au avut un RMT mediu semnificativ mai mic în comparație cu martorii (rezultatele TMS sunt prezentate în detaliu în Tabelul 2 și Figura 2).

Tabelul 2. Rezultatele TMS la pacienții cu ALS și la martori.
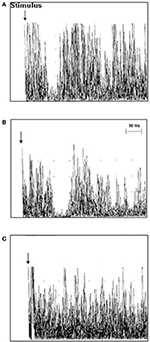
Figura 2. Răspunsuri musculare ipsilaterale (10 trasee EMG rectificate și suprapuse) înregistrate de la primul mușchi interosos dorsal (FDI) la pacienți individuali cu ALS și controale. (A) Latența iSP a fost normală în cazul de control 3 (37,8 ms), (B) latența iSP a fost prelungită în cazul 11 al pacientului cu ALS (51 ms) și (C) cazul 18 al pacientului cu ALS a prezentat o pierdere a iSP.
Diferențe de grup în ceea ce privește anizotropia fracțională și difuzivitatea medie
În ceea ce privește analizele ROI-urilor pre-specificate, valorile FA ale CST au fost semnificativ mai mici la pacienții cu ALS în comparație cu controalele. Valorile FA ale diferitelor ROI ale corpului calos (genu, splenium și corp) nu au fost diferite între cele două grupuri (tabelul 3). Valorile AD și RD au prezentat rezultate similare. Analiza întregului creier nu a arătat nicio diferență în FA, MD, RD și AD între pacienții cu ALS și controale la un nivel de semnificație corectat FWE.

Tabel 3. Constatări DTI la pacienții cu ALS și la controale .
Corelația dintre parametrii clinici, parametrii TMS și măsurile DTI
Am găsit corelații negative semnificative ale valorilor FA ale CST cu valorile RMT pe ambele părți la pacienții cu ALS, dar nu și la controale (Tabelul 4). Nu a existat nicio corelație semnificativă între valorile FA și parametrii iSP (Tabelul 4). În schimb, a existat o corelație semnificativă a scorurilor ALS-FRS-R cu valorile FA ale CST pe ambele părți (r CST-dreapta, ALS-FRS-R = 0,58, p = 0,009 și r CST-stânga, LS-FRS-R = 0,05, p = 0,02), dar nu și cu valorile FA ale corpului calos.
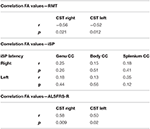
Tabel 4. Corelații între TMS și DTI.
Discuție
Disfuncția neuronilor motori inferiori și superiori este un semn clinic distinctiv al SLA. Pe lângă implicarea ariilor motorii primare, în SLA a fost sugerată și o disfuncție calosală precoce (37). MM-urile pot fi un semn clinic al căilor transcalosale disfuncționale și ar putea fi observate la ~30% dintre pacienții cu SLA. Dovezi suplimentare pentru interpretarea MMs ca markeri ai disfuncției calosale provin dintr-o serie de studii TMS care arată disfuncția calosală indicată de inhibiția transcallosală afectată (2-4, 15), împreună cu prezența MMs în ALS și în alte afecțiuni precum boala Parkinson (16). Mai mult, mai multe studii DTI au arătat modificări microstructurale nu numai în tractul piramidal, ci și în corpul calos în SLA (22, 23, 38). S-a demonstrat că implicarea calosului este o caracteristică relativ consistentă a SLA, chiar și fără implicarea clinică a UMN, și poate reflecta răspândirea interhemisferică a patologiei și o conectivitate structurală motorie afectată (23, 24).
În studiul actual ne așteptam la o corelație semnificativă a măsurilor DTI și a constatărilor TMS care reflectă inhibiția transcallosală la pacienții cu SLA cu MMs. În concordanță cu așteptările noastre, am găsit o inhibiție transcallosală afectată în până la 68% din cazuri, ceea ce este în concordanță cu datele publicate anterior din cohorte independente (3, 4). În schimb, totuși, pacienții cu ALS cu MM din eșantionul actual nu au prezentat o implicare microstructurală a corpului calos, ceea ce este în contrast cu unele (22, 34), dar nu cu toate studiile anterioare (39). O interpretare a lipsei modificărilor corpului calos în studiul nostru poate fi aceea că pacienții noștri au prezentat o tulburare funcțională anterioară, potențial anterioară constatărilor microstructurale în căile transcallosale. Astfel, cele două studii anterioare care au constatat modificări de difuzie a corpului calos (23, 41) au inclus cazuri mai avansate din punct de vedere funcțional (scorul mediu ALSFRS-R 33,1 și, respectiv, 36,5, în comparație cu 38,5 în studiul actual). Un studiu recent a demonstrat creșterea AD în corpul calos și reducerea FA în CST drept în ALS fără a lua în considerare MM-urile (25). Studiul lui Geraldo et al. nu s-a axat pe modificările electrofiziologice în căile de proiecție transcallosală, dar excitabilitatea corticală și proprietățile de conducere ale CST au fost testate prin investigarea pragului motor în repaus (RMT) ca măsură a excitabilității corticale și a timpului de conducere motorie centrală (CMCT). Ținând cont de faptul că Geraldo și colaboratorii au folosit un alt mușchi mic al mâinii ca mușchi țintă (mușchiul abductor digiti minimi față de primul mușchi interosos dorsal în studiul nostru), RMT a fost ușor mai mic în studiul nostru, reflectând o excitabilitate corticală mai mare în cohorta noastră care prezintă MM. Măsurătorile CMCT au afișat valori comparabile cu cele din studiul nostru. Extinzând aceste constatări anterioare la pacienții cu ALS cu MMs, am putut replica reducerea FA a CST asociată cu modificările TMS în ALS, fără efecte în corpul calos. O altă explicație a lipsei de semnificație a constatărilor DTI în corpul calos în eșantionul nostru ar putea fi eterogenitatea relativ mare a pacienților, care reprezintă o limitare a studiului nostru. O altă limitare este reprezentată de numărul mic de pacienți. Un motiv important pentru această circumstanță ar putea fi raritatea relativă a MM-urilor, care ar putea fi observate doar la aproximativ 30% dintre pacienții cu ALS. Din cauza limitărilor în ceea ce privește resursa de personal disponibilă, perioada de studiu nu a putut fi extinsă.
În concluzie, acesta este primul studiu care investighează o cohortă de pacienți cu SLA care prezentau toți MM. Studiul de față reproduce și extinde constatările anterioare privind integritatea redusă a tractului de fibre la pacienții cu ALS cu MM, dar nu a reușit să arate modificări microstructurale care să însoțească mișcările în oglindă și inhibiția transcallosală perturbată. Afectarea tractului piramidal pare a fi o precondiție importantă pentru dezvoltarea MMs. Acest studiu adaugă dovezi suplimentare pentru înțelegerea conectivității deficitare la pacienții cu ALS. Prin urmare, sunt necesare studii suplimentare în cohorte mai mari și mai omogene.
Declarație privind disponibilitatea datelor
Datele participanților dezidentificați vor fi împărtășite, precum și protocolul studiului și analizele statistice, în urma unor solicitări rezonabile.
Declarație etică
Studiile care implică participanți umani au fost revizuite și aprobate de către Comitetul de evaluare instituțională al Facultății de Medicină, Universitatea din Rostock (A-2011-0026, A267 2012-0083). Pacienții/participanții și-au dat consimțământul scris pentru a participa la acest studiu.
Contribuții ale autorilor
MW: concepție, design, redactarea manuscrisului, achiziția datelor și aprobarea finală a manuscrisului. NW, AG și EK: achiziția de date, revizuirea manuscrisului și aprobarea finală a manuscrisului. ST: concepția, designul, analiza și interpretarea datelor, redactarea manuscrisului, revizuirea manuscrisului și aprobarea finală a manuscrisului.
Conflict de interese
ST a efectuat lucrările enumerate mai jos (toate în Germania): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Cercul de calitate pentru medici în Kühlungsborn, Discuție: „Demența și diabetul – raport actual”
14.11.2018-MSD Expert-forum: NAB Alzheimer la München, participant în calitate de consultant
13.08.2019-Eveniment „Diabet și demență” la Rostock, Discuție: „Demența și diabetul – raport actual” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board din Frankfurt am Main, participare în calitate de consultant
27.09.2019-ROCHE Symposium at the DGN Congress in Stuttgart, Talk: „Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
Ceilalți autori declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revizuit: criterii revizuite pentru diagnosticul sclerozei laterale amiotrofice. Amyotroph Lateral Scler Other Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200200300079536
PubMed Abstract | Full CrossRef Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Mișcările în oglindă și potențialele evocate motorii ipsilaterale în ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/14660820410019657
PubMed Abstract |Ref Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract |Ref Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mișcările în oglindă în scleroza laterală amiotrofică. Amyotroph Lateral Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Diferențe între „mișcările în oglindă congenitale” și „mișcările asociate” la copiii normali: un studiu de caz neurofiziologic. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. Un studiu neurofiziologic al mișcărilor în oglindă la adulți și copii. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | Reflect Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mișcările oglinzii la oamenii sănătoși de-a lungul vieții: efecte ale dezvoltării și îmbătrânirii. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | Refef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogenia proiecțiilor corticospinale ipsilaterale: un studiu de dezvoltare cu stimulare magnetică transcraniană. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | Refef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurofiziologia controlului motor unimanual și a mișcărilor în oglindă. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Tulburări de coordonare la pacienții cu boala Parkinson: un studiu al mișcărilor ritmice ale antebrațului ritmate. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s00222210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Mișcările în oglindă în parkinsonism: evaluarea unui nou semn clinic. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | Reflect Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Modele individuale de reorganizare funcțională în cortexul cerebral uman după infarctul capsular. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | Refef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganizarea producției motorii în emisfera neafectată după un accident vascular cerebral. Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical substrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impedimentele inhibiției interhemisferice în scleroza laterală amiotrofică. Amyotroph Lateral Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | Text integral | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Conexiuni interhemisferice și ipsilaterale în boala Parkinson: relația cu mișcările în oglindă. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | Text integral | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistența mișcărilor în oglindă congenitale după un accident vascular cerebral hemiplegic. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group. anatomical MRI and DTI in the diagnosis of Alzheimer’s disease: a European multicenter study. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | Refef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | Full CrossRef Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Implicarea corpului calos este o caracteristică constantă a sclerozei laterale amiotrofice. Neurologie. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Conexomul motor structural deteriorat în scleroza laterală amiotrofică. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiologie. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | Full CrossRef Text | Google Scholar
26. Ellis CM, Simmons A, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusion tensor MRI evaluează leziunile tractului corticospinal în ALS. Neurologie. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. Evaluarea și analiza handicapei: inventarul Edinburgh. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Mișcări în oglindă după hemipareza din copilărie. Neurologie. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.11.1152
PubMed Abstract | Refef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. Grupul de studiu BDNF ALS (faza III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | Refef Full Text | Google Scholar
30. Turner MR, Cagnin A, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Dovezi ale activării microgliale cerebrale răspândite în scleroza laterală amiotrofică: un studiu de tomografie cu emisie de pozitroni (R)-PK11195. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Statistici spațiale bazate pe tract: analiza voxelwise a datelor de difuzie multi-subiect. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. DELCODE study group. multicenter tract-based analysis of microstructural lesions within the Alzheimer’s disease spectrum: association with amyloid pathology and diagnostic usefulness. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Hărți de probabilitate a tractului în spații stereotaxice: analize ale anatomiei materiei albe și cuantificarea specifică tractului. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Analiza regiunii de interes utilizând SPM toolbox (rezumat). Prezentat la cea de-a 8-a conferință internațională privind cartografierea funcțională a creierului uman, 2-6 iunie 2002, Sendai, Japonia. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | Refef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Disfuncția calosală în scleroza laterală amiotrofică se corelează cu imagistica tensorială de difuzie a sistemului motor central. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Modificări microstructurale ale materiei albe care stau la baza afectării cognitive și comportamentale în ALS – un studiu in vivo folosind DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar
.