- Introduction
- Pacjenci i Metody
- Przedmioty
- Transcranial Magnetic Stimulation
- Akwizycja MRI
- Przetwarzanie danych MRI
- Analiza statystyczna
- Wyniki
- Wyniki TMS
- Różnice grupowe w anizotropii frakcyjnej i średniej dyfuzyjności
- Correlation of Clinical Parameter, TMS Parameters, and DTI Measures
- Dyskusja
- Oświadczenie o dostępności danych
- Oświadczenie o etyce
- Wkład autorów
- Konflikt interesów
Introduction
Stwardnienie zanikowe boczne (ALS) jest postępującą chorobą neurodegeneracyjną charakteryzującą się głównie zespołem ruchowym ze zmienną ekspresją dysfunkcji dolnego (LMN) i górnego (UMN) neuronu ruchowego. Kryteria El Escorial (1) wymagają zajęcia UMN i LMN w jednej lub kilku okolicach ciała w celu postawienia diagnozy definitywnej ALS. Objawy UMN mogą obejmować spastyczność, wzmocnione lub zachowane odruchy ścięgniste i reakcję prostowników grzbietu. Ruchy lustrzane (mirror movements – MMs) były wielokrotnie opisywane w ALS (2-4), ale nadal nie są częścią kryteriów diagnostycznych. MMs są mimowolnymi ruchami kontralateralnymi w stosunku do zamierzonego ruchu palca. MMs mogą być widoczne u normalnych dzieci do 10 roku życia, ale ich częstość występowania i intensywność zmniejsza się po tym wieku (5-7), co prawdopodobnie odzwierciedla dojrzewanie ciała modzelowatego (8). Utrzymywanie się lub nowa manifestacja MMs u dorosłych może mieć różną etiologię. Trwałe wrodzone MM opisywano w różnych stanach chorobowych, od braku innych zaburzeń neurologicznych do ciężkiego wrodzonego niedowładu połowiczego w mózgowym porażeniu dziecięcym (9). MMs opisywano również w wielu innych nabytych stanach chorobowych, takich jak choroba Parkinsona (PD) (10, 11) lub udar mózgu (12, 13). Omówiono dwie główne hipotezy rozwoju MM: nieprawidłowy rozwój pierwotnego układu ruchowego, obejmujący ipsilateralny szlak korowo-rdzeniowy, oraz brak kontralateralnych mechanizmów hamujących kory ruchowej, głównie poprzez ciało modzelowate (9, 14). Uważa się, że patofizjologiczne podłoże MMs we wszystkich tych nabytych stanach klinicznych jest wynikiem dominującej zmiany szlaków projekcyjnych ciała modzelowatego. Wydaje się jednak, że do rozwoju MM konieczne jest dodatkowe lub istniejące wcześniej zaburzenie funkcji korowych lub piramidowych (2). Ponadto stwierdzono, że MM wiążą się z obniżonym hamowaniem przezciemieniowym (TI) mierzonym za pomocą przezczaszkowej stymulacji magnetycznej (TMS) w ALS, PD i udarze mózgu (3, 4, 15-17). Niezależnie od dokładnego mechanizmu patofizjologicznego MM, najważniejszym aspektem klinicznym jest to, że odzwierciedlają one zajęcie OUN przez leżący u ich podłoża stan patologiczny. Dyfuzyjne techniki MRI, takie jak obrazowanie tensora dyfuzji (diffusion tensor imaging – DTI), zostały stworzone do badania integralności szlaków neuronalnych in vivo w ludzkim mózgu. Badania DTI wykazały zmiany integralności szlaków włókien w chorobach neurodegeneracyjnych, takich jak choroba Alzheimera i ALS (18-21), w tym zajęcie ciała modzelowatego (22-24). Badanie obserwacyjne wykazało konsekwentne zmniejszenie anizotropii frakcyjnej w ciele modzelowatym pacjentów z ALS, rozciągające się rostralnie i obustronnie na obszar pierwotnych kor motorycznych (23). W nowszym badaniu wykorzystano DTI i TMS do charakterystyki neurodegeneracji w ALS i stwierdzono ich uzupełniającą się rolę jako biomarkerów diagnostycznych dysfunkcji UMN (25). Ellis i współpracownicy stwierdzili znaczący wzrost średniej dyfuzyjności i zmniejszenie anizotropii frakcyjnej wzdłuż dróg korowo-rdzeniowych u pacjentów z ALS, z korelacją do stopnia zaawansowania choroby i zaangażowania UMN (26). Żadne z tych badań nie skupiło się na MMs albo funkcjonalnej łączności w ALS.
Dlatego, badaliśmy stowarzyszenia funkcjonalnych środków TMS z dyfuzyjnymi markerami strukturalnej integralności ciała modzelowatego i szlaku mózgowo-rdzeniowego w prospektywnej próbie pacjentów ALS wyświetlających MMs by wyjaśnić patofizjologiczne koncepcje MMs w ALS. Postawiliśmy hipotezę, że pacjenci z ALS z MMs będą wykazywać upośledzoną integralność funkcjonalną ciała modzelowatego, związaną ze spadkiem markerów integralności strukturalnej. Takie ustalenia wspierałyby rolę dysfunkcji ciała modzelowatego i strukturalnego upośledzenia dla MMs w ALS.
Pacjenci i Metody
Przedmioty
Nietnastu pacjentów z ALS i 20 zdrowych przedmiotów kontroli przeszło ocenę kliniczną i badania MRI, włączając DTI. Szczegółowe dane demograficzne i charakterystykę kliniczną całej badanej kohorty przedstawiono w tabeli 1. Wszyscy badani byli praworęczni, co oceniano za pomocą Edinburgh handedness inventory (27). W momencie badania u 4 pacjentów stwierdzono definitywną ALS, u 8 prawdopodobną ALS i u 4 możliwą ALS według zrewidowanych kryteriów El Escorial (1). Trzech pacjentów wykazywało wariant dolnego neuronu ruchowego. Średni czas trwania choroby wynosił 34,8 ± 34,8 miesiąca. Ocena kliniczna składała się z badania neurologicznego ze szczególnym uwzględnieniem ręczności; MM były oceniane przez sekwencyjne stukanie palcami jednej ręki bez kontroli wzrokowej i obserwacji MM zgodnie z procedurą Woodsa i Teubera (28), oraz oceny zrewidowanej skali oceny funkcjonalnej ALS (-R) (29). Ponadto, aby odnieść się do zaangażowania górnego neuronu ruchowego (UMN), obliczono „obciążenie” UMN (UMNB) poprzez zsumowanie liczby patologicznych objawów UMN w badaniu (maksymalny wynik 16) (30). Do badań kognitywnych użyto „Montrealskiej oceny poznawczej” (MOCA) (31). Wynik MOCA wahał się między 18 a 29 ze średnią 24,5 ± 4 dla pacjentów z ALS i między 27 a 29 ze średnią 27,6 ± 0,7 dla kontroli (P = 0,006). Osoby z grupy kontrolnej nie miały dolegliwości poznawczych i uzyskały wynik w granicach 1,5 odchylenia standardowego od wartości normy MOCA skorygowanej o wiek i wykształcenie.
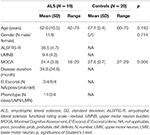
Tabela 1. Dane demograficzne i kliniczne wszystkich uczestników badania.
Pacjenci i osoby z grupy kontrolnej byli włączani do badania tylko w przypadku uzyskania pisemnej zgody. Badanie zostało zatwierdzone przez Institutional Review Board of the Medical Faculty, University of Rostock (A-2011-0026, A 2012-0083).
Transcranial Magnetic Stimulation
Wykonaliśmy TMS u wszystkich pacjentów i u 10 z 20 zdrowych osób z grupy kontrolnej. Centralny czas przewodzenia ruchowego (CMCT), amplitudy motorycznych potencjałów wywołanych (MEP) i kontralateralny okres ciszy (cSP) zostały określone u wszystkich pacjentów z ALS i osób z grupy kontrolnej. MEP były rejestrowane z pierwszego mięśnia międzykostnego grzbietowego (FDI) oraz z mięśnia piszczelowego przedniego (TA) przy użyciu standardowej cewki okrężnej (średnica zewnętrzna 9 cm) podłączonej do stymulatora Magstim 200 (Magstim Co., Whitland, Dyfeld, UK). Do akwizycji danych użyto komercyjnego systemu MEP (Brain Quick System Plus, Inomed, Erlangen, Niemcy). Badanie ipsilateralnego okresu ciszy (iSP) przeprowadzono przy użyciu cewki ogniskowej (średnica pętli zewnętrznej 7 cm). Cewka była zorientowana tak, aby wywołać przepływ prądu skierowany tylno-przednio do obszaru kory ruchowej ręki; punkt optymalnej pobudliwości (POE) mięśnia FDI był wyznaczany nad kontralateralną korą ruchową; TMS był aplikowany w POE z 1,5-krotną wartością spoczynkowego progu motorycznego (RMT), podczas gdy badani wykonywali maksymalną toniczną aktywację ipsilateralnego mięśnia FDI i gdy utrzymywali kontralateralny mięsień FDI w stanie rozluźnienia, jak szczegółowo opublikowano wcześniej (3). Do określenia latencji i czasu trwania iSP używano 10 prób dla każdej półkuli. Po rektyfikacji offline i uśrednieniu sygnałów EMG, parametry iSP były analizowane.
Akwizycja MRI
Akwizycje MRI mózgu były prowadzone przy użyciu 3-Teslowego skanera MRI z 32-kanałową cewką głowicy phased-array i możliwościami obrazowania równoległego (Magnetom Verio, Siemens, Erlangen, Niemcy, oprogramowanie syngo MR B17). Badani byli skanowani w jednej sesji, bez zmiany pozycji w skanerze. Zastosowano następujące sekwencje: Wykonano strzałkową wysokorozdzielczą sekwencję 3D T1-weighted magnetization prepared rapidly acquired gradient echo (MP-RAGE), rozmiar matrycy 256 × 256 × 192, izometryczny rozmiar voxela 1,0 mm3), TE/TI/TR 4,82 ms/1,100 ms/2,500 ms, flip angle 7°. W celu identyfikacji zmian w istocie białej wykonano dwuwymiarową sekwencję T2-ważoną (fluid attenuation inversion recovery FLAIR, rozmiar matrycy 384 × 187, 24 warstwy o grubości 5,0 mm, TE/TI/TR 94 ms/2 500 ms/9 000 ms, kąt odwracania 150°). Obrazowanie dyfuzyjne wykonano za pomocą sekwencji echo-planarnej (TE/TR 81 ms/12 700 ms). Gradienty dyfuzyjne zastosowano w 30 różnych kierunkach przestrzennych. Wartości b wynosiły 0 i 1,000 s/mm2. Obrazy miały rozmiar matrycy 128 × 128 mm, grubość warstwy 2 mm, wynikowy rozmiar voxela wynosił 2,0 × 2,0 × 2,0 mm2.
Przetwarzanie danych MRI
Dane DTI zostały wstępnie przetworzone przy użyciu zestawu narzędzi DTI oprogramowania FSL (http://www.fmrib.ox.ac.uk/fsl/, FMRIB, Oxford, UK, wersja 4.1) (32). Najpierw zastosowaliśmy korekcje dla prądów wirowych i ruchu głowy. Czaszka została usunięta przy użyciu narzędzia Brain Extraction Tool w celu rozróżnienia tkanki mózgowej i pozamózgowej przy użyciu maski binarnej (próg 0,15-0,3), a tensory dyfuzji zostały dopasowane do danych przy użyciu DTI fit (FMRIB Image Analysis Group, Oxford, UK). Utworzono mapy anizotropii frakcyjnej (FA) i średniej dyfuzyjności (MD), a także mapy dyfuzyjności osiowej (AD) i radialnej (RD).
Analizę TBSS (tract based spatial statistics) wykonano przy użyciu oprogramowania FMRIB (wersja 4.1 www.fmrib.ox.ac.uk/fsl) (33). TBSS umożliwia przestrzenną reorientację map FA w standardowej przestrzeni bez systematycznego wpływu transformacji przestrzennej na kierunkowość dróg włóknistych i bez konieczności wyboru przestrzennego jądra wygładzającego, które może mieć wpływ na pożądane efekty (22). Przetwarzanie map dyfuzyjności składało się z następujących etapów: Mapy FA zostały przekształcone do przestrzeni MNI (Montreal Neurologic Institute). Znormalizowane mapy FA wszystkich badanych osób zostały uśrednione i poddane szkieletyzacji ze standaryzowanym progiem 0,2. Na podstawie specyficznych dla badania szkieletów materii utworzono indywidualny szkielet dla każdego uczestnika badania.
Dla specyficznej analizy zmian dyfuzyjności poszczególnych szlaków włóknistych przeprowadzono analizę ROI (region of interest). Wyboru ROI z JHU dokonano w sposób opisany wcześniej (34). Na podstawie atlasu istoty białej JHU (35) zdefiniowaliśmy siedem regionów: ciało modzelowate z podregionami genu, truncus i splenium, drogi korowo-rdzeniowe oraz crus posterior of the internal capsula po obu stronach. Przetwarzanie danych wykonano za pomocą oprogramowania Matlab 2013a (MathWorks Inc., MA, Natrick, USA) (Ryc. 1).
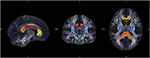
Rysunek 1. Rysunek pokazuje nakładanie się średniej mapy szkieletowej FA naszej próbki (niebieski) i znormalizowanego wzorca MNI-FA oraz zdefiniowanych regionów zainteresowania na podstawie atlasu istoty białej JHU: genu (żółty), korpusu (czerwony) i Splenium (pomarańczowy) ciała modzelowatego, CST po obu stronach (zielony) i crus posterior of the internal capsula po obu stronach (jasnoniebieski).
Do analizy korelacji pomiędzy wartościami TMS i pomiarami DTI wykonaliśmy analizę regionu zainteresowania (ROI) przy użyciu MarsBaR (36) w celu wyodrębnienia średnich wartości z ciała modzelowatego oraz odpowiednio lewej i prawej drogi korowo-rdzeniowej.
Analiza statystyczna
Analizę statystyczną przeprowadzono dla ocen klinicznych, pomiarów TMS i danych ROI w programie SPSS (wersja IBM SPSS statistics 20). Do analizy całego mózgu wykorzystano zestaw narzędzi „Randomize” w ramach TBSS w FMRIB (wersja 4.1 www.fmrib.ox.ac.uk/fsl). Wszystkie wyniki kliniczne i parametry TMS wykazywały rozkład normalny, co sprawdzono za pomocą testu Kołmogorowa Smirnowa (P > 0,1). Różnice w parametrach TMS porównywano między grupami za pomocą testu t-Studenta. Wyniki pomiarów iSP były dychotomizowane na patologiczne vs niepatologiczne i analizowane przy użyciu testu Chi2.
Dla analizy ROI, grupowe porównania FA pacjentów i kontroli były wykonywane zgodnie z ustaleniami patologicznego iSP i niepatologicznego iSP w jednoczynnikowej analizie wariancji i kolejnych testach post-hoc. Ponadto obliczono korelacje pomiędzy wynikami iSP a ALSFRS i parametrami FA wszystkich badanych ROI. Do analizy korelacji użyto korelacji Spearman-Rank, a istotność ustalono na poziomie P < 0,05.Do analizy całego mózgu zbadaliśmy różnice grupowe w anizotropii frakcyjnej i średniej dyfuzyjności za pomocą ogólnego modelu liniowego na podstawie wokseli. Analizy całego mózgu zostały przeprowadzone dla wszystkich parametrów dyfuzji. Mapy FA, MD, RD i AD porównywano za pomocą jednoczynnikowej analizy wariancji (czynnik: grupa, kowariancja: ALSFRS-R i UMNB). W celu uniknięcia przeszacowania istotności zastosowano test wielokrotnych porównań (metoda family wise error), a istotność ustalono na poziomie P < 0,05.
Wyniki
Wyniki TMS
Badanie TMS u pacjentów z ALS wykazało średnią latencję iSP wynoszącą 41,3 ± 5,4 ms/40,9 ± 5,7 ms (prawa/lewa), która była dłuższa niż u osób zdrowych z grupy kontrolnej 39,0 ± 4,6/37,7 ± 6,3 (prawa/lewa) (p = 0,006/0,012). Nie stwierdzono różnic w czasie trwania iSP między pacjentami z ALS a osobami z grupy kontrolnej. Dwunastu pacjentów z ALS (63,2%), ale żaden z grupy kontrolnej nie wykazał utraty iSP. cSP był numerycznie krótszy u pacjentów z ALS niż w grupie kontrolnej bez osiągnięcia istotności. Pacjenci z ALS mieli znacząco niższą średnią RMT w porównaniu z kontrolami (wyniki TMS są przedstawione szczegółowo w Tabeli 2 i Rycinie 2).

Tabela 2. Wyniki TMS u pacjentów z ALS i w grupie kontrolnej.
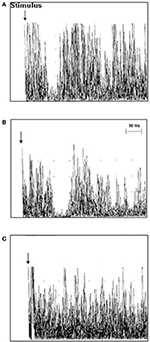
Rysunek 2. Ipsilateralne odpowiedzi mięśniowe (10 wyprostowanych i nałożonych na siebie śladów EMG) zarejestrowane z pierwszego grzbietowego mięśnia międzykostnego (FDI) u poszczególnych pacjentów z ALS i osób z grupy kontrolnej. (A) latencja iSP była normalna w przypadku kontrolnym 3 (37,8 ms), (B) latencja iSP była wydłużona w przypadku pacjenta z ALS 11 (51 ms), i (C) przypadek pacjenta z ALS 18 wykazywał utratę iSP.
Różnice grupowe w anizotropii frakcyjnej i średniej dyfuzyjności
W odniesieniu do analiz wstępnie określonych ROI wartości FA w CST były znacząco niższe u pacjentów z ALS w porównaniu z kontrolami. Wartości FA w poszczególnych ROI ciała modzelowatego (genu, splenium i ciała) nie różniły się pomiędzy obiema grupami (Tabela 3). Wartości AD i RD wykazały podobne wyniki. Analiza całego mózgu nie wykazała żadnych różnic w FA, MD, RD i AD między pacjentami z ALS i kontrolami na poziomie istotności skorygowanym o FWE.

Tabela 3. DTI findings in ALS patients and controls .
Correlation of Clinical Parameter, TMS Parameters, and DTI Measures
Znaleźliśmy znaczące ujemne korelacje wartości FA CST z wartościami RMT po obu stronach u pacjentów z ALS, ale nie w grupie kontrolnej (Tabela 4). Nie stwierdzono istotnej korelacji między wartościami FA a parametrami iSP (tab. 4). Natomiast istniała istotna korelacja wyników ALS-FRS-R z wartościami FA CST po obu stronach (r CST-prawa, ALS-FRS-R = 0,58, p = 0,009 i r CST-lewa, LS-FRS-R = 0,05, p = 0,02), ale nie z wartościami FA ciała modzelowatego.
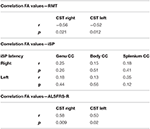
Tabela 4. Korelacje pomiędzy TMS i DTI.
Dyskusja
Dysfunkcja dolnego i górnego neuronu ruchowego jest klinicznym wyróżnikiem ALS. Oprócz zajęcia pierwotnych obszarów ruchowych, w ALS sugeruje się również wczesną dysfunkcję ciała modzelowatego (37). MMs mogą być klinicznym objawem dysfunkcji szlaków transcallosalnych i mogą być obserwowane u ~30% pacjentów z ALS. Dalsze dowody na interpretację MMs jako markerów dysfunkcji ciała modzelowatego pochodzą z szeregu badań TMS wykazujących dysfunkcję ciała modzelowatego, na którą wskazuje upośledzenie hamowania przezściennego (2-4, 15) w połączeniu z obecnością MMs w ALS i innych schorzeniach, takich jak choroba Parkinsona (16). Ponadto, kilka badań DTI wykazało zmiany mikrostrukturalne nie tylko w drogach piramidowych, ale także w ciele modzelowatym w ALS (22, 23, 38). Wykazano, że zaangażowanie ciała modzelowatego jest stosunkowo spójną cechą ALS, nawet bez klinicznego zaangażowania UMN, i może odzwierciedlać międzypółkulowe rozprzestrzenianie się patologii i zaburzoną strukturalną łączność ruchową (23, 24).
W bieżącym badaniu spodziewaliśmy się znaczącej korelacji pomiarów DTI i wyników TMS odzwierciedlających hamowanie przezciemieniowe u pacjentów z ALS z MMs. Zgodnie z naszymi oczekiwaniami, stwierdziliśmy upośledzenie hamowania transcallosalnego w 68% przypadków, co jest zgodne z wcześniej opublikowanymi danymi z niezależnych kohort (3, 4). W przeciwieństwie jednak do tego, pacjenci z ALS z MM w obecnej próbie nie wykazali mikrostrukturalnego zaangażowania ciała modzelowatego, co jest sprzeczne z niektórymi (22, 34), ale nie wszystkimi wcześniejszymi badaniami (39). Jedną z interpretacji braku zmian w ciele modzelowatym w naszym badaniu może być to, że nasi pacjenci wykazywali wcześniejsze zaburzenia funkcjonalne potencjalnie poprzedzające mikrostrukturalne odkrycia w drogach transcallosalnych. Tak więc dwa poprzednie badania, w których stwierdzono zmiany dyfuzyjne w ciele modzelowatym (23, 41), obejmowały bardziej zaawansowane funkcjonalnie przypadki (średni wynik ALSFRS-R odpowiednio 33,1 i 36,5, w porównaniu z 38,5 w obecnym badaniu). W jednym z ostatnich badań wykazano zwiększenie AD w ciele modzelowatym i zmniejszenie FA w prawym CST w ALS bez uwzględnienia MMs (25). Badanie Geraldo i wsp. nie koncentrowało się na zmianach elektrofizjologicznych w szlakach przezbłonowych, ale badano pobudliwość korową i właściwości przewodzenia w CST poprzez badanie spoczynkowego progu motorycznego (RMT) jako miary pobudliwości korowej i centralnego czasu przewodzenia motorycznego (CMCT). Biorąc pod uwagę, że Geraldo i współpracownicy używali innego mięśnia małej ręki jako mięśnia docelowego (abductor digiti minimi vs. pierwszy mięsień grzbietowy międzykostny w naszym badaniu) RMT był nieco niższy w naszym badaniu odzwierciedlając większą pobudliwość korową w naszej kohorcie wykazującej MMs. Pomiary CMCT wykazały porównywalne wartości do naszego badania. Rozszerzając te wcześniejsze wyniki na pacjentów z ALS z MMs, mogliśmy zreplikować redukcję FA w CST związaną ze zmianami TMS w ALS, bez wpływu na ciało modzelowate. Innym wyjaśnieniem braku istotności wyników DTI w ciele modzelowatym w naszej próbie może być względnie duża heterogeniczność pacjentów, która stanowi jedno z ograniczeń naszego badania. Innym ograniczeniem jest mała liczba pacjentów. Główną przyczyną tej sytuacji może być względna rzadkość występowania MM, które można zaobserwować tylko u około 30% pacjentów z ALS. Z powodu ograniczeń w dostępnym personelu okres badania nie mógł być przedłużony.
W podsumowaniu, jest to pierwsze badanie kohorty pacjentów z ALS, którzy wszyscy wykazywali MMs. Obecne badanie replikuje i rozszerza poprzednie ustalenia dotyczące zmniejszonej integralności dróg włóknistych u pacjentów z ALS z MMs, ale nie wykazało zmian mikrostrukturalnych towarzyszących ruchom lustrzanym i zaburzonemu hamowaniu transcallosalnemu. Uszkodzenie dróg piramidowych wydaje się być ważnym warunkiem wstępnym rozwoju MMs. Badanie to dostarcza kolejnych dowodów na zrozumienie zaburzeń łączności u pacjentów z ALS. Dlatego potrzebne są dalsze badania w większych i bardziej jednorodnych kohortach.
Oświadczenie o dostępności danych
Dane osobowe uczestników zostaną udostępnione, jak również protokół badania i analizy statystyczne, na uzasadnione żądanie.
Oświadczenie o etyce
Badania z udziałem ludzi zostały przejrzane i zatwierdzone przez Institutional Review Board Wydziału Medycznego Uniwersytetu w Rostoku (A-2011-0026, A267 2012-0083). Pacjenci/uczestnicy wyrazili pisemną zgodę na udział w tym badaniu.
Wkład autorów
MW: koncepcja, projekt, sporządzenie manuskryptu, uzyskanie danych i ostateczne zatwierdzenie manuskryptu. NW, AG, and EK: acquisition of data, revision of manuscript, and final approval of manuscript. ST: koncepcja, projekt, analiza i interpretacja danych, sporządzenie manuskryptu, korekta manuskryptu i ostateczne zatwierdzenie manuskryptu.
Konflikt interesów
ST wykonał wymienione poniżej prace (wszystkie w Niemczech): MSD Sharp & Dohme GmbH, Lindenplatz 1, 85540 Haar
11.09.2018-Quality circle for physicians in Kühlungsborn, Talk: „Dementia and Diabetes-current report”
14.11.2018-MSD Expert-forum: NAB Alzheimer w Monachium, uczestnik jako konsultant
13.08.2019-Event „Diabetes and Dementia” w Rostocku, Talk: „Dementia and Diabetes-current report” ROCHE Pharma AG, Emil-Barell-Str. 1, 79639 Grenzach-Wyhlen
12.09.2019–3. National Advisory-Board we Frankfurcie nad Menem, udział w charakterze konsultanta
27.09.2019-ROCHE Sympozjum na Kongresie DGN w Stuttgarcie, Talk: „Amyloid as target for diagnosis and treatment in Alzheimer’s disease.”
Pozostali autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Brooks BR, Miller RG, Swash M, Munsat TL. El escorial revisited: zmienione kryteria diagnozy stwardnienia zanikowego bocznego. Amyotroph Lateral Scler Inne Motor Neuron Disord. (2000) 1:293-9. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krampfl K, Mohammadi B, Komissarow L, Dengler R, Bufler J. Mirror movements and ipsilateral motor evoked potentials in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord. (2004) 5:154-63. doi: 10.1080/14660820410019657
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wittstock M, Wolters A, Benecke R. Transcallohsal inhibition in amyotrophic lateral sclerosis. Clin. Neurophysiol. (2007) 118:301-7. doi: 10.1016/j.clinph.2006.09.026
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Wittstock M, Meister S, Walter U, Benecke R, Wolters A. Mirror movements in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2011) 6:393-7. doi: 10.3109/17482968.2011.577223
CrossRef Full Text | Google Scholar
5. Reitz M, Müller K. Differences between 'congenital mirror movements’ and 'associated movements’ in normal children: a neurophysiological case study. Neurosci Lett. (1998) 256:69-72. doi: 10.1016/S0304-3940(98)00748-4
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Mayston MJ, Harrison LM, Stephens JA. Badanie neurofizjologiczne ruchów lustrzanych u dorosłych i dzieci. Ann Neurol. (1999) 45:583-94. doi: 10.1002/1531-8249(199905)45:5<583::AID-ANA6>3.0.CO;2-W
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Koerte I, Eftimov L, Laubender RP, Esslinger O, Schroeder AS, Ertl-Wagner B, et al. Mirror movements in healthy humans across the lifespan: effects of development and ageing. Dev Med Child Neurol. (2010) 52:1106-12. doi: 10.1111/j.1469-8749.2010.03766.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Müller K, Kass-Iliya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation. Ann Neurol. (1997) 42:705-71. doi: 10.1002/ana.410420506
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cincotta M, Ziemann U. Neurofizjologia jednoosobowej kontroli motorycznej i ruchów lustrzanych. Clin Neurophysiol. (2008) 119:744-62. doi: 10.1016/j.clinph.2007.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Van den Berg C, Beek PJ, Wagenaar RC, van Wieringen PC. Coordination disorders in patients with Parkinson’s disease: a study of paced rhythmic forearm movements. Exp Brain Res. (2000) 134:174-86. doi: 10.1007/s002210000441
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Espay AJ, Li JY, Johnston L, Chen R, Lang AE. Ruchy lustrzane w parkinsonizmie: ocena nowego objawu klinicznego. J Neurol Neurosurg Psychiatry. (2005) 76:1355-8. doi: 10.1136/jnnp.2005.062950
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS. Indywidualne wzorce reorganizacji funkcjonalnej w ludzkiej korze mózgowej po zawale czaszkowym. Ann Neurol. (1993) 33:181-9. doi: 10.1002/ana.410330208
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Netz J, Lammers T, Hömberg V. Reorganization of motor output in the non-affected hemisphere after stroke. Brain. (1997) 120:1579-86. doi: 10.1093/brain/120.9.1579
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Manara R, Salvalaggio A, Citton V, Palumbo V, D’Errico A, Elefante A, et al. Brain anatomical substrates of mirror movements in Kallmann syndrome. Neuroimage. (2015) 104:52-8. doi: 10.1016/j.neuroimage.2014.09.067
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karandreas N, Papadopoulou M, Kokotis P, Papapostolou A, Tsivgoulis G, Zambelis T. Impaired interhemispheric inhibition in amyotrophic lateral sclerosis. Amyotroph Lateral Scler. (2007) 8:112-8. doi: 10.1080/17482960601030113
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Li JY, Espay AJ, Gunraj CA, Pal PK, Cunic DI, Lang AE, et al. Interhemispheric and ipsilateral connections in Parkinson’s disease: relation to mirror movements. Mov Disord. (2007) 22:813-21. doi: 10.1002/mds.21386
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Rocca MA, Mezzapesa DM, Comola M, Leocani L, Falini A, Gatti R, et al. Persistence of congenital mirror movements after hemiplegic stroke. AJNR Am J Neuroradiol. (2005) 26:831-4.
PubMed Abstract | Google Scholar
18. Teipel SJ, Wegrzyn M, Meindl T, Frisoni G, Bokde AL, Fellgiebel A, et al. EDSD study group. anatomical MRI and DTI in the diagnosis of Alzheimer’s disease: a European multicenter study. J Alzheimers Dis. (2012) 31(Suppl. 3):S33-47. doi: 10.3233/JAD-2012-112118
CrossRef Full Text | Google Scholar
19. Turner MR, Grosskreutz J, Kassubek J, Abrahams S, Agosta F, Benatar M, et al. First neuroimaging symosium in ALS (NISALS). Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. (2011) 10:400-3. doi: 10.1016/S1474-4422(11)70049-7
CrossRef Full Text | Google Scholar
20. Müller HP, Turner MR, Grosskreutz J, Abrahams S, Bede P, Govind V, et al. Neuroimaging society in ALS (NiSALS) DTI study group. a large-scale multicentre cerebral diffusion tensor imaging study in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry. (2016) 87:570-9. doi: 10.1136/jnnp-2015-311952
CrossRef Full Text | Google Scholar
21. Kassubek J, Müller HP, Del Tredici K, Lulé D, Gorges M, Braak H, et al. Imaging the pathoanatomy of amyotrophic lateral sclerosis in vivo: targeting a propagation-based biological marker. J Neurol Neurosurg Psychiatry. (2018) 89:374-81. doi: 10.1136/jnnp-2017-316365
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Sach M, Winkler G, Glauche V, Liepert J, Heimbach B, Koch MA, et al. Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Brain. (2004) 127:340-50. doi: 10.1093/brain/awh041
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Filippini N, Douaud G, Mackay CE, Knight S, Talbot K, Turner MR. Corpus callosum involvement is a consistent feature of amyotrophic lateral sclerosis. Neurology. (2010) 75:1645-52. doi: 10.1212/WNL.0b013e3181fb84d1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Verstraete E, Veldink JH, Mandl RCW, van den Berg LH, van den Heuvel MP. Impaired structural motor connectome in amyotrophic lateral sclerosis. PLoS ONE. (2011) 6:e24239. doi: 10.1371/journal.pone.0024239
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Geraldo AF, Pereira J, Nunes P, Reimão S, Sousa R, Castelo-Branco M, et al. Beyond fractional anisotropy in amyotrophic lateral sclerosis: the value of mean, axial, and radial diffusivity and its correlation with electrophysiological conductivity changes. Neuroradiology. (2018) 60:505-15. doi: 10.1007/s00234-018-2012-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Ellis CM, Simmons A, Jones DK, Bland J, Dawson JM, Horsfield MA, et al. Diffusion tensor MRI assesses corticospinal tract damage in ALS. Neurology. (1999) 53:1051-8. doi: 10.1212/WNL.53.5.1051
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Oldfield RC. Ocena i analiza ręki: inwentarz edynburski. Neuropsychologia. (1971) 9:97-113. doi: 10.1016/0028-3932(71)90067-4
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Woods BT, Teuber HL. Mirror movements after childhood hemiparesis. Neurology. (1978) 28:1152-7. doi: 10.1212/WNL.28.11.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. BDNF ALS study group (Phase III). J Neurol Sci. (1999) 169:13-21. doi: 10.1016/S0022-510X(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Turner MR, Cagnin A, Turkheimer FE, Miller CC, Shaw CE, Brooks DJ, et al. Evidence of widespread cerebral microglial activation in amyotrophic lateral sclerosis: an (R)-PK11195 positron emission tomography study. Neurobiol Dis. (2004) 15:601-9. doi: 10.1016/j.nbd.2003.12.012@@uline@
CrossRef Full Text | Google Scholar
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am. Geriatr Soc. (2005) 53:695-9. doi: 10.1111/j.1532-5415.2005.53221.x
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Smith SM, Jenkinson M, Woolrich MW, Beckmann CF, Behrens TEJ, Johansen-Berg H, et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. (2004) 23:208-19. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. (2006) 31:1487-505. doi: 10.1016/j.neuroimage.2006.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Teipel SJ, Kuper-Smith JO, Bartels C, Brosseron F, Buchmann M, Buerger K, et al. Grupa badawcza DELCODE. wieloośrodkowa analiza oparta na traktach zmian mikrostrukturalnych w obrębie spektrum choroby Alzheimera: związek z patologią amyloidową i przydatność diagnostyczna. J Alzheimers Dis. (2019) 72:455-65. doi: 10.3233/JAD-190446
CrossRef Full Text | Google Scholar
35. Hua K, Zhang J, Wakana S, Jiang H, Li X, Reich DS, et al. Tract probability maps in stereotaxic spaces: analyses of white matter anatomy and tract-specific quantification. NeuroImage. (2008) 39:336-47. doi: 10.1016/j.neuroimage.2007.07.053
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Brett M, Anton JL, Valabregue R, Poline JB. Analiza regionu zainteresowania przy użyciu SPM toolbox (abstrakt). Presented at the 8th international conference on functional mapping of the human brain, June 2-6, 2002, Sendai, Japan. NeuroImage. 16:253-62.
Google Scholar
37. Caiazzo G, Corbo D, Trojsi F, Piccirillo G, Cirillo M, Monsurrò MR, et al. Distributed corpus callosum involvement in amyotrophic lateral sclerosis: a deterministic tractography study using q-ball imaging. J Neurol. (2014) 261:27-36. doi: 10.1007/s00415-013-7144-3
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Bartels C, Mertens M, Hofer S, Merboldt KM, Dietrich J, Frahm J, et al. Callosal dysfunction in amyotrophic lateral sleosis correlates with diffusion tensor imaging of the central motor system. Neuromusc Disord. (2008) 18:398-407. doi: 10.1016/j.nmd.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kasper E, Schuster C, Machts J, Kaufmann J, Bittner D, Vielhaber S, et al. Microstructural white matter changes underlying cognitive and behavioural impairment in ALS-an in vivo study using DTI. PLoS ONE. (2014) 9:e114543. doi: 10.1371/journal.pone.0114543
PubMed Abstract | CrossRef Full Text | Google Scholar
.