- Historisch perspectief op de chromatine-afhankelijke MT-assemblagepad
- Het nucleo-cytoplasmatisch transport en het kleine GTPase Ran
- De RanGTP-route tijdens celdeling
- Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
- Regulatie van het RanGTP Systeem tijdens Celdeling
- De rol van andere componenten van de nucleo-cytoplasmatische shuttling-machines tijdens Mitose
- Conservatie van de RanGTP pathway in delende cellen
- De RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
- Conclusies
- Bijdragen van de auteur
- Funding
- Conflict of Interest Statement
- Acknowledgments
- Afkortingen
Historisch perspectief op de chromatine-afhankelijke MT-assemblagepad
De eerste aanwijzingen voor het bestaan van een chromosoom-afhankelijk MT-assemblagemechanisme in de delende cel werden verkregen in de jaren 1970-1980, toen verschillende groepen rapporteerden dat MT-kernvorming plaatsvond in de buurt van of op de kinetochores (McGill en Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) en een spilachtige structuur werd gevormd rond lambda DNA geïnjecteerd in metafase gearresteerde Xenopus eieren (Karsenti et al., 1984). In 1996 werd aangetoond dat met DNA gecoate korrels bipolaire spindelvorming teweegbrachten wanneer ze geïncubeerd werden in ei-extracten van Xenopus (Heald et al., 1996), wat verdere ondersteuning gaf aan het idee dat chromatine alle informatie draagt die nodig is om MT-assemblage en -organisatie in het cytoplasma van de M-fase te sturen. Kort daarna zorgde de identificatie van het kleine Ran GTPase als motor van chromatine-afhankelijke MT assemblage in het M-fase cytoplasma voor een belangrijke doorbraak om het onderliggende mechanisme te begrijpen (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde en Zheng, 1999; Zhang et al., 1999). Vandaag weten we dat de chromosomen de MT assemblage en organisatie in een bipolaire spindel aansturen op een RanGTP afhankelijke manier in de meeste cellen (Karsenti en Vernos, 2001; Rieder, 2005).
In dit mini-review zullen we kort beschrijven hoe het RanGTP systeem de nucleo-cytoplasmatische shuttling van componenten in de interfase regelt en, na NEBD, de activiteit en/of lokalisatie van specifieke factoren om de spindel assemblage aan te sturen. We zullen een kort overzicht geven van onze huidige kennis over de identiteit en functie van RanGTP gereguleerde factoren en de recente vooruitgang in het begrijpen van nieuwe mechanismen gereguleerd door RanGTP. Tenslotte geven we een overzicht van de regulatie van de RanGTP pathway zelf tijdens mitose, het behoud ervan in verschillende organismen en celtypes, en de rol ervan in andere cellulaire functies. Voor aanvullende informatie verwijzen we de lezer naar uitstekende recensies (Ciciarello et al., 2007; O’Connell and Khodjakov, 2007; Clarke and Zhang, 2008; Kalab and Heald, 2008; Roscioli et al., 2010; Forbes et al., 2015).
Het nucleo-cytoplasmatisch transport en het kleine GTPase Ran
Eukaryote cellen zijn gecompartimenteerd en hebben specifieke transportsystemen voor de communicatie tussen het cytoplasma en de verschillende membraangebonden organellen. Het nucleo-cytoplasmatisch transportsysteem is essentieel om de transcriptie van het genoom, die in de kern plaatsvindt, functioneel te verbinden met de translatie van eiwitten, die in het cytoplasma plaatsvindt (Figuren 1A,B). Het transport van moleculen in en uit de kern gebeurt door het nucleair pore complex (NPC), een groot eiwitcomplex van ~60 MDa dat in het kernmembraan is ingebracht (Sorokin et al., 2007). Kleine ladingen (< 40 kDa) diffunderen snel door het NPC. In plaats daarvan vereisen eiwitten groter dan 40 kDa een actief transport door het NPC waarbij oplosbare nucleaire transportreceptoren (NTR’s) betrokken zijn die tot de karyopherine-β eiwitfamilie behoren. NTR’s die het transport van ladingseiwitten naar de kern vergemakkelijken, worden importines genoemd en interageren met hun lading via een nucleair lokalisatiesignaal (NLS) dat rijk is aan basische residuen. NTR’s die de uitvoer van eiwitten uit de celkern vergemakkelijken, worden exportins genoemd en werken met hun lading samen via een nucleair uitvoersignaal (NES) dat rijk is aan hydrofobe residuen zoals leucine. Het karyopherine-β importine β1 interageert vaak met de lading via een adaptor van de importine α familie (Sorokin et al., 2007). Importine α bindt direct aan de NLS van het ladingseiwit en aan importine β1 via een IBB-domein (importine β-bindend domein), wat leidt tot de vorming van een trimerisch complex.
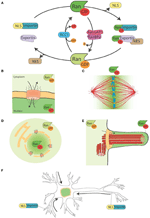
Figuur 1. Het Ran-systeem en zijn maanlichtfuncties. (A) Schematische voorstelling van het Ran-systeem voor de ruimtelijke controle van NLS- en NES-dragende eiwitten. In cellen komt Ran voor in twee vormen, RanGTP (groen), en RanGDP (lichtgroen). RCC1 (lichtblauw) bevordert de uitwisseling van GDP naar GTP, terwijl RanGAP1-RanBP2 (in roze en paars) de hydrolyse van GTP naar GDP bevorderen. RanGTP bindt aan de importins (turkooisgroen) en exportins (lichtpaars). Exportins in complex met RanGTP kunnen zich associëren met de NES-eiwitten (in bruin). Anderzijds veroorzaakt de binding van RanGTP aan importins hun dissociatie van de NLS-eiwitten (geel). (B) Tijdens de interfase controleert het Ran-systeem de nucleo-cytoplasmatische shuttling van eiwitten, omdat RanGTP overheerst in het nucleoplasma en RanGDP in het cytoplasma (Sorokin et al., 2007). (C) Tijdens de mitose bepaalt de associatie van RCC1, het RanGEF, met de chromosomen een gradiënt van RanGTP-concentraties die het vrijkomen van SAFs en MT-kernvorming rond het chromatine bevordert. Het Ran systeem wordt omgezet in een route voor MT assemblage en organisatie die essentieel is voor mitotische spindel assemblage. De RanGTP-route is afhankelijk van de totstandkoming van een concentratiegradiënt van RanGTP die pieken vertoont rond de chromosomen (Kalab et al., 2002; Caudron et al., 2005). (D) Aan het einde van de mitose regelt het Ran-systeem ook de nucleaire membraan- en NPC-assemblage door membraanfusie te regelen en NPC-componenten vrij te geven (Walther et al., 2003; Harel et al., 2003). (E) In gecilieerde cellen accumuleert RanGTP in het cilioplasma en bevordert het transport en de accumulatie van Kif17 en retinis pigmentosa 2 naar het cilioplasma (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) In neuronen hebben vele SAFs een functie. Bovendien lokaliseren importins naar de dendritische synaptische ruimte en zijn ze betrokken bij het transport van cargos naar de nucleus (Jordan en Kreutz, 2009; Panayotis et al., 2015). Het Ran-systeem is ook actief in het axon van de nervus ischiadicus, waar importines na verwonding het transport van cargos naar het neuroncellichaam bevorderen (Hanz et al., 2003; Yudin et al., 2008).
NTRs associëren met het kleine GTPase Ran dat fungeert als een moleculaire schakelaar. In zijn GTP-gebonden vorm interageert Ran (RanGTP) met hoge affiniteit met karyopherine-β-eiwitten, terwijl het dissocieert in zijn GDP-gebonden vorm (RanGDP). RanGTP binding aan importins en exportins heeft zeer verschillende gevolgen: het stabiliseert de exportin-cargo interactie terwijl het de importin-cargo interactie destabiliseert (Figuur 1A).
De RanGEF (guanine nucleotide exchange factor) RCC1 associeert met het chromatine in de kern, terwijl RanGAP (GTPase activating protein) cytoplasmatisch is. Dientengevolge is de overheersende vorm van Ran in de kern gebonden aan GTP, terwijl het in het cytoplasma gebonden is aan GDP. Daarbij worden NLS-eiwitten die door importines naar de kern worden getransporteerd, vrijgemaakt en accumuleren zij zich in het nucleoplasma, terwijl NES-eiwitten in complex met exportine-RanGTP uit de kern worden getransporteerd (figuren 1A,B).
Hoewel het nucleo-cytoplasmatisch transport niet langer nodig is wanneer een cel in mitose gaat, wordt zijn complexe moleculaire machinerie gerecycleerd om MT-assemblage rond het chromatine te bevorderen en de organisatie van de bipolaire spindel te sturen (Clarke en Zhang, 2008).
De RanGTP-route tijdens celdeling
Als RCC1 geassocieerd blijft met het chromatine na NEBD, is RanGTP sterk verrijkt in de nabijheid van de chromosomen. Als RanGTP diffundeert uit de buurt van het chromatine, RanGAP in het cytoplasma zet het in RanGDP (figuur 1C). De resulterende gradiënt is direct gevisualiseerd in cellen en Xenopus ei extracten (Kalab et al., 2002, 2006) en de eigenschappen in MT nucleatie en stabilisatie getest en gemodelleerd (Caudron et al., 2005). Net als in de interfase, biedt dit systeem een ruimtelijke controle over de stabiliteit van NTRs-cargo complexen. De cargos zijn NLS en/of NES-bevattende eiwitten met specifieke functies gerelateerd aan de assemblage en functie van de spindel. De NLS-eiwitten met een rol in de assemblage van de spoel zijn SAFs genoemd (Spindle Assembly Factors).
De ontdekking en karakterisering van de RanGTP pathway heeft geleid tot een heroverweging van het Search and Capture model voor de assemblage van de spoel dat in 1986 werd voorgesteld (Kirschner en Mitchison, 1986). Dit model stelt dat centrosomale MT’s groeien en krimpen terwijl ze de cytoplasmatische ruimte verkennen, totdat een stochastische ontmoeting met een kinetochore hun vangst en bevestiging bevordert. Inmiddels is echter duidelijk vastgesteld dat dierlijke cellen die experimenteel van hun centrosomen zijn beroofd, wel degelijk een functionele mitotische spindel assembleren (Debec et al., 1995; Khodjakov et al., 2000). Bovendien suggereerden wiskundige simulaties dat het Search and Capture mechanisme geen verklaring zou kunnen zijn voor de korte delingsduur die in de meeste dierlijke cellen wordt waargenomen (Wollman et al., 2005). Door MT-kernvorming en -stabilisatie in de nabijheid van de chromosomen te bevorderen, bevordert de RanGTP-route zeker het MT-vangst door de kinetochoren, waardoor de efficiëntie van het zoek- en vangmechanisme toeneemt. De rol van de RanGTP-route moet echter verder gaan dan MT-vangst door de kinetochores en vorming van kinetochore-vezels (K-vezels), omdat deze ook MT-organisatie bevordert in afwezigheid van chromosomen, kinetochores en K-vezels (Carazo-Salas et al., 1999). De identificatie van de directe en indirecte RanGTP targets in het M-fase cytoplasma is daarom een essentiële stap om de verschillende rollen die deze pathway vervult tijdens de celdeling volledig te begrijpen.
Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
Een directe uitlezing van de rol van RanGTP in het M-fase cytoplasma werd verkregen in Xenopus ei-extracten, verstoken van chromatine en centrosomen. Toevoeging van RanGTP aan deze extracten is inderdaad voldoende om MT nucleatie op gang te brengen, MT stabilisatie te bevorderen, en de organisatie van MT assemblages genaamd mini-spindels te induceren (Carazo-Salas et al., 1999, 2001). Daarom kunnen een of meer SAF’s betrokken zijn bij deze verschillende gebeurtenissen.
Sinds de identificatie van de eerste SAF’s in 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al, 2001; Clarke en Zhang, 2008; Meunier en Vernos, 2012), is het aantal door RanGTP gecontroleerde eiwitten in mitose langzaam gegroeid en zijn recentelijk verschillende nieuwe SAF’s geïdentificeerd (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier en Vernos, 2011; Samwer et al., 2013; Wilbur en Heald, 2013). Momenteel zijn 22 eiwitten gevalideerd als SAF’s (tabel 1). Bovendien zijn een aantal eiwitten met vastgestelde rollen in verschillende aspecten van spindelassemblage nucleair en zouden daarom doelwitten kunnen zijn voor RanGTP-regulatie (d.w.z. Kif4a/Klp1, Ino80, Reptin), maar verdere studies moeten deze mogelijkheid onderzoeken.

Tabel 1. Spindle assembly factors.
Interessant is dat de functionele karakterisering van sommige van de SAFs mechanistische inzichten verschaft in de functies van de RanGTP pathway in de delende cel. Het mechanisme waarmee RanGTP de MT nucleatie de novo in het M-fase cytoplasma bevordert werd onlangs beschreven (Scrofani et al., 2015). Door TPX2 los te maken van importins, bevordert RanGTP zijn interactie met Aurora A en met een RHAMM-NEDD1-γTURC (γTubulin Ring Complex) complex. In dit nieuwe complex fosforyleert de geactiveerde Aurora A NEDD1, een essentiële voorwaarde voor MT-kernvorming. Van een ander SAF, Mel28, werd aangetoond dat het interacteert met het γTuRC en er werd voorgesteld dat het een rol speelt in RanGTP-afhankelijke MT-kernvorming (Yokoyama et al., 2014). De mogelijke samenwerking van Mel28 met de hierboven beschreven TPX2-afhankelijke pathway moet nog worden vastgesteld.
De RanGTP pathway draagt ook bij aan centrosoom maturatie en zijn MT assemblage activiteit (Carazo-Salas et al., 2001). In feite werd aangetoond dat twee SAFs, CDK11 en Mel28, MT-assemblage aan het centrosoom bevorderen (Yokoyama et al., 2008, 2014).
De identificatie en karakterisering van een andere SAF, MCRS1, heeft een nieuw en belangrijk mechanisme onthuld voor de regulatie van K-fiber MT minus-end dynamica (Meunier en Vernos, 2011) en nieuwe inzichten in de rol van de RanGTP-route in spindelassemblage en celdeling (Meunier en Vernos, 2012). MCRS1, in complex met leden van de chromatine modifier KAT8-geassocieerd niet-specifiek dodelijk (KANSL) complex (Meunier et al., 2015), is gericht op het min-einde van RanGTP-afhankelijke MTs die hen beschermen tegen depolymerisatie. Binnen de spindel associeert MCRS1 ook specifiek met de min-einden van K-fiber MTs en reguleert hun depolymerisatiesnelheid, wat een essentiële rol speelt in de dynamiek van de K-fiber en de uitlijning van chromosomen (Meunier en Vernos, 2011; Meunier et al., 2015). De specifieke associatie van MCRS1 met de MT’s die door de RanGTP-afhankelijke route worden gekernen, suggereert ook dat deze MT’s specifieke kenmerken hebben die hen onderscheiden van de MT’s die door de centrosomen worden gekernen. Als dit waar blijkt te zijn, zouden de chromosomale MT’s niet slechts een lokale toevoer van MT’s zijn die een efficiënt Search and Capture mechanisme bevorderen, maar zij zouden essentiële unieke functionaliteiten kunnen leveren die nodig zijn voor de assemblage en functie van de bipolaire spindel (Meunier et al, 2015).
Recentelijk werd aangetoond dat de MT depolymeriserende kinesine Kif2a wordt gereguleerd door RanGTP in mitose, waarbij een belangrijk mechanisme werd onthuld voor het schalen van de spindel naar de celgrootte tijdens de vroege ontwikkeling van Xenopus embryo’s (Wilbur en Heald, 2013). Kif2a wordt inactief gehouden door importine α tot stadium 8 van de embryonale ontwikkeling. Wanneer de oplosbare concentratie van importine α afneemt, komt Kif2a vrij en functioneert als een MT-depolymerase die spindelverkorting bevordert.
Hoewel de meeste tot nu toe geïdentificeerde SAFs een rol bleken te spelen in de vroege fasen van celdeling, blijkt uit een aantal recente rapporten dat de RanGTP-route andere essentiële rollen heeft die niet direct verband houden met spindelassemblage. Inderdaad, de karakterisering van de SAF ISWI suggereert functies voor de RanGTP-route tijdens anafase (Yokoyama et al., 2009).
Meerdere lijnen van onderzoek wijzen er ook op dat het een rol speelt in de spindelpositionering. Vóór het begin van de anafase beperkt de RanGTP-gradiënt namelijk de lokalisatie van het LGN-NuMa-complex naar celcortexgebieden die verder van de chromosomen afliggen, wat bijdraagt aan de controle van de spindelpositie en -oriëntatie (Kiyomitsu en Cheeseman, 2012).
Daarnaast reguleert RanGTP ook niet-MT-gerelateerde doelen. Het controleert de Anillin-lokalisatie en zet asymmetrische membraanverlenging in gang tijdens de anafase, waardoor de spindelpositie in het midden van de delende cel wordt bepaald (Silverman-Gavrila et al., 2008; Kiyomitsu en Cheeseman, 2012). Ten slotte reguleert de RanGTP-route tijdens cytokinese de activiteit van de kinesine Kif14/Nabkin in actinebundeling (Carleton et al., 2006; Samwer et al., 2013) en coördineert de nucleaire membraan- en NPC-reassemblage (Harel et al., 2003; Walther et al., 2003; Ciciarello et al., 2010; Roscioli et al., 2010; Forbes et al., 2015; Figuur 1D).
Het is dus duidelijk dat de identificatie en functionele karakterisering van de RanGTP mitotische targets nieuwe inzichten verschaft in het mechanisme van spindelassemblage en celdeling. Het is echter onduidelijk of er nog veel of slechts enkele RanGTP targets moeten worden geïdentificeerd. Dit aantal zou potentieel hoog kunnen zijn aangezien het aantal nucleaire eiwitten in de orde van honderden of duizenden ligt (Dellaire et al., 2003), minstens een orde van grootte boven het huidige aantal bekende RanGTP targets in de delende cel (Tabel 1).
De meeste proteomische studies gericht op het identificeren van nieuwe SAFs hebben zich geconcentreerd op importins α1 en β1 (Nachury et al., 2001; Wiese et al., 2001; Yokoyama et al., 2008), die twee van de meest overvloedige importins in Xenopus-ei-extracten zijn (Bernis et al., 2014; Wuhr et al., 2014). Er zijn echter vijf extra α-importins en acht extra β-importins bij de mens (Cautain et al., 2015).
Hoewel nog schaars, wijzen sommige gegevens erop dat inderdaad ook andere importins een rol spelen tijdens de celdeling. Zo werd aangetoond dat de RanGTP-regulatie van NuSAP afhankelijk is van importin-β1 en importin-7 (Ribbeck et al., 2006) en die van Mel28, Nup107-160, en Nup98 van importin-β1 en transportin/importin-β2 (Lau et al., 2009). Transportine bleek ook specifiek de spindelassemblage en de nucleaire membraan- en NPC-assemblage negatief te reguleren (Bernis et al., 2014). Er zijn echter geen beschreven mitotische factoren die exclusief worden gereguleerd door importin-7 of transportin.
De karakterisering van mogelijke transportin specifieke doelen en, meer in het algemeen, van de andere importins α en β vertegenwoordigt een open veld voor exploratie. Dit zou belangrijk kunnen zijn om de regulatie van de RanGTP pathway te begrijpen, vooral gezien het feit dat importins expressiepatronen aanzienlijk veranderen in verschillende ontwikkelingsstadia en weefsels (Hosokawa et al., 2008).
Regulatie van het RanGTP Systeem tijdens Celdeling
Naast de specificiteiten van NTR-SAF interacties, kunnen verschillende mechanismen rechtstreeks van invloed zijn op de RanGTP pathway tijdens celdeling. Verschillende gegevens suggereren dat RCC1 zelf een sleutelcomponent is onder fijne regulatie. Menselijke cellen hebben drie isovormen van RCC1, die op een weefselspecifieke manier tot expressie komen (Hood en Clarke, 2007). De isovormen verschillen in hun N-terminus, een regio die betrokken is bij de binding van importine en die wordt gereguleerd door fosforylering, waarvan werd voorgesteld dat ze de chromosoomgekoppelde RanGTP-productie beïnvloedt (Hood en Clarke, 2007; Li et al., 2007). Bovendien varieert het niveau van RCC1-expressie ook in verschillende cellen en correleert dit met de steilheid van de RanGTP-gradiënt (Hasegawa et al., 2013). Dit kan belangrijke gevolgen hebben, aangezien werd voorgesteld dat de steilheid van de RanGTP gradiënt de lengte van de prometafase en metafase bepaalt, die op hun beurt relevant kunnen zijn voor de trouwheid van de chromosoomsegregatie (Silkworth et al., 2012; Hasegawa et al., 2013).
Andere mechanismen, zoals post-translationele modificaties en alternatieve splicing zijn ook potentiële strategieën om het NLS van SAFs te controleren. Deze mechanismen zouden echter eerder een bepaald eiwit beïnvloeden dan de hele RanGTP pathway.
Recentelijk werd een alternatief mechanisme voor de regulering van SAFs onafhankelijk van RanGTP voorgesteld. De targeting van het Golgi-eiwit GM130 op gefragmenteerde Golgi-membranen in mitose kan lokaal TPX2 uit de importin α1-binding concurreren, waardoor MT-assemblage in de nabijheid van Golgi-fragmenten wordt bevorderd (Wei et al., 2015). Dit op competitie gebaseerde mechanisme zou een andere strategie kunnen zijn om SAFs die door importins worden vastgelegd, lokaal te controleren.
De rol van andere componenten van de nucleo-cytoplasmatische shuttling-machines tijdens Mitose
De binding van RanGTP aan exportins stabiliseert zijn interactie met NES-cargo-eiwitten. Het belangrijkste exportine, CRM1, bleek betrokken te zijn bij de targeting van NES-eiwitten naar de kinetochore of de centrosomen. Aan de kinetochore rekruteert CRM1 het RanBP2-RanGAP1-SUMO complex dat nodig is voor de interactie tussen MTs en de kinetochore (Arnaoutov et al., 2005). Het is echter mechanistisch nog onduidelijk hoe dit complex de MT-kinetochore interactie bevordert (Forbes et al., 2015). CRM1 bevordert ook de rekrutering van RanGAP1-RanBP2 naar de spindel op een RanGTP-afhankelijke manier (Wu et al., 2013) en het is betrokken bij het vastbinden van het Chromosome Passenger Complex aan het centromeer door zijn directe interactie met survivin (Knauer et al., 2006). Van CRM1 is ook aangetoond dat het de rekrutering van BRCA1 en pericentrine aan de mitotische centrosomen bevordert, waardoor de MT-assemblageactiviteit van de centrosomen wordt gestimuleerd (Liu et al., 2009; Brodie en Henderson, 2012). Onlangs werd ontdekt dat de transcriptionele repressor Bach1 een rol speelt in de uitlijning van chromosoomarmen tijdens mitose en tijdens de metafase op een CRM1-afhankelijke manier van de chromosomen wordt uitgesloten (Li et al., 2012).
Het belang van deze targeting-gebeurtenissen is echter mechanistisch niet helemaal duidelijk (Yokoyama en Gruss, 2013). Een groot probleem is dat tijdens mitose de vermeende rol van export gemedieerde interacties moeilijk te ontwarren kan zijn van die van import gemedieerde interacties, omdat er eiwitten bij betrokken zijn die zowel NES als NLS hebben. Niettemin lijkt het duidelijk dat de RanGTP regulatie van CRM1 verschillende rollen heeft tijdens mitose en het zal interessant zijn om te testen of andere exportins ook belangrijk zijn voor mitotische gebeurtenissen.
Conservatie van de RanGTP pathway in delende cellen
In de laatste 15 jaar is de RanGTP pathway bestudeerd in verschillende organismen en celtypes. Het bleek dat het op sommige details variaties vertoonde of in sommige gevallen overbodig was. In sommige meiotische systemen blijkt de bijdrage van de RanGTP pathway inderdaad niet-essentieel te zijn. Zo kunnen Drosophila spermatocyten de meiosis I spindel assembleren in de volledige afwezigheid van chromosomen (Bucciarelli et al., 2003). De assemblage van de acentrosomale spindel van meiose I in muizen en kikkeroöcyten bleek ook slechts gedeeltelijk afhankelijk te zijn van de RanGTP-route, hoewel de route strikt essentieel is voor de assemblage van de spindel tijdens meiose II (Dumont et al., 2007).
Zelfs in systemen die afhankelijk zijn van RanGTP voor de assemblage van de spindel zijn er enkele variaties, althans op het niveau van de machinerie. TPX2 bijvoorbeeld, dat essentieel is in kikkers en zoogdieren, is niet aanwezig in Caenorhabditis elegans en Drosophila melanogaster. Hoewel in deze systemen eiwitten met enkele kenmerken van TPX2 zijn geïdentificeerd (Ozlu et al., 2005; Goshima, 2011), missen ze essentiële kenmerken van TPX2, zoals een NLS dat aan de basis ligt van de RanGTP-regulatie. Dit voorbeeld geeft aan dat de effectoren van de RanGTP pathway van systeem tot systeem kunnen verschillen, hoewel de belangrijkste principes waarschijnlijk gehandhaafd en geconserveerd zijn.
De RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
De RanGTP pathway is een voorbeeld van een hele pathway die essentiële functies vervult in verschillende delen van de celcyclus. In de interfase orkestreert het het nucleo-cytoplasmatisch transport, terwijl het in mitose de spindelassemblage en later het kernmembraan en de NPC-assemblage aanstuurt (Figuren 1B-D). Individuele proteïnen die op verschillende tijdstippen verschillende functies hebben, worden omschreven als moonlighting proteïnen (Jeffery, 1999). De RanGTP pathway zou daarom een voorbeeld kunnen zijn van een moonlighting pathway.
De RanGTP pathway is bijzonder interessant, omdat het laat zien hoe de functie van een eiwit afhangt van zijn context: de meeste SAFs hebben nucleaire functies en worden gescheiden gehouden van tubulines en andere cytoskelet-eiwitten tijdens de interfase. Bij NEBD verandert de algemene context en oefenen de SAFs belangrijke functies uit die gerelateerd zijn aan de MTs.
Sommige gegevens wijzen in de richting van een bijverlichte functie van de RanGTP-route bij ciliavorming en bij het transport in het cilium. Er is aangetoond dat RanGTP de accumulatie van Kif17 en retinis pigmentosa 2 naar het ciliumtoplasma controleert (Dishinger et al., 2010; Hurd et al., 2011), waar RanGTP geconcentreerd is (Fan et al., 2011). Het huidige werkmodel is dat de RanGTP-route het transport orkestreert van ladingen met een cilia-lokalisatiesignaal door het cilia pore complex, waarvan is voorgesteld dat het zich aan de basis van het cilium bevindt (Kee et al., 2012; Figuur 1E). Verdere studies zijn echter nodig om te begrijpen hoe de RanGTP gradiënt tot stand komt in cilia en welke andere cargos het transporteert in de cilia.
Interessant is dat de RanGTP pathway ook in gedifferentieerde neuronen, waar veel SAFs ook een functie hebben, een maanlicht schijnt. Verder accumuleren importins α en β in de dendritische synaptische ruimte en hebben een rol in het transport van cargos van de synapsen naar de kern (Jordan en Kreutz, 2009; Panayotis et al., 2015). Ten slotte is aangetoond dat een RanGTP gereguleerd mechanisme een rol speelt in reactie op letsels aan de heupzenuw (Hanz et al., 2003; Yudin et al., 2008; Figuur 1F).
Conclusies
De identificatie van de rol die de RanGTP-route speelt tijdens de celdeling vond meer dan 15 jaar geleden plaats. We weten nu dat de RanGTP pathway bijkomende functies heeft en kan beschouwd worden als een zwartwerkende pathway die verschillende belangrijke cellulaire processen controleert (Figuur 1). Tijdens de celdeling stuurt hij essentiële mechanismen aan die we beginnen te begrijpen dankzij de identificatie en functionele karakterisering van zijn directe doelwitten. Verschillende open vragen moeten echter nog worden beantwoord. Het totale aantal SAF’s is moeilijk te voorspellen en wij weten dan ook niet hoeveel er nog moeten worden geïdentificeerd. Bovendien is het grootste deel van onze huidige kennis beperkt tot de rol van slechts enkele componenten van de nucleo-cytoplasmatische transportmachinerie. Zo is er momenteel zeer weinig bekend over de vermeende rol bij de celdeling van de verschillende importins die in de menselijke cel aanwezig zijn. Specifieke importines kunnen de activiteit van nieuwe SAFs reguleren en hun verschillende expressiepatronen in verschillende celtypes en weefsels kunnen een relevant combinatorisch mechanisme opleveren. We weten ook weinig over de vermeende rol van de componenten van de exportmachine in de assemblage van de spoel en in de andere nieuwe functies van de route. Hoewel er gegevens zijn die wijzen op verschillende punten van regulatie van de route zelf, zijn de gevolgen voor de celdeling en andere processen nog niet duidelijk, noch hoe de route kan worden aangepast aan de eisen van verschillende celtypes of weefsels. De studie van de RanGTP pathway zal in de komende jaren zeker opwindende nieuwe inzichten opleveren, waarbij enkele essentiële mechanismen voor celorganisatie en -functie aan het licht zullen komen.
Bijdragen van de auteur
IV en TC schreven het manuscript, TC stelde de tabel en figuur op.
Funding
TC werd gesteund door het Spaanse Ministerie van Economie en Concurrentievermogen (MINECO) via de FPI-beurs BES-2010-031355. Het werk in het Vernos lab werd ondersteund door de Spaanse ministeriële subsidies BFU2009-10202 en BFU2012-37163, medegefinancierd door het Europees Fonds voor Regionale Ontwikkeling (EFRO/FEDER). We erkennen ook de steun van het Spaanse ministerie van Economie en Concurrentievermogen, “Centro de Excelencia Severo Ochoa 2013-2017,” SEV-2012-0208.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
We willen de leden van Vernos lab bedanken voor kritische discussies over de verschillende aspecten van de RanGTP pathway.
Afkortingen
γTuRC, γTubulin Ring Complex; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-geassocieerd niet-specifiek dodelijk complex; MT, Microtubule; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Nucleair Lokaliseringssignaal; NPC, Nucleair Porie Complex; NTR, Nucleair Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Rol van importin-beta in de koppeling van Ran aan stroomafwaartse doelen bij de assemblage van microtubuli. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar