- Historisk perspektiv på den kromatinafhængige MT-monteringsvej
- Den nukleo-cytoplasmatiske transport og den lille GTPase Ran
- RanGTP-vejen under celledeling
- Forståelse af RanGTP-vejen gennem identifikation og funktionel karakterisering af dens mål
- Regulering af RanGTP-systemet under celledeling
- Rollen af andre komponenter i det nukleo-cytoplasmatiske shuttling-maskineri under mitose
- Konservering af RanGTP-vejen i delende celler
- RanGTP-vejen: RanGTP-banen: En måneskinsbane med en rolle i flere cellulære funktioner
- Konklusioner
- Author Contributions
- Funding
- Interessekonflikterklæring
- Anerkendelser
- Abkortelser
Historisk perspektiv på den kromatinafhængige MT-monteringsvej
De første antydninger om eksistensen af en kromosomafhængig MT-monteringsmekanisme i den delende celle blev opnået i 1970-1980’erne, da flere grupper rapporterede, at MT-kernedannelsen fandt sted tæt på eller ved kinetokorerne (McGill og Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981), og der blev dannet en spindellignende struktur omkring lambda-DNA, der blev sprøjtet ind i metafasearrestede Xenopus-æg (Karsenti et al., 1984). I 1996 blev det vist, at DNA-belagte perler udløste bipolær spindeldannelse, når de blev inkuberet i Xenopus-ægekstrakter (Heald et al., 1996), hvilket giver yderligere støtte til ideen om, at kromatin bærer al den information, der er nødvendig for at styre MT-samlingen og organiseringen i M-fase-cytoplasmaet. Kort efter gav identifikationen af den lille Ran GTPase som drivkraft for kromatinafhængig MT-samling i M-fase cytoplasmaet et stort gennembrud for forståelsen af den underliggende mekanisme (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde og Zheng, 1999; Zhang et al., 1999). I dag ved vi, at kromosomerne styrer MT-samlingen og organiseringen til en bipolær spindel på en RanGTP-afhængig måde i de fleste celler (Karsenti og Vernos, 2001; Rieder, 2005).
I denne mini-review vil vi kort beskrive, hvordan RanGTP-systemet regulerer den nukleo-cytoplasmatiske shuttling af komponenter i interfasen og, efter NEBD, aktiviteten og/eller lokaliseringen af specifikke faktorer for at styre spindelsamlingen. Vi vil kort gennemgå vores nuværende viden om identiteten og funktionen af RanGTP-regulerede faktorer og de seneste fremskridt med hensyn til at forstå nye mekanismer, der reguleres af RanGTP. Endelig vil vi give et overblik over reguleringen af selve RanGTP-vejen under mitose, dens bevarelse i forskellige organismer og celletyper og dens rolle i andre cellulære funktioner. For yderligere oplysninger henviser vi læseren til fremragende oversigter (Ciciarello et al., 2007; O’Connell og Khodjakov, 2007; Clarke og Zhang, 2008; Kalab og Heald, 2008; Roscioli et al., 2010; Forbes et al., 2015).
Den nukleo-cytoplasmatiske transport og den lille GTPase Ran
Eukaryote celler er kompartmentaliserede og har specifikke transportsystemer til kommunikation mellem cytoplasmaet og de forskellige membranbundne organeller. Det nukleo-cytoplasmatiske transportsystem er afgørende for den funktionelle forbindelse mellem den transkription af genomet, der finder sted i kernen, og den proteinoversættelse, der finder sted i cytoplasmaet (figur 1A, B). Transporten af molekyler ind og ud af kernen sker gennem det nukleare porekompleks (NPC), et stort proteinkompleks på ~60 MDa, der er indsat i kernemembranen (Sorokin et al., 2007). Små cargos (< 40 kDa) diffunderer hurtigt gennem NPC. I stedet kræver proteiner, der er større end 40 kDa, en aktiv transport gennem NPC’en, der involverer opløselige nukleare transportreceptorer (NTR’er), der tilhører karyopherin-β-proteinfamilien. NTR’er, der letter transporten af lastproteiner ind i kernen, kaldes importiner og interagerer med deres last gennem et nukleart lokaliseringssignal (NLS), der er rigt på basiske rester. NTR’er, der letter eksporten af proteiner ud af kernen, kaldes eksportiner og interagerer med deres last gennem et nukleært eksportsignal (NES), der er rig på hydrofobiske rester som f.eks. leucin. Karyopherin-β-importin β1 interagerer ofte med lasten gennem en adaptor af importin α-familien (Sorokin et al., 2007). Importin α binder direkte til lastproteinets NLS og til importin β1 gennem et IBB-domæne (importin β-bindingsdomæne), hvilket fører til dannelse af et trimerisk kompleks.
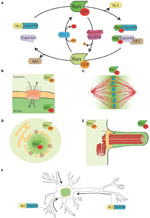
Figur 1. Ran-systemet og dets måneskinsfunktioner. (A) Skematisk fremstilling af Ran-systemet til rumlig kontrol af NLS og NES-bærende proteiner. I celler findes Ran i to former, RanGTP (grøn) og RanGDP (lysegrøn). RCC1 (lyseblå) fremmer udvekslingen af GDP til GTP, mens RanGAP1-RanBP2 (lyserød og lilla) fremmer hydrolysen af GTP til GDP. RanGTP binder sig til importinerne (turkisgrøn) og eksportinerne (lyslilla). Eksportiner i kompleks med RanGTP kan knytte sig til NES-proteinerne (i brun farve). På den anden side udløser bindingen af RanGTP til importinerne deres dissociation fra NLS-proteinerne (gul). (B) Under interfasen kontrollerer Ran-systemet den nukleo-cytoplasmatiske shuttling af proteiner, fordi RanGTP er fremherskende i nucleoplasmaet og RanGDP er fremherskende i cytoplasmaet (Sorokin et al., 2007). (C) Under mitose definerer associeringen af RCC1, RanGEF’en, med kromosomerne en gradient af RanGTP-koncentrationer, der fremmer frigivelsen af SAF’er og MT-nukleation omkring kromatinet. Ran-systemet omdannes til en vej til samling og organisering af MT’er, som er afgørende for mitotisk spindelsamling. RanGTP-vejen afhænger af etableringen af en koncentrationsgradient af RanGTP, der topper omkring kromosomerne (Kalab et al., 2002; Caudron et al., 2005). (D) I slutningen af mitosen regulerer Ran-systemet også kernemembranen og NPC-genopbygningen ved at kontrollere membranfusionen og frigive NPC-komponenter (Walther et al., 2003; Harel et al., 2003). (E) I cilierede celler akkumuleres RanGTP i cilioplasmaet og fremmer transport og akkumulering af Kif17 og retinis pigmentosa 2 til cilioplasmaet (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) I neuroner har mange SAF’er en funktion. Desuden lokaliseres importiner til det dendritiske synaptiske rum og er involveret i transporten af cargos til kernen (Jordan og Kreutz, 2009; Panayotis et al., 2015). Ran-systemet er også aktivt i iskiasnervens axon, hvor importiner ved skade fremmer transporten af cargos mod neuronets cellekrop (Hanz et al., 2003; Yudin et al., 2008).
NTR’er associeres med den lille GTPase Ran, der fungerer som en molekylær switch. I sin GTP-bundne form interagerer Ran (RanGTP) med karyopherin-β-proteiner med høj affinitet, mens den dissocierer i sin GDP-bundne form (RanGDP). RanGTP-binding til importiner og eksportiner har meget forskellige konsekvenser: den stabiliserer eksportin-ladningsinteraktionen, mens den destabiliserer importin-ladningsinteraktionen (figur 1A).
RanGEF (guaninnukleotidudvekslingsfaktor) RCC1 associerer med kromatinet inde i kernen, mens RanGAP (GTPase-aktiverende protein) er cytoplasmatisk. Som følge heraf er den fremherskende form af Ran i kernen bundet til GTP, mens den i cytoplasmaet er bundet til GDP. Derved frigøres NLS-proteiner, der transporteres til kernen af importiner, og ophobes i nukleoplasmaet, mens NES-proteiner i kompleks med eksportin-RanGTP transporteres ud af kernen (figur 1A,B).
Og selv om den nukleo-cytoplasmatiske transport ikke længere er nødvendig, når en celle går ind i mitose, genbruges dens komplekse molekylære maskineri for at fremme MT-samlingen omkring kromatinet og for at styre organiseringen af den bipolære spindel (Clarke og Zhang, 2008).
RanGTP-vejen under celledeling
Da RCC1 forbliver associeret med kromatinet efter NEBD, er RanGTP stærkt beriget i nærheden af kromosomerne. Efterhånden som RanGTP diffunderer væk fra kromatinet, omdanner RanGAP i cytoplasmaet det til RanGDP (figur 1C). Den resulterende gradient er blevet direkte visualiseret i celler og Xenopus-ægekstrakter (Kalab et al., 2002, 2006), og dens egenskaber i MT-nukleation og -stabilisering er blevet testet og modelleret (Caudron et al., 2005). Ligesom i interfasen giver dette system en rumlig kontrol over stabiliteten af NTR’er-ladningskomplekser. Lasterne er NLS og/eller NES-holdige proteiner med specifikke funktioner i forbindelse med spindelsamling og -funktion. NLS-proteinerne med en rolle i spindelsammensætningen er blevet kaldt SAF’er (Spindle Assembly Factors).
Fundet og karakteriseringen af RanGTP-banen gav anledning til en fornyet gennemgang af den Search and Capture-model for spindelsammensætning, der blev foreslået i 1986 (Kirschner og Mitchison, 1986). Denne model postulerer, at centrosomale MT’er vokser og krymper og udforsker det cytoplasmatiske rum, indtil et stokastisk møde med en kinetochore fremmer deres indfangning og fastgørelse. Det er imidlertid nu klart blevet fastslået, at dyreceller, der eksperimentelt er blevet frataget deres centrosomer, samler en funktionel mitotisk spindel (Debec et al., 1995; Khodjakov et al., 2000). Desuden tyder matematiske simuleringer på, at Search and Capture-mekanismen ikke kan forklare den korte delingstid, der er observeret i de fleste dyreceller (Wollman et al., 2005). Ved at fremme MT-kernedannelse og stabilisering i nærheden af kromosomerne begunstiger RanGTP-vejen helt sikkert MT-fangst af kinetokorerne, hvilket øger effektiviteten af Search and Capture-mekanismen. RanGTP-vejens rolle må imidlertid gå ud over MT-fangst ved kinetokorerne og dannelse af kinetokor-fibre (K-fibre), da den også fremmer MT-organisering i fravær af kromosomer, kinetokorer og K-fibre (Carazo-Salas et al., 1999). Identifikationen af de direkte og indirekte RanGTP-mål i M-fase cytoplasmaet er derfor et vigtigt skridt for fuldt ud at forstå de forskellige roller, som denne vej udfylder under celledeling.
Forståelse af RanGTP-vejen gennem identifikation og funktionel karakterisering af dens mål
En direkte aflæsning af RanGTP’s rolle i M-fase cytoplasmaet blev opnået i Xenopus ægudtræk uden kromatin og centrosomer. Tilføjelse af RanGTP til disse ekstrakter er faktisk tilstrækkelig til at udløse MT-kernedannelse, fremme MT-stabilisering og inducere organiseringen af MT-samlinger kaldet mini-spindler (Carazo-Salas et al., 1999, 2001). Derfor kan en eller flere SAF’er være involveret i disse forskellige hændelser.
Siden identifikationen af de første SAF’er i 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al., 2001; Clarke og Zhang, 2008; Meunier og Vernos, 2012), er antallet af proteiner, der kontrolleres af RanGTP i mitose, langsomt vokset, og flere nye SAF’er blev for nylig identificeret (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier og Vernos, 2011; Samwer et al., 2013; Wilbur og Heald, 2013). I øjeblikket er 22 proteiner blevet valideret som SAF’er (tabel 1). Derudover er en række proteiner med etablerede roller i forskellige aspekter af spindelmontering nukleare og kunne derfor være mål for RanGTP-regulering (dvs. Kif4a/Klp1, Ino80, Reptin), men yderligere undersøgelser bør behandle denne mulighed.

Tabel 1. Spindle assembly factors.
Interessant nok giver den funktionelle karakterisering af nogle af SAF’erne mekanistisk indsigt i RanGTP-vejens funktioner i den delende celle. Den mekanisme, hvormed RanGTP fremmer MT-nukleation de novo i M-fase cytoplasmaet, blev for nylig beskrevet (Scrofani et al., 2015). Ved at frigøre TPX2 fra importiner fremmer RanGTP dets interaktion med Aurora A og med et RHAMM-NEDD1-γTURC (γTubulin Ring Complex)-kompleks. I dette nye kompleks fosforylerer den aktiverede Aurora A NEDD1, hvilket er en væsentlig forudsætning for MT-nukleation. En anden SAF, Mel28, blev vist at interagere med γTuRC, og det blev foreslået at spille en rolle i RanGTP-afhængig MT-nukleation (Yokoyama et al., 2014). Det potentielle samarbejde mellem Mel28 og den TPX2-afhængige vej, der er beskrevet ovenfor, mangler stadig at blive fastslået.
RanGTP-banen bidrager også til centrosommodning og dens MT-samlingsaktivitet (Carazo-Salas et al., 2001). Faktisk blev det vist, at to SAF’er, CDK11 og Mel28, favoriserer MT-samlingen ved centrosomet (Yokoyama et al., 2008, 2014).
Identificeringen og karakteriseringen af en anden SAF, MCRS1, har afsløret en ny og vigtig mekanisme til regulering af K-fiber MT minus-end-dynamikken (Meunier og Vernos, 2011) og ny indsigt i RanGTP-vejens roller i spindelsamling og celledeling (Meunier og Vernos, 2012). MCRS1, i kompleks med medlemmer af kromatinmodifikator KAT8-associeret ikke-specifik dødelig (KANSL) komplekset (Meunier et al., 2015), er målrettet mod minus-enden af RanGTP-afhængige MT’er, der beskytter dem mod depolymerisering. Inden for spindlen associerer MCRS1 også specifikt med minus-enderne af K-fiber MT’er og regulerer deres depolymeriseringshastighed, der spiller en væsentlig rolle i K-fiberdynamikken og kromosomjustering (Meunier og Vernos, 2011; Meunier et al., 2015). Den specifikke tilknytning af MCRS1 til de MT’er, der er nukleeret af den RanGTP-afhængige vej, tyder også på, at disse MT’er har specifikke egenskaber, der adskiller dem fra de MT’er, der er nukleeret af centrosomerne. Hvis dette viser sig at være sandt, ville de kromosomale MT’er ikke blot være en lokal forsyning af MT’er, der begunstiger en effektiv Search and Capture-mekanisme, men de kunne levere væsentlige unikke funktionaliteter, der er nødvendige for samling og funktion af den bipolære spindel (Meunier et al, 2015).
Den MT depolymeriserende kinesin Kif2a blev for nylig vist at blive reguleret af RanGTP i mitose, hvilket afslørede en vigtig mekanisme for skalering af spindlen til cellestørrelsen under den tidlige udvikling af Xenopus-embryoner (Wilbur og Heald, 2013). Kif2a holdes inaktiv af importin α indtil stadie 8 af embryonaludviklingen. Når den opløselige koncentration af importin α falder, frigøres Kif2a og fungerer som en MT-depolymerase, der fremmer spindelforkortning.
Og selv om de fleste af de SAF’er, der hidtil er identificeret, har vist sig at spille en rolle i de tidlige faser af celledelingen, tyder en række nyere rapporter på, at RanGTP-vejen har andre vigtige roller, der ikke er direkte relateret til spindelsammensætningen. Faktisk tyder karakteriseringen af SAF ISWI på funktioner for RanGTP-vejen under anafase (Yokoyama et al., 2009).
Flere forskningslinjer tyder også på, at den spiller en rolle i spindelpositionering. Før indtræden i anafase begrænser RanGTP-gradienten faktisk lokaliseringen af LGN-NuMa-komplekset til cellecortexområder længere væk fra kromosomerne, hvilket bidrager til kontrollen af spindelposition og -orientering (Kiyomitsu og Cheeseman, 2012).
Dertil kommer, at RanGTP også regulerer ikke-MT-relaterede mål. Faktisk kontrollerer det Anillin lokalisering og udløser asymmetrisk membranforlængelse under anafase, hvilket definerer spindelpositionering i midten af den delende celle (Silverman-Gavrila et al., 2008; Kiyomitsu og Cheeseman, 2012). Endelig regulerer RanGTP-vejen under cytokinese kinesin Kif14/Nabkin’s aktivitet i aktinbundtning (Carleton et al., 2006; Samwer et al., 2013) og koordinerer kernemembranen og NPC-reassemblering (Harel et al., 2003; Walther et al., 2003; Ciciarello et al., 2010; Roscioli et al., 2010; Forbes et al., 2015; Figur 1D).
Det er derfor klart, at identifikationen og den funktionelle karakterisering af RanGTP’s mitotiske mål giver ny indsigt i mekanismen for spindelsamling og celledeling. Det er imidlertid uklart, om der stadig mangler at blive identificeret mange eller kun få flere RanGTP-mål. Dette antal kan være potentielt højt, da antallet af nukleare proteiner er i størrelsesordenen hundreder eller tusinder (Dellaire et al., 2003), mindst en størrelsesorden over det nuværende antal kendte RanGTP-mål i den delende celle (tabel 1).
De fleste proteomiske undersøgelser, der har til formål at identificere nye SAF’er, har fokuseret på importiner α1 og β1 (Nachury et al, 2001; Wiese et al., 2001; Yokoyama et al., 2008), som er to af de hyppigst forekommende importiner i Xenopus-ægekstrakter (Bernis et al., 2014; Wuhr et al., 2014). Der findes imidlertid fem yderligere α-importiner og otte yderligere β-importiner i mennesker (Cautain et al., 2015).
Men selv om det stadig er sparsomt, tyder nogle data på, at faktisk andre importiner også spiller en rolle under celledeling. Det blev vist, at RanGTP-reguleringen af NuSAP afhænger af importin-β1 og importin-7 (Ribbeck et al., 2006), og at Mel28, Nup107-160 og Nup98 afhænger af importin-β1 og transportin/importin-β2 (Lau et al., 2009). Transportin blev også specifikt vist at regulere spindelsamling og nukleær membran- og NPC-genopbygning negativt (Bernis et al., 2014). Der er imidlertid ingen beskrevne mitotiske faktorer, der udelukkende reguleres af importin-7 eller transportin.
Karakteriseringen af mulige transportin-specifikke mål og mere generelt af de andre importiner α og β udgør et åbent felt for udforskning. Dette kunne være vigtigt for at forstå reguleringen af RanGTP-vejen, især i betragtning af, at importinernes ekspressionsmønstre ændrer sig betydeligt i forskellige udviklingsstadier og væv (Hosokawa et al., 2008).
Regulering af RanGTP-systemet under celledeling
Bortset fra NTR-SAF-interaktionernes specificiteter kan flere mekanismer direkte påvirke RanGTP-vejen under celledeling. Flere data tyder på, at RCC1 selv er en nøglekomponent under finregulering. Menneskelige celler har tre isoformer af RCC1, som udtrykkes på en vævsspecifik måde (Hood og Clarke, 2007). Isoformerne adskiller sig ved deres N-terminus, et område, der er involveret i importinbinding og reguleres ved fosforylering, som blev foreslået at påvirke den kromosomkoblede RanGTP-produktion (Hood og Clarke, 2007; Li et al., 2007). Desuden varierer niveauet af RCC1-ekspression også i forskellige celler og korrelerer med stejlheden af RanGTP-gradienten (Hasegawa et al., 2013). Dette kan have vigtige konsekvenser, da det blev foreslået, at stejlheden af RanGTP-gradienten bestemmer længden af prometafase og metafase, som igen kan være relevant for kromosomers segregeringstrofasthed (Silkworth et al., 2012; Hasegawa et al., 2013).
Andre mekanismer, såsom posttranslationelle modifikationer og alternativ splejsning, er også potentielle strategier til at kontrollere NLS af SAF’er. Disse mekanismer ville imidlertid snarere påvirke et bestemt protein end hele RanGTP-banen.
For nylig blev der foreslået en alternativ mekanisme til regulering af SAF’er uafhængigt af RanGTP. Målretning af Golgi-proteinet GM130 til fragmenterede Golgimembraner i mitose kan lokalt udkonkurrere TPX2 fra importin α1-bindingen og dermed favorisere MT-samlingen i nærheden af Golgi-fragmenter (Wei et al., 2015). Denne konkurrencebaserede mekanisme kunne være en anden strategi til lokal kontrol af SAF’er, der er sequesteret af importiner.
Rollen af andre komponenter i det nukleo-cytoplasmatiske shuttling-maskineri under mitose
Bindingen af RanGTP til eksportiner stabiliserer dets interaktion med NES-fragtproteiner. Den vigtigste eksportin, CRM1, blev vist at være involveret i målretning af NES-proteiner til kinetochoren eller centrosomerne. Ved kinetochoren rekrutterer CRM1 RanBP2-RanGAP1-SUMO-komplekset, som er nødvendigt for interaktionen mellem MT’er og kinetochoren (Arnaoutov et al., 2005). Det er dog stadig mekanistisk uklart, hvordan dette kompleks begunstiger MT-kinetochore-interaktionen (Forbes et al., 2015). CRM1 fremmer også rekruttering af RanGAP1-RanBP2 til spindlen på en RanGTP-afhængig måde (Wu et al., 2013), og det er involveret i fastgørelse af Chromosome Passenger Complex til centromeren gennem dets direkte interaktion med survivin (Knauer et al., 2006). CRM1 har også vist sig at fremme rekrutteringen af BRCA1 og pericentrin til de mitotiske centrosomer og dermed fremme MT-samlingsaktiviteten af centrosomerne (Liu et al., 2009; Brodie og Henderson, 2012). For nylig blev det konstateret, at den transkriptionelle repressor Bach1 spiller en rolle i kromosomparmenes armjustering under mitose og udelukkes fra kromosomerne under metafase på en CRM1-afhængig måde (Li et al., 2012).
Den betydning af disse målrettede begivenheder er imidlertid ikke helt klar mekanistisk set (Yokoyama og Gruss, 2013). Et stort problem er, at under mitose kan den formodede rolle af eksportinformidlede interaktioner være vanskelig at adskille fra importinformidlede interaktioner, da de involverer proteiner, der har både NES og NLS . Ikke desto mindre synes det indlysende, at RanGTP-reguleringen af CRM1 har flere roller under mitose, og det vil være interessant at teste, om andre eksportiner også er vigtige for mitotiske hændelser.
Konservering af RanGTP-vejen i delende celler
I de sidste 15 år er RanGTP-vejen blevet undersøgt i flere organismer og celletyper. Det blev konstateret, at den udviser variationer i nogle detaljer eller i nogle tilfælde er unødvendig. I nogle meiotiske systemer synes bidraget fra RanGTP-banen faktisk at være uvæsentligt. F.eks. kan Drosophila-sædceller samle meiose I-spindlen i fuldstændig fravær af kromosomer (Bucciarelli et al., 2003). Samlingen af den acentrosomale spindel i meiose I i mus og frøers oocytter blev også vist kun delvist at være afhængig af RanGTP-vejen, selv om vejen er strengt essentiel for spindel-samlingen under meiose II (Dumont et al., 2007).
Selv i systemer, der er afhængige af RanGTP til spindel-samlingen, er der nogle variationer i det mindste på maskinens niveau. For eksempel er TPX2, som er essentiel i frøer og pattedyr, ikke til stede i Caenorhabditis elegans og Drosophila melanogaster. Selv om proteiner med nogle af TPX2-egenskaberne er blevet identificeret i disse systemer (Ozlu et al., 2005; Goshima, 2011), mangler de væsentlige træk ved TPX2, som f.eks. en NLS, der ligger til grund for RanGTP-reguleringen. Dette eksempel viser, at effektorerne i RanGTP-vejen kan variere fra system til system, selv om hovedprincipperne sandsynligvis opretholdes og bevares.
RanGTP-vejen: RanGTP-banen: En måneskinsbane med en rolle i flere cellulære funktioner
RanGTP-banen er et eksempel på en hel bane, der udfører vigtige funktioner i forskellige dele af cellecyklusen. I interfasen orkestrerer den den nukleo-cytoplasmatiske transport, mens den i mitose driver spindelmontering og senere kerneembran- og NPC-genmontering (figur 1B-D). Individuelle proteiner, der har forskellige funktioner på forskellige tidspunkter, defineres som “moonlighting proteiner” (Jeffery, 1999). RanGTP-banen kunne derfor være et eksempel på en moonlighting-bane.
RanGTP-banen er særlig interessant, fordi den viser, hvordan et proteins funktion afhænger af dets kontekst: de fleste SAF’er har nukleare funktioner og holdes adskilt fra tubuliner og andre cytoskeletproteiner i interfasen. Ved NEBD ændres den generelle kontekst, og SAF’erne udøver vigtige funktioner, der er relateret til MT’erne.
Nogle data peger i retning af en måneskinsfunktion for RanGTP-vejen i ciliedannelse og i transport ind i ciliet. RanGTP er blevet vist at kontrollere ophobningen af Kif17 og retinis pigmentosa 2 til cilioplasmaet (Dishinger et al., 2010; Hurd et al., 2011), hvor RanGTP er koncentreret (Fan et al., 2011). Den nuværende arbejdsmodel er, at RanGTP-vejen orkestrerer transporten af cargos, der bærer et cilia-lokaliseringssignal, gennem cilia-porekomplekset, som er blevet foreslået at være placeret ved basen af ciliet (Kee et al., 2012; Figur 1E). Der er imidlertid behov for yderligere undersøgelser for at forstå, hvordan RanGTP-gradienten etableres i cilia, og hvilke andre cargos den transporterer ind i cilia.
Interessant nok er RanGTP-vejen også måneskin i differentierede neuroner, hvor mange SAF’er også har en funktion . Desuden akkumuleres importiner α og β ved det dendritiske synaptiske rum og har en rolle i transporten af cargos fra synapserne til kernen (Jordan og Kreutz, 2009; Panayotis et al., 2015). Endelig er en RanGTP-reguleret mekanisme blevet vist at være i spil som reaktion på skader på iskiasnerven (Hanz et al., 2003; Yudin et al., 2008; Figur 1F).
Konklusioner
Den identifikation af den rolle, som RanGTP-vejen spiller under celledeling, fandt sted for mere end 15 år siden. Vi ved nu, at RanGTP-vejen har yderligere funktioner og kan betragtes som en måneskinsvej, der kontrollerer forskellige vigtige cellulære processer (figur 1). Under celledeling styrer den vigtige mekanismer, som vi begynder at forstå takket være identifikationen og den funktionelle karakterisering af dens direkte mål. Der er dog stadig flere åbne spørgsmål, der skal besvares. Det samlede antal SAF’er er vanskeligt at forudse, og vi ved derfor ikke, hvor mange der stadig mangler at blive identificeret. Desuden er det meste af vores nuværende viden begrænset til den rolle, som kun nogle af komponenterne i det nukleo-cytoplasmatiske transportmaskineri spiller. F.eks. ved man i øjeblikket meget lidt om den formodede rolle, som de forskellige importiner, der findes i den menneskelige celle, spiller ved celledeling. Specifikke importiner kan regulere aktiviteten af nye SAF’er, og deres forskellige ekspressionsmønstre i forskellige celletyper og væv kan udgøre en relevant kombinatorisk mekanisme. Vi ved også meget lidt om den formodede rolle, som komponenterne i eksportmaskineriet kan spille i spindelsammensætningen og i de andre nye funktioner i denne vej. Selv om der er data, der tyder på forskellige reguleringspunkter for selve vejen, er konsekvenserne for celledeling og andre processer endnu ikke klarlagt, og det er heller ikke klart, hvordan den kan tilpasses til kravene i forskellige celletyper eller væv. Undersøgelsen af RanGTP-banen vil helt sikkert give spændende ny indsigt i de næste par år og afsløre nogle væsentlige mekanismer for cellens organisering og funktion.
Author Contributions
IV og TC skrev manuskriptet, TC udarbejdede tabel og figur.
Funding
TC blev støttet af det spanske ministerium for økonomi og konkurrenceevne (MINECO) gennem FPI-stipendiet BES-2010-031355. Arbejdet i Vernos-laboratoriet blev støttet af det spanske ministeriums tilskud BFU2009-10202 og BFU2012-37163, der samfinansieres af Den Europæiske Fond for Regionaludvikling (EFRU/FEDER). Vi anerkender også støtte fra det spanske ministerium for økonomi og konkurrenceevne, “Centro de Excelencia Severo Ochoa 2013-2017,” SEV-2012-0208.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført i fravær af kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Anerkendelser
Vi vil gerne takke medlemmerne af Vernos laboratorium for kritiske diskussioner om de forskellige aspekter af RanGTP-vejen.
Abkortelser
γTuRC, γTubulin Ring Complex; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-associated nonspecific lethal complex; MT, Microtubule; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Nuclear Localization Signal; NPC, Nuclear Pore Complex; NTR, Nuclear Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Importin-beta’s rolle i koblingen af Ran til nedstrømsmål i mikrotubuli-samlingen. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar