- Historical Perspective on the Chromatin Dependent MT Assembly Pathway
- Der nukleo-zytoplasmatische Transport und die kleine GTPase Ran
- Der RanGTP-Weg während der Zellteilung
- Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
- Regulierung des RanGTP-Systems während der Zellteilung
- Die Rolle anderer Komponenten der nukleo-cytoplasmatischen Shuttling-Maschinerie während der Mitose
- Erhaltung des RanGTP-Wegs in sich teilenden Zellen
- Der RanGTP-Stoffwechsel: Ein „Moonlighting Pathway“ mit einer Rolle in mehreren zellulären Funktionen
- Schlussfolgerungen
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
- Danksagung
- Abkürzungen
Historical Perspective on the Chromatin Dependent MT Assembly Pathway
Die ersten Hinweise auf die Existenz eines chromosomenabhängigen MT-Assembly-Mechanismus in der sich teilenden Zelle wurden in den 1970-1980er Jahren gewonnen, als mehrere Gruppen berichteten, dass die MT-Nukleation in der Nähe oder an den Kinetochoren stattfand (McGill und Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) und sich eine spindelartige Struktur um Lambda-DNA bildete, die in Xenopus-Eier mit Metaphasenstillstand injiziert wurde (Karsenti et al., 1984). Im Jahr 1996 wurde gezeigt, dass DNA-beschichtete Kügelchen die Bildung bipolarer Spindeln auslösen, wenn sie in Xenopus-Eiextrakten inkubiert werden (Heald et al., 1996), was die Idee unterstützt, dass Chromatin alle Informationen enthält, die für die Steuerung der MT-Montage und -Organisation im Zytoplasma der M-Phase erforderlich sind. Kurz darauf brachte die Identifizierung der kleinen Ran-GTPase als treibende Kraft der chromatinabhängigen MT-Montage im Zytoplasma der M-Phase einen wichtigen Durchbruch zum Verständnis des zugrunde liegenden Mechanismus (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde und Zheng, 1999; Zhang et al., 1999). Heute wissen wir, dass die Chromosomen in den meisten Zellen die MT-Assemblierung und die Organisation zu einer bipolaren Spindel in einer RanGTP-abhängigen Weise steuern (Karsenti und Vernos, 2001; Rieder, 2005).
In dieser Mini-Review werden wir kurz beschreiben, wie das RanGTP-System das nukleo-cytoplasmatische Shuttling von Komponenten in der Interphase und, nach NEBD, die Aktivität und/oder Lokalisierung spezifischer Faktoren zur Steuerung der Spindelassemblierung reguliert. Wir geben einen kurzen Überblick über den aktuellen Wissensstand zur Identität und Funktion der durch RanGTP regulierten Faktoren und über die jüngsten Fortschritte beim Verständnis neuartiger Mechanismen, die durch RanGTP reguliert werden. Schließlich geben wir einen Überblick über die Regulierung des RanGTP-Stoffwechsels selbst während der Mitose, seine Erhaltung in verschiedenen Organismen und Zelltypen und seine Rolle bei anderen zellulären Funktionen. Für zusätzliche Informationen verweisen wir den Leser auf ausgezeichnete Übersichtsarbeiten (Ciciarello et al., 2007; O’Connell und Khodjakov, 2007; Clarke und Zhang, 2008; Kalab und Heald, 2008; Roscioli et al., 2010; Forbes et al, 2015).
Der nukleo-zytoplasmatische Transport und die kleine GTPase Ran
Eukaryotische Zellen sind kompartimentiert und verfügen über spezifische Transportsysteme für die Kommunikation zwischen dem Zytoplasma und den verschiedenen membrangebundenen Organellen. Das nukleo-zytoplasmatische Transportsystem ist für die funktionelle Verbindung zwischen der Transkription des Genoms, die im Zellkern stattfindet, und der Protein-Translation, die im Zytoplasma abläuft, unerlässlich (Abbildungen 1A und B). Der Transport von Molekülen in und aus dem Zellkern erfolgt über den Kernporenkomplex (NPC), einen großen Proteinkomplex von ~60 MDa, der in die Kernmembran eingebaut ist (Sorokin et al., 2007). Kleine Ladungen (< 40 kDa) diffundieren schnell durch den NPC. Proteine, die größer als 40 kDa sind, benötigen stattdessen einen aktiven Transport durch den NPC, an dem lösliche Kerntransportrezeptoren (NTRs) beteiligt sind, die zur Familie der Karyopherin-β-Proteine gehören. NTRs, die den Transport von Frachtproteinen in den Zellkern erleichtern, werden Importine genannt und interagieren mit ihrer Fracht über ein Kernlokalisierungssignal (NLS), das reich an basischen Resten ist. NTRs, die den Export von Proteinen aus dem Zellkern erleichtern, werden Exportine genannt und interagieren mit ihrer Ladung über ein Kernexportsignal (NES), das reich an hydrophoben Resten wie Leucin ist. Das Karyopherin-β-Importin β1 interagiert häufig mit der Ladung über einen Adaptor der Importin-α-Familie (Sorokin et al., 2007). Importin α bindet direkt an die NLS des Frachtproteins und an Importin β1 über eine IBB-Domäne (importin β binding domain), was zur Bildung eines trimeren Komplexes führt.
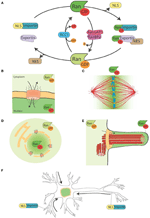
Abbildung 1. Das Ran-System und seine Moonlighting-Funktionen. (A) Schematische Darstellung des Ran-Systems für die räumliche Kontrolle von NLS- und NES-tragenden Proteinen. In Zellen kommt Ran in zwei Formen vor, RanGTP (grün) und RanGDP (hellgrün). RCC1 (hellblau) fördert den Austausch von GDP zu GTP, während RanGAP1-RanBP2 (in rosa und lila) die Hydrolyse von GTP zu GDP fördern. RanGTP bindet an die Importine (türkisgrün) und Exportine (hellviolett). Exportine im Komplex mit RanGTP können mit den NES-Proteinen (in braun) assoziieren. Andererseits löst die Bindung von RanGTP an Importine deren Dissoziation von NLS-Proteinen aus (gelb). (B) Während der Interphase steuert das Ran-System das nukleo-zytoplasmatische Shuttling von Proteinen, da RanGTP im Nukleoplasma und RanGDP im Zytoplasma vorherrscht (Sorokin et al., 2007). (C) Während der Mitose definiert die Assoziation von RCC1, dem RanGEF, mit den Chromosomen einen Gradienten der RanGTP-Konzentration, der die Freisetzung von SAFs und die MT-Kernbildung um das Chromatin fördert. Das Ran-System wird in einen Weg für die MT-Montage und -Organisation umgewandelt, der für den Aufbau der mitotischen Spindel unerlässlich ist. Der RanGTP-Weg hängt von der Schaffung eines Konzentrationsgradienten von RanGTP ab, der um die Chromosomen herum seinen Höhepunkt erreicht (Kalab et al., 2002; Caudron et al., 2005). (D) Am Ende der Mitose reguliert das Ran-System auch den Zusammenbau von Kernmembran und NPC, indem es die Membranfusion steuert und NPC-Komponenten freisetzt (Walther et al., 2003; Harel et al., 2003). (E) In Wimpernzellen akkumuliert RanGTP im Wimpernplasma und fördert den Transport und die Akkumulation von Kif17 und Retinis pigmentosa 2 zum Wimpernplasma (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) In Neuronen haben viele SAFs eine Funktion. Darüber hinaus lokalisieren sich Importine im dendritischen synaptischen Raum und sind am Transport von Gütern zum Zellkern beteiligt (Jordan und Kreutz, 2009; Panayotis et al., 2015). Das Ran-System ist auch im Axon des Ischiasnervs aktiv, wo Importine nach einer Verletzung den Transport von Gütern zum Zellkörper des Neurons fördern (Hanz et al., 2003; Yudin et al., 2008).
NTRs assoziieren mit der kleinen GTPase Ran, die als molekularer Schalter fungiert. In seiner GTP-gebundenen Form interagiert Ran (RanGTP) mit Karyopherin-β-Proteinen mit hoher Affinität, während es in seiner GDP-gebundenen Form (RanGDP) dissoziiert. Die Bindung von RanGTP an Importine und Exportine hat sehr unterschiedliche Folgen: es stabilisiert die Exportin-Cargo-Interaktion, während es die Importin-Cargo-Interaktion destabilisiert (Abbildung 1A).
Der RanGEF (Guanin-Nukleotid-Austauschfaktor) RCC1 assoziiert mit dem Chromatin innerhalb des Zellkerns, während RanGAP (GTPase-aktivierendes Protein) zytoplasmatisch ist. Infolgedessen ist die vorherrschende Form von Ran im Kern an GTP gebunden, während es im Zytoplasma an GDP gebunden ist. Dadurch werden NLS-Proteine, die durch Importine in den Kern transportiert werden, freigesetzt und sammeln sich im Nukleoplasma an, während NES-Proteine im Komplex mit Exportin-RanGTP aus dem Kern transportiert werden (Abbildungen 1A,B).
Obwohl der nukleo-zytoplasmatische Transport nicht mehr benötigt wird, wenn eine Zelle in die Mitose eintritt, wird seine komplexe molekulare Maschinerie wiederverwendet, um die MT-Montage um das Chromatin herum zu fördern und die Organisation der bipolaren Spindel zu steuern (Clarke und Zhang, 2008).
Der RanGTP-Weg während der Zellteilung
Da RCC1 nach NEBD mit dem Chromatin assoziiert bleibt, ist RanGTP in der Nähe der Chromosomen stark angereichert. Wenn RanGTP vom Chromatin wegdiffundiert, wird es von RanGAP im Zytoplasma in RanGDP umgewandelt (Abbildung 1C). Der sich daraus ergebende Gradient wurde in Zellen und Xenopus-Eiextrakten direkt sichtbar gemacht (Kalab et al., 2002, 2006) und seine Eigenschaften bei der MT-Kernbildung und -Stabilisierung getestet und modelliert (Caudron et al., 2005). Wie in der Interphase bietet dieses System eine räumliche Kontrolle über die Stabilität von NTRs-Cargo-Komplexen. Bei den Cargos handelt es sich um NLS- und/oder NES-haltige Proteine mit spezifischen Funktionen im Zusammenhang mit dem Aufbau und der Funktion der Spindel. Die NLS-Proteine, die bei der Spindelmontage eine Rolle spielen, wurden als SAFs (Spindle Assembly Factors) bezeichnet.
Die Entdeckung und Charakterisierung des RanGTP-Wegs veranlasste eine erneute Überprüfung des 1986 vorgeschlagenen Search-and-Capture-Modells für die Spindelmontage (Kirschner und Mitchison, 1986). Dieses Modell postuliert, dass zentrosomale MTs wachsen und schrumpfen und dabei den zytoplasmatischen Raum erkunden, bis eine stochastische Begegnung mit einem Kinetochor ihr Einfangen und Anhaften fördert. Es ist jedoch inzwischen eindeutig erwiesen, dass Tierzellen, denen experimentell ihre Zentrosomen entzogen wurden, eine funktionelle mitotische Spindel aufbauen (Debec et al., 1995; Khodjakov et al., 2000). Darüber hinaus legten mathematische Simulationen nahe, dass der Search-and-Capture-Mechanismus die kurze Teilungszeit, die in den meisten tierischen Zellen beobachtet wird, nicht erklären kann (Wollman et al., 2005). Durch die Förderung der MT-Kernbildung und -Stabilisierung in der Nähe der Chromosomen begünstigt der RanGTP-Weg mit Sicherheit das Einfangen der MT durch die Kinetochoren und erhöht damit die Effizienz des Search-and-Capture-Mechanismus. Die Rolle des RanGTP-Wegs muss jedoch über das Einfangen von MT durch die Kinetochoren und die Bildung von Kinetochor-Fasern (K-Fasern) hinausgehen, da er auch die MT-Organisation in Abwesenheit von Chromosomen, Kinetochoren und K-Fasern fördert (Carazo-Salas et al., 1999). Die Identifizierung der direkten und indirekten RanGTP-Ziele im Zytoplasma der M-Phase ist daher ein wesentlicher Schritt zum vollständigen Verständnis der verschiedenen Aufgaben, die dieser Stoffwechselweg während der Zellteilung erfüllt.
Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
Ein direkter Einblick in die Rolle von RanGTP im Zytoplasma der M-Phase wurde in Xenopus-Eiextrakten ohne Chromatin und Zentrosomen gewonnen. Die Zugabe von RanGTP zu diesen Extrakten reicht in der Tat aus, um die MT-Kernbildung auszulösen, die MT-Stabilisierung zu fördern und die Organisation von MT-Ansammlungen, den so genannten Mini-Spindeln, zu induzieren (Carazo-Salas et al., 1999, 2001). Daher könnten eine oder mehrere SAFs an diesen verschiedenen Ereignissen beteiligt sein.
Seit der Identifizierung der ersten SAFs im Jahr 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al., 2001; Clarke und Zhang, 2008; Meunier und Vernos, 2012) ist die Zahl der Proteine, die von RanGTP in der Mitose kontrolliert werden, langsam gewachsen und mehrere neue SAFs wurden kürzlich identifiziert (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier und Vernos, 2011; Samwer et al., 2013; Wilbur und Heald, 2013). Derzeit sind 22 Proteine als SAF validiert worden (Tabelle 1). Darüber hinaus sind eine Reihe von Proteinen, die nachweislich an verschiedenen Aspekten des Spindelaufbaus beteiligt sind, nukleär und könnten daher Ziele für die RanGTP-Regulierung sein (z. B. Kif4a/Klp1, Ino80, Reptin), aber diese Möglichkeit sollte in weiteren Studien untersucht werden.

Table 1. Spindelaufbau-Faktoren.
Interessanterweise liefert die funktionelle Charakterisierung einiger SAFs mechanistische Einblicke in die Funktionen des RanGTP-Wegs in der sich teilenden Zelle. Der Mechanismus, durch den RanGTP die MT-Nukleation de novo im Zytoplasma der M-Phase fördert, wurde kürzlich beschrieben (Scrofani et al., 2015). Durch die Freisetzung von TPX2 von Importinen fördert RanGTP dessen Interaktion mit Aurora A und mit einem RHAMM-NEDD1-γTURC (γTubulin Ring Complex) Komplex. In diesem neuen Komplex phosphoryliert das aktivierte Aurora A NEDD1, eine wesentliche Voraussetzung für die MT-Kernbildung. Es wurde gezeigt, dass ein weiterer SAF, Mel28, mit dem γTuRC interagiert, und es wurde vorgeschlagen, dass er eine Rolle bei der RanGTP-abhängigen MT-Kernbildung spielt (Yokoyama et al., 2014). Die potenzielle Zusammenarbeit von Mel28 mit dem oben beschriebenen TPX2-abhängigen Stoffwechselweg ist noch nicht geklärt.
Der RanGTP-Stoffwechselweg trägt auch zur Reifung des Zentrosoms und seiner MT-Aktivität bei (Carazo-Salas et al., 2001). Tatsächlich wurde gezeigt, dass zwei SAFs, CDK11 und Mel28, den MT-Aufbau am Zentrosom begünstigen (Yokoyama et al., 2008, 2014).
Die Identifizierung und Charakterisierung eines weiteren SAFs, MCRS1, hat einen neuartigen und wichtigen Mechanismus für die Regulierung der MT-Minus-Ende-Dynamik der K-Faser aufgedeckt (Meunier und Vernos, 2011) und neue Einblicke in die Rolle des RanGTP-Wegs beim Spindelaufbau und der Zellteilung ermöglicht (Meunier und Vernos, 2012). MCRS1 ist im Komplex mit Mitgliedern des Chromatinmodifikators KAT8-associated nonspecific lethal (KANSL)-Komplexes (Meunier et al., 2015) auf das Minus-Ende von RanGTP-abhängigen MTs ausgerichtet und schützt diese vor Depolymerisation. Innerhalb der Spindel assoziiert MCRS1 auch spezifisch mit den Minus-Enden von K-Faser-MTs und reguliert deren Depolymerisationsrate, was eine wesentliche Rolle bei der K-Faser-Dynamik und der Chromosomenausrichtung spielt (Meunier und Vernos, 2011; Meunier et al., 2015). Die spezifische Assoziation von MCRS1 mit den MTs, die durch den RanGTP-abhängigen Weg nukleiert werden, deutet auch darauf hin, dass diese MTs spezifische Eigenschaften haben, die sie von den MTs unterscheiden, die von den Zentrosomen nukleiert werden. Wenn sich dies bewahrheitet, wären die chromosomalen MTs nicht nur ein lokaler Vorrat an MTs, der einen effizienten Search-and-Capture-Mechanismus begünstigt, sondern sie könnten wesentliche einzigartige Funktionalitäten bieten, die für den Aufbau und die Funktion der bipolaren Spindel erforderlich sind (Meunier et al, 2015).
Kürzlich wurde gezeigt, dass das MT depolymerisierende Kinesin Kif2a durch RanGTP in der Mitose reguliert wird, was einen wichtigen Mechanismus für die Skalierung der Spindel auf die Zellgröße während der frühen Entwicklung von Xenopus-Embryonen aufzeigt (Wilbur und Heald, 2013). Kif2a wird durch Importin α bis zum Stadium 8 der Embryonalentwicklung inaktiv gehalten. Wenn die lösliche Konzentration von Importin α abnimmt, wird Kif2a freigesetzt und fungiert als MT-Depolymerase, die die Verkürzung der Spindel fördert.
Obwohl die meisten der bisher identifizierten SAFs eine Rolle in den frühen Phasen der Zellteilung spielen, deuten eine Reihe neuerer Berichte darauf hin, dass der RanGTP-Signalweg auch andere wesentliche Funktionen hat, die nicht direkt mit dem Spindelaufbau zusammenhängen. So deutet die Charakterisierung des SAF ISWI darauf hin, dass der RanGTP-Stoffwechselweg während der Anaphase eine Rolle spielt (Yokoyama et al., 2009).
Mehrere Forschungslinien deuten auch darauf hin, dass er eine Rolle bei der Spindelpositionierung spielt. Tatsächlich schränkt der RanGTP-Gradient vor dem Eintritt in die Anaphase die Lokalisierung des LGN-NuMa-Komplexes auf weiter von den Chromosomen entfernte Bereiche der Zellrinde ein und trägt so zur Kontrolle der Spindelposition und -ausrichtung bei (Kiyomitsu und Cheeseman, 2012).
Darüber hinaus reguliert RanGTP auch nicht-MT-bezogene Ziele. So steuert es die Anillin-Lokalisierung und löst die asymmetrische Membranverlängerung während der Anaphase aus, wodurch die Spindelpositionierung im Zentrum der sich teilenden Zelle bestimmt wird (Silverman-Gavrila et al., 2008; Kiyomitsu und Cheeseman, 2012). Schließlich reguliert der RanGTP-Weg während der Zytokinese die Aktivität des Kinesins Kif14/Nabkin bei der Aktinbündelung (Carleton et al., 2006; Samwer et al., 2013) und koordiniert den Zusammenbau von Kernmembran und NPC (Harel et al., 2003; Walther et al., 2003; Ciciarello et al, 2010; Roscioli et al., 2010; Forbes et al., 2015; Abbildung 1D).
Es ist daher klar, dass die Identifizierung und funktionelle Charakterisierung der mitotischen RanGTP-Ziele neue Einblicke in den Mechanismus des Spindelaufbaus und der Zellteilung liefert. Es ist jedoch unklar, ob noch viele oder nur wenige weitere RanGTP-Ziele identifiziert werden müssen. Diese Zahl könnte potenziell hoch sein, da die Zahl der Kernproteine in der Größenordnung von Hunderten oder Tausenden liegt (Dellaire et al., 2003), mindestens eine Größenordnung über der derzeitigen Zahl der bekannten RanGTP-Ziele in der sich teilenden Zelle (Tabelle 1).
Die meisten proteomischen Studien zur Identifizierung neuer SAFs haben sich auf die Importine α1 und β1 konzentriert (Nachury et al., 2001; Wiese et al., 2001; Yokoyama et al., 2008), die zwei der am häufigsten vorkommenden Importine in Xenopus-Eiextrakten sind (Bernis et al., 2014; Wuhr et al., 2014). Es gibt jedoch fünf weitere α-Importine und acht weitere β-Importine beim Menschen (Cautain et al., 2015).
Obwohl noch spärlich, deuten einige Daten darauf hin, dass tatsächlich auch andere Importine eine Rolle bei der Zellteilung spielen. Es wurde gezeigt, dass die RanGTP-Regulation von NuSAP von Importin-β1 und Importin-7 abhängt (Ribbeck et al., 2006) und die von Mel28, Nup107-160 und Nup98 von Importin-β1 und Transportin/Importin-β2 (Lau et al., 2009). Es wurde auch gezeigt, dass Transportin die Spindelmontage und die Kernmembran- und NPC-Neubildung negativ reguliert (Bernis et al., 2014). Es gibt jedoch keine beschriebenen mitotischen Faktoren, die ausschließlich durch Importin-7 oder Transportin reguliert werden.
Die Charakterisierung möglicher Transportin-spezifischer Ziele und, allgemeiner, der anderen Importine α und β stellt ein offenes Feld für die Erforschung dar. Dies könnte wichtig sein, um die Regulierung des RanGTP-Stoffwechsels zu verstehen, insbesondere in Anbetracht der Tatsache, dass sich die Expressionsmuster der Importine in verschiedenen Entwicklungsstadien und Geweben erheblich verändern (Hosokawa et al., 2008).
Regulierung des RanGTP-Systems während der Zellteilung
Abgesehen von den Besonderheiten der NTR-SAF-Interaktionen können mehrere Mechanismen den RanGTP-Stoffwechsel während der Zellteilung direkt beeinflussen. Mehrere Daten deuten darauf hin, dass RCC1 selbst eine Schlüsselkomponente ist, die fein reguliert wird. Menschliche Zellen haben drei Isoformen von RCC1, die gewebespezifisch exprimiert werden (Hood und Clarke, 2007). Die Isoformen unterscheiden sich an ihrem N-Terminus, einer Region, die an der Importin-Bindung beteiligt ist und durch Phosphorylierung reguliert wird, von der angenommen wurde, dass sie die Chromosomen-gekoppelte RanGTP-Produktion beeinflusst (Hood und Clarke, 2007; Li et al., 2007). Darüber hinaus variiert das Niveau der RCC1-Expression in verschiedenen Zellen und korreliert mit der Steilheit des RanGTP-Gradienten (Hasegawa et al., 2013). Dies könnte wichtige Konsequenzen haben, da vorgeschlagen wurde, dass die Steilheit des RanGTP-Gradienten die Länge der Prometaphase und Metaphase bestimmt, was wiederum für die Chromosomentrennungstreue von Bedeutung sein könnte (Silkworth et al., 2012; Hasegawa et al., 2013).
Weitere Mechanismen wie posttranslationale Modifikationen und alternatives Spleißen sind ebenfalls mögliche Strategien zur Kontrolle der NLS von SAFs. Diese Mechanismen würden jedoch eher ein bestimmtes Protein als den gesamten RanGTP-Weg betreffen.
Kürzlich wurde ein alternativer Mechanismus für die Regulierung von SAFs unabhängig von RanGTP vorgeschlagen. Die Ausrichtung des Golgi-Proteins GM130 auf fragmentierte Golgi-Membranen in der Mitose könnte lokal TPX2 von der Importin-α1-Bindung verdrängen und damit die MT-Montage in der Nähe von Golgi-Fragmenten begünstigen (Wei et al., 2015). Dieser auf Wettbewerb basierende Mechanismus könnte eine weitere Strategie zur lokalen Kontrolle von SAFs sein, die von Importinen sequestriert werden.
Die Rolle anderer Komponenten der nukleo-cytoplasmatischen Shuttling-Maschinerie während der Mitose
Die Bindung von RanGTP an Exportine stabilisiert seine Interaktion mit NES-Frachtproteinen. Es wurde gezeigt, dass das wichtigste Exportin, CRM1, an der Ausrichtung von NES-Proteinen auf den Kinetochor oder die Zentrosomen beteiligt ist. Am Kinetochor rekrutiert CRM1 den RanBP2-RanGAP1-SUMO-Komplex, der für die Interaktion zwischen MTs und dem Kinetochor erforderlich ist (Arnaoutov et al., 2005). Es ist jedoch mechanistisch noch unklar, wie dieser Komplex die MT-Kinetochore-Interaktion begünstigt (Forbes et al., 2015). CRM1 fördert auch die Rekrutierung von RanGAP1-RanBP2 an die Spindel in einer RanGTP-abhängigen Weise (Wu et al., 2013) und ist durch seine direkte Interaktion mit Survivin an der Bindung des Chromosomen-Passagierkomplexes an das Zentromer beteiligt (Knauer et al., 2006). Es wurde auch gezeigt, dass CRM1 die Rekrutierung von BRCA1 und Pericentrin an den mitotischen Zentrosomen fördert und damit die MT-Assembly-Aktivität der Zentrosomen unterstützt (Liu et al., 2009; Brodie und Henderson, 2012). Kürzlich wurde festgestellt, dass der transkriptionelle Repressor Bach1 eine Rolle bei der Ausrichtung von Chromosomenarmen während der Mitose spielt und während der Metaphase in Abhängigkeit von CRM1 von den Chromosomen entfernt wird (Li et al., 2012).
Die Bedeutung dieser Targeting-Ereignisse ist jedoch mechanistisch nicht ganz klar (Yokoyama und Gruss, 2013). Ein Hauptproblem besteht darin, dass während der Mitose die mutmaßliche Rolle der Exportin-vermittelten Interaktionen nur schwer von derjenigen der Importin-vermittelten Interaktionen zu trennen ist, da an ihnen Proteine beteiligt sind, die sowohl NES als auch NLS besitzen. Dennoch scheint es offensichtlich, dass die RanGTP-Regulierung von CRM1 während der Mitose mehrere Funktionen hat, und es wird interessant sein zu prüfen, ob andere Exportine ebenfalls für mitotische Ereignisse wichtig sind.
Erhaltung des RanGTP-Wegs in sich teilenden Zellen
In den letzten 15 Jahren wurde der RanGTP-Weg in verschiedenen Organismen und Zelltypen untersucht. Dabei wurde festgestellt, dass er in einigen Details variiert oder in einigen Fällen gar nicht notwendig ist. In einigen meiotischen Systemen scheint der Beitrag des RanGTP-Stoffwechsels tatsächlich unwesentlich zu sein. So können beispielsweise Drosophila-Spermatozyten die Meiose-I-Spindel in völliger Abwesenheit von Chromosomen zusammensetzen (Bucciarelli et al., 2003). Der Aufbau der acentrosomalen Spindel der Meiose I in Oozyten von Mäusen und Fröschen ist ebenfalls nur teilweise vom RanGTP-Signalweg abhängig, obwohl der Signalweg für den Spindelaufbau während der Meiose II unbedingt erforderlich ist (Dumont et al., 2007).
Selbst in Systemen, die für den Spindelaufbau auf RanGTP angewiesen sind, gibt es zumindest auf der Ebene der Maschinerie einige Variationen. So ist beispielsweise TPX2, das bei Fröschen und Säugetieren essentiell ist, in Caenorhabditis elegans und Drosophila melanogaster nicht vorhanden. Obwohl in diesen Systemen Proteine mit einigen TPX2-Merkmalen identifiziert wurden (Ozlu et al., 2005; Goshima, 2011), fehlen ihnen wesentliche Merkmale von TPX2, wie z. B. eine NLS, die die Grundlage der RanGTP-Regulierung ist. Dieses Beispiel zeigt, dass die Effektoren des RanGTP-Stoffwechsels von System zu System variieren können, obwohl die Hauptprinzipien wahrscheinlich beibehalten und konserviert werden.
Der RanGTP-Stoffwechsel: Ein „Moonlighting Pathway“ mit einer Rolle in mehreren zellulären Funktionen
Der RanGTP-Stoffwechselweg ist ein Beispiel für einen ganzen Stoffwechselweg, der wesentliche Funktionen in verschiedenen Abschnitten des Zellzyklus erfüllt. In der Interphase steuert er den Nukleo-Zytoplasma-Transport, während er in der Mitose den Spindelaufbau und später den Zusammenbau der Kernmembran und des NPC antreibt (Abbildungen 1B-D). Einzelne Proteine, die zu verschiedenen Zeiten unterschiedliche Funktionen haben, werden als „moonlighting proteins“ bezeichnet (Jeffery, 1999). Der RanGTP-Weg könnte daher ein Beispiel für einen Moonlighting-Weg sein.
Der RanGTP-Weg ist besonders interessant, weil er zeigt, wie die Funktion eines Proteins von seinem Kontext abhängt: Die meisten SAFs haben Kernfunktionen und werden während der Interphase von Tubulinen und anderen Zytoskelettproteinen getrennt gehalten. Bei NEBD ändert sich der allgemeine Kontext und die SAFs üben wichtige Funktionen im Zusammenhang mit den MTs aus.
Einige Daten deuten auf eine Nebenfunktion des RanGTP-Wegs bei der Zilienbildung und beim Transport in das Zilium hin. Es hat sich gezeigt, dass RanGTP die Anhäufung von Kif17 und Retinis pigmentosa 2 im Cilioplasma kontrolliert (Dishinger et al., 2010; Hurd et al., 2011), wo RanGTP konzentriert ist (Fan et al., 2011). Das derzeitige Arbeitsmodell geht davon aus, dass der RanGTP-Weg den Transport von Gütern, die ein Zilienlokalisierungssignal tragen, durch den Zilienporenkomplex steuert, der sich an der Basis des Ziliums befinden soll (Kee et al., 2012; Abbildung 1E). Es sind jedoch weitere Studien erforderlich, um zu verstehen, wie der RanGTP-Gradient in den Zilien aufgebaut wird und welche anderen Frachten er in die Zilien transportiert.
Interessanterweise leuchtet der RanGTP-Weg auch in differenzierten Neuronen, wo viele SAFs ebenfalls eine Funktion haben. Darüber hinaus akkumulieren Importine α und β im dendritischen synaptischen Raum und spielen eine Rolle beim Transport von Gütern von den Synapsen zum Zellkern (Jordan und Kreutz, 2009; Panayotis et al., 2015). Schließlich wurde gezeigt, dass ein RanGTP-gesteuerter Mechanismus bei Verletzungen des Ischiasnervs eine Rolle spielt (Hanz et al., 2003; Yudin et al., 2008; Abbildung 1F).
Schlussfolgerungen
Die Identifizierung der Rolle, die der RanGTP-Signalweg während der Zellteilung spielt, liegt mehr als 15 Jahre zurück. Heute wissen wir, dass der RanGTP-Stoffwechselweg noch weitere Funktionen hat und als „moonlighting pathway“ betrachtet werden könnte, der verschiedene wichtige zelluläre Prozesse kontrolliert (Abbildung 1). Während der Zellteilung steuert er wesentliche Mechanismen, die wir dank der Identifizierung und funktionellen Charakterisierung seiner direkten Ziele zu verstehen beginnen. Mehrere offene Fragen müssen jedoch noch geklärt werden. Die Gesamtzahl der SAF ist schwer abzuschätzen, und daher wissen wir nicht, wie viele noch zu identifizieren sind. Außerdem beschränkt sich der Großteil unseres derzeitigen Wissens auf die Rolle einiger Komponenten der nukleo-cytoplasmatischen Transportmaschinerie. So ist beispielsweise nur sehr wenig über die mutmaßliche Rolle der verschiedenen Importine, die in der menschlichen Zelle vorkommen, bei der Zellteilung bekannt. Spezifische Importine könnten die Aktivität neuartiger SAFs regulieren, und ihre unterschiedlichen Expressionsmuster in verschiedenen Zelltypen und Geweben könnten einen relevanten kombinatorischen Mechanismus darstellen. Wir wissen auch wenig über die mutmaßliche Rolle der Komponenten der Exportmaschinerie beim Spindelaufbau und bei anderen neuartigen Funktionen des Weges. Obwohl es Daten gibt, die auf verschiedene Punkte der Regulierung des Weges selbst hindeuten, sind die Folgen für die Zellteilung und andere Prozesse noch nicht klar, und auch nicht, wie er an die Anforderungen verschiedener Zelltypen oder Gewebe angepasst werden kann. Die Erforschung des RanGTP-Signalwegs wird in den nächsten Jahren sicherlich spannende neue Erkenntnisse liefern und einige wesentliche Mechanismen für die Zellorganisation und -funktion aufdecken.
Beiträge der Autoren
IV und TC haben das Manuskript verfasst, TC hat die Tabelle und Abbildung erstellt.
Finanzierung
TC wurde vom spanischen Ministerium für Wirtschaft und Wettbewerbsfähigkeit (MINECO) durch das FPI-Stipendium BES-2010-031355 unterstützt. Die Arbeit im Vernos-Labor wurde durch die Stipendien BFU2009-10202 und BFU2012-37163 des spanischen Ministeriums unterstützt, die aus dem Europäischen Fonds für regionale Entwicklung (EFRE/FEDER) kofinanziert werden. Wir bedanken uns auch für die Unterstützung durch das spanische Ministerium für Wirtschaft und Wettbewerbsfähigkeit, „Centro de Excelencia Severo Ochoa 2013-2017“, SEV-2012-0208.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken den Mitgliedern von Vernos Labor für kritische Diskussionen über die verschiedenen Aspekte des RanGTP-Stoffwechsels.
Abkürzungen
γTuRC, γTubulin Ring Complex; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-associated nonspecific lethal complex; MT, Mikrotubuli; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Nuclear Localization Signal; NPC, Nuclear Pore Complex; NTR, Nuclear Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Role of importin-beta in coupling Ran to downstream targets in microtubule assembly. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar