- Historical Perspective on the Chromatin Dependent MT Assembly Pathway
- Transport jądrowo-cytoplazmatyczny i mała GTPaza Ran
- Scieżka RanGTP podczas podziału komórki
- Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
- Regulacja systemu RanGTP podczas podziału komórki
- Rola innych komponentów machiny przemieszczania jądrowo-cytoplazmatycznego podczas mitozy
- Conservation of the RanGTP Pathway in Dividing Cells
- The RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
- Wnioski
- Author Contributions
- Funding
- Oświadczenie o konflikcie interesów
- Podziękowania
- Abbreviations
Historical Perspective on the Chromatin Dependent MT Assembly Pathway
Pierwsze wskazówki dotyczące istnienia zależnego od chromosomu mechanizmu składania MT w dzielącej się komórce uzyskano w latach 1970-1980, gdy kilka grup doniosło, że nukleacja MT zachodziła w pobliżu lub przy kinetochorach (McGill i Brinkley, 1975; Telzer i in., 1975; Witt et al., 1980; De Brabander et al., 1981), a struktura przypominająca wrzeciono utworzyła się wokół DNA lambda wstrzykniętego do zatrzymanych w metafazie jaj Xenopus (Karsenti et al., 1984). W 1996 r. wykazano, że kulki pokryte DNA, inkubowane w ekstraktach z jaj Xenopus, wyzwalają tworzenie wrzecion dwubiegunowych (Heald i in., 1996), co stanowiło dalsze wsparcie dla idei, że chromatyna przenosi wszystkie informacje wymagane do kierowania tworzeniem i organizacją MT w cytoplazmie w fazie M. Wkrótce potem, identyfikacja małej GTPazy Ran jako czynnika kierującego zależnym od chromatyny składaniem MT w cytoplazmie fazy M dostarczyła istotnego przełomu w zrozumieniu mechanizmu leżącego u podstaw tego procesu (Carazo-Salas i in., 1999; Kalab i in., 1999; Ohba i in., 1999; Wilde i Zheng, 1999; Zhang i in., 1999). Obecnie wiemy, że chromosomy kierują montażem MT i organizacją w dwubiegunowe wrzeciono w sposób zależny od RanGTP w większości komórek (Karsenti i Vernos, 2001; Rieder, 2005).
W tym mini-przeglądzie opiszemy pokrótce, jak system RanGTP reguluje jądrowo-cytoplazmatyczne przemieszczanie składników w interfazie oraz, po NEBD, aktywność i/lub lokalizację specyficznych czynników kierujących montażem wrzeciona. Dokonamy krótkiego przeglądu naszej obecnej wiedzy na temat tożsamości i funkcji czynników regulowanych przez RanGTP oraz ostatnich postępów w zrozumieniu nowych mechanizmów regulowanych przez RanGTP. Na koniec przedstawimy przegląd regulacji samego szlaku RanGTP podczas mitozy, jego zachowanie w różnych organizmach i typach komórek oraz jego rolę w innych funkcjach komórkowych. Po dodatkowe informacje odsyłamy czytelnika do doskonałych recenzji (Ciciarello i in., 2007; O’Connell i Khodjakov, 2007; Clarke i Zhang, 2008; Kalab i Heald, 2008; Roscioli i in., 2010; Forbes i in., 2015).
Transport jądrowo-cytoplazmatyczny i mała GTPaza Ran
Komórki eukariotyczne są podzielone na przedziały i posiadają specyficzne systemy transportowe do komunikacji między cytoplazmą a różnymi organellami związanymi z błonami. System transportu jądrowo-cytoplazmatycznego jest niezbędny do funkcjonalnego połączenia transkrypcji genomu, która zachodzi w jądrze, z translacją białek, która ma miejsce w cytoplazmie (Ryc. 1A, B). Transport cząsteczek do i z jądra odbywa się za pośrednictwem jądrowego kompleksu porowego (NPC), dużego kompleksu białkowego o masie ~60 MDa wprowadzonego do błony jądrowej (Sorokin i in., 2007). Małe ładunki (< 40 kDa) szybko dyfundują przez NPC. Białka większe niż 40 kDa wymagają natomiast aktywnego transportu przez NPC, w którym biorą udział rozpuszczalne receptory transportu jądrowego (NTR) należące do rodziny białek karioferyn-β. NTR ułatwiaj±ce transport białek ładunkowych do j±dra nazywane s± importynami i oddziałuj± ze swoim ładunkiem poprzez sygnał lokalizacji j±drowej (NLS) bogaty w reszty zasadowe. NTR ułatwiające eksport białek z jądra nazywane są eksportynami i oddziałują z ładunkiem poprzez sygnał eksportu jądrowego (NES) bogaty w reszty hydrofobowe, takie jak leucyna. Importyna kariopherin-β β1 często oddziałuje z ładunkiem poprzez adaptor z rodziny importin α (Sorokin i in., 2007). Importyna α wiąże się bezpośrednio z NLS białka ładunku oraz z importyną β1 poprzez domenę IBB (importin β binding domain), co prowadzi do utworzenia trimerycznego kompleksu.
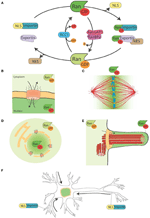
Rysunek 1. System Ran i jego funkcje księżycowe. (A) Schematyczne przedstawienie systemu Ran do przestrzennej kontroli białek niosących NLS i NES. W komórkach Ran występuje w dwóch formach, RanGTP (zielona) i RanGDP (jasnozielona). RCC1 (jasnoniebieski) promuje wymianę GDP na GTP, podczas gdy RanGAP1-RanBP2 (różowy i fioletowy) promują hydrolizę GTP do GDP. RanGTP wi±że się z importynami (turkusowozielony) i eksportynami (jasnofioletowy). Eksportyny w kompleksie z RanGTP mog± się przył±czyć do białek NES (br±zowe). Z drugiej strony, zwi±zanie RanGTP z importynami powoduje ich dysocjację od białek NLS (kolor żółty). (B) Podczas interfazy, system Ran kontroluje nukleo-cytoplazmatyczne przemieszczanie białek, ponieważ RanGTP dominuje w nukleoplazmie, a RanGDP w cytoplazmie (Sorokin i in., 2007). (C) Podczas mitozy asocjacja RCC1, RanGEF, z chromosomami definiuje gradient stężeń RanGTP, który promuje uwalnianie SAFs i nukleację MT wokół chromatyny. System Ran przekształca się w szlak składania i organizacji MT, który jest niezbędny do tworzenia wrzeciona mitotycznego. Szlak RanGTP zależy od ustanowienia gradientu stężenia RanGTP, który osiąga szczyty wokół chromosomów (Kalab i in., 2002; Caudron i in., 2005). (D) Pod koniec mitozy, system Ran reguluje również reasemblację błony jądrowej i NPC poprzez kontrolę fuzji błony i uwalnianie składników NPC (Walther i in., 2003; Harel i in., 2003). (E) W komórkach glejowych RanGTP gromadzi się w cilioplazmie i promuje transport i akumulację Kif17 i retinis pigmentosa 2 do cilioplazmy (Dishinger i in., 2010; Fan i in., 2011; Hurd i in., 2011). (F) W neuronach wiele SAF pełni określone funkcje. Ponadto, importyny lokalizują się do dendrytycznej przestrzeni synaptycznej i biorą udział w transporcie ładunków do jądra (Jordan i Kreutz, 2009; Panayotis i in., 2015). System Ran jest również aktywny w aksonie nerwu kulszowego, gdzie po uszkodzeniu importyny promują transport ładunków w kierunku ciała komórkowego neuronu (Hanz i in., 2003; Yudin i in., 2008).
NTRs asocjują z małą GTPazą Ran, która działa jak przełącznik molekularny. W formie związanej z GTP, Ran (RanGTP) oddziałuje z białkami karioferyny-β z wysokim powinowactwem, podczas gdy dysocjuje w formie związanej z GDP (RanGDP). Wiązanie RanGTP do importyn i eksportyn ma bardzo różne konsekwencje: stabilizuje interakcję eksportyna-ładunek, podczas gdy destabilizuje interakcję importyna-ładunek (Rysunek 1A).
Czynnik wymiany nukleotydów guaninowych RanGEF (guanine nucleotide exchange factor) RCC1 wiąże się z chromatyną wewnątrz jądra, podczas gdy RanGAP (GTPase activating protein) jest cytoplazmatyczny. W konsekwencji dominującą formą Ran w jądrze jest forma związana z GTP, podczas gdy w cytoplazmie z GDP. W ten sposób białka NLS transportowane do jądra przez importyny są uwalniane i gromadzą się w nukleoplazmie, natomiast białka NES w kompleksie z eksportyną-RanGTP są transportowane poza jądro (Ryc. 1A,B).
Pomimo że transport jądrowo-cytoplazmatyczny nie jest już potrzebny, gdy komórka wchodzi w mitozę, jej złożona maszyneria molekularna jest ponownie wykorzystywana do promowania montażu MT wokół chromatyny i kierowania organizacją wrzeciona dwubiegunowego (Clarke i Zhang, 2008).
Scieżka RanGTP podczas podziału komórki
Jako że RCC1 pozostaje związany z chromatyną po NEBD, RanGTP jest wysoce wzbogacony w pobliżu chromosomów. Gdy RanGTP dyfunduje z dala od chromatyny, RanGAP w cytoplazmie przekształca go w RanGDP (Rysunek 1C). Powstały w ten sposób gradient został bezpośrednio uwidoczniony w komórkach i ekstraktach z jaj Xenopusa (Kalab i in., 2002, 2006), a jego właściwości w zarodkowaniu i stabilizacji MT zostały zbadane i wymodelowane (Caudron i in., 2005). Podobnie jak w interfazie, system ten zapewnia przestrzenną kontrolę nad stabilnością kompleksów NTRs-cargo. Ładunki te to białka zawierające NLS i/lub NES o specyficznych funkcjach związanych z tworzeniem i funkcjonowaniem wrzeciona. Białka NLS odgrywające rolę w montażu wrzeciona zostały nazwane SAFs (Spindle Assembly Factors).
Odkrycie i scharakteryzowanie szlaku RanGTP skłoniło do ponownego przeanalizowania modelu Search and Capture dla montażu wrzeciona zaproponowanego w 1986 roku (Kirschner i Mitchison, 1986). Model ten postuluje, że MT centrosomalne rosną i kurczą się, eksplorując przestrzeń cytoplazmatyczną, aż do momentu stochastycznego spotkania z kinetochorem, co sprzyja ich wychwyceniu i przyłączeniu. Jednakże, obecnie wyraźnie stwierdzono, że komórki zwierzęce pozbawione eksperymentalnie centrosomów tworzą funkcjonalne wrzeciono mitotyczne (Debec i in., 1995; Khodjakov i in., 2000). Co więcej, symulacje matematyczne sugerowały, że mechanizm Search and Capture nie może odpowiadać za krótki czas podziału obserwowany w większości komórek zwierzęcych (Wollman i in., 2005). Promując nukleację i stabilizację MT w pobliżu chromosomów, szlak RanGTP z pewnością sprzyja wychwytywaniu MT przez kinetochory, zwiększając efektywność mechanizmu Search and Capture. Jednakże rola szlaku RanGTP musi wykraczać poza wychwytywanie MT przez kinetochory i tworzenie włókien kinetochorowych (K-fiber), ponieważ promuje on również organizację MT w nieobecności chromosomów, kinetochorów i włókien K (Carazo-Salas i in., 1999). Identyfikacja bezpośrednich i pośrednich celów RanGTP w cytoplazmie fazy M jest zatem niezbędnym krokiem do pełnego zrozumienia kilku ról, jakie ten szlak spełnia podczas podziału komórki.
Understanding the RanGTP Pathway through the Identification and Functional Characterization of its Targets
Bezpośredni odczyt roli RanGTP w cytoplazmie fazy M uzyskano w ekstraktach z jaj Xenopus pozbawionych chromatyny i centrosomów. Dodanie RanGTP do tych ekstraktów jest rzeczywiście wystarczające do uruchomienia nukleacji MT, promowania stabilizacji MT i indukowania organizacji zespołów MT zwanych mini-wrzecionami (Carazo-Salas i in., 1999, 2001). Dlatego jeden lub więcej SAFs może być zaangażowany w te różne zdarzenia.
Od czasu identyfikacji pierwszych SAFs w 2001 roku (Gruss i in., 2001; Nachury i in., 2001; Wiese i in., 2001; Clarke i Zhang, 2008; Meunier i Vernos, 2012), liczba białek kontrolowanych przez RanGTP w mitozie powoli wzrasta, a ostatnio zidentyfikowano kilka nowych SAF (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila i wsp, 2008; Yokoyama i in., 2008, 2009, 2014; Dikovskaya i in., 2010; Meunier i Vernos, 2011; Samwer i in., 2013; Wilbur i Heald, 2013). Obecnie 22 białka zostały zwalidowane jako SAF-y (Tabela 1). Ponadto, szereg białek o ustalonych rolach w różnych aspektach składania wrzeciona jest jądrowych i dlatego mogłyby być celami regulacji RanGTP (tj. Kif4a/Klp1, Ino80, Reptin), ale dalsze badania powinny zająć się tą możliwością.

Tabela 1. Spindle assembly factors.
Interesująco, funkcjonalna charakterystyka niektórych SAF dostarcza mechanistycznych wglądów w funkcje szlaku RanGTP w dzielącej się komórce. Mechanizm, dzięki któremu RanGTP promuje nukleację MT de novo w cytoplazmie fazy M, został niedawno opisany (Scrofani i in., 2015). Uwalniając TPX2 od importyn, RanGTP promuje jego interakcję z Aurorą A oraz z kompleksem RHAMM-NEDD1-γTURC (γTubulin Ring Complex). W tym nowym kompleksie aktywowana Aurora A fosforyluje NEDD1, co jest niezbędnym warunkiem nukleacji MT. Wykazano, że inny SAF, Mel28, oddziałuje z γTuRC i zaproponowano, że odgrywa on rolę w nukleacji MT zależnej od RanGTP (Yokoyama i in., 2014). Potencjalna współpraca Mel28 z opisanym powyżej szlakiem TPX2-zależnym pozostaje do ustalenia.
Ścieżka RanGTP również przyczynia się do dojrzewania centrosomu i jego aktywności w składaniu MT (Carazo-Salas i wsp., 2001). W rzeczywistości wykazano, że dwa SAF, CDK11 i Mel28 sprzyjają montażowi MT w centrosomie (Yokoyama i in., 2008, 2014).
Identyfikacja i charakterystyka innego SAF, MCRS1, ujawniła nowy i ważny mechanizm regulacji dynamiki minus-końca włókna K MT (Meunier i Vernos, 2011) oraz nowe spojrzenie na rolę szlaku RanGTP w montażu wrzeciona i podziale komórki (Meunier i Vernos, 2012). MCRS1, w kompleksie z członkami kompleksu modyfikatora chromatyny KAT8-associated nonspecific lethal (KANSL) (Meunier i in., 2015), jest ukierunkowany na minus-end MT zależnych od RanGTP, chroniąc je przed depolimeryzacją. W obrębie wrzeciona MCRS1 wiąże się również specyficznie z minus-końcami włókien K MTs i reguluje tempo ich depolimeryzacji, odgrywając istotną rolę w dynamice włókien K i wyrównywaniu chromosomów (Meunier i Vernos, 2011; Meunier i in., 2015). Specyficzna asocjacja MCRS1 z MT zarodkowanymi na drodze zależnej od RanGTP sugeruje również, że MT te posiadają specyficzne cechy odróżniające je od MT zarodkowanych przez centrosomy. Jeśli okaże się to prawdą, chromosomalne MTs nie stanowiłyby jedynie lokalnej podaży MTs sprzyjającej wydajnemu mechanizmowi Search and Capture, ale mogłyby dostarczać istotnych unikalnych funkcjonalności wymaganych do złożenia i funkcjonowania wrzeciona dwubiegunowego (Meunier i in., 2015).
Dawno temu wykazano, że kinezyna Kif2a depolimeryzująca MT jest regulowana przez RanGTP w mitozie, ujawniając ważny mechanizm skalowania wrzeciona do rozmiaru komórki podczas wczesnego rozwoju embrionów Xenopus (Wilbur i Heald, 2013). Kif2a jest utrzymywany w stanie nieaktywnym przez importynę α do 8 etapu rozwoju embrionalnego. Wraz ze spadkiem stężenia rozpuszczalnej importyny α, Kif2a jest uwalniany i funkcjonuje jako depolimeraza MT promując skracanie wrzeciona.
Pomimo, że w większości zidentyfikowanych do tej pory SAF-ów stwierdzono, że odgrywają one rolę we wczesnych fazach podziału komórki, szereg ostatnich doniesień wskazuje, że szlak RanGTP pełni inne istotne role nie związane bezpośrednio ze składaniem wrzeciona. Rzeczywiście, charakterystyka SAF ISWI sugeruje funkcje dla ścieżki RanGTP podczas anafazy (Yokoyama i in., 2009).
Wiele linii badawczych wskazuje również, że odgrywa ona rolę w pozycjonowaniu wrzeciona. Rzeczywiście, przed wejściem w anafazę, gradient RanGTP ogranicza lokalizację kompleksu LGN-NuMa do obszarów kory komórkowej bardziej oddalonych od chromosomów, przyczyniając się do kontroli pozycji i orientacji wrzeciona (Kiyomitsu i Cheeseman, 2012).
Więcej, RanGTP reguluje również cele niezwiązane z MT. Rzeczywiście, kontroluje lokalizację Anillin i wyzwala asymetryczną elongację błony podczas anafazy, definiując pozycjonowanie wrzeciona w centrum dzielącej się komórki (Silverman-Gavrila i in., 2008; Kiyomitsu i Cheeseman, 2012). Wreszcie, podczas cytokinezy szlak RanGTP reguluje aktywność kinezyny Kif14/Nabkin w wiązaniu aktyny (Carleton i in., 2006; Samwer i in., 2013) i koordynuje ponowne składanie błony jądrowej i NPC (Harel i in., 2003; Walther i in., 2003; Ciciarello i in., 2010; Roscioli i in., 2010; Forbes i in., 2015; Figura 1D).
Jasne jest zatem, że identyfikacja i funkcjonalna charakterystyka celów mitotycznych RanGTP dostarcza nowych wglądów w mechanizm montażu wrzeciona i podziału komórki. Nie jest jednak jasne, czy wiele, czy tylko kilka innych celów RanGTP pozostaje do zidentyfikowania. Liczba ta może być potencjalnie wysoka, ponieważ liczba białek jądrowych jest rzędu setek lub tysięcy (Dellaire i in., 2003), co najmniej o rząd wielkości powyżej obecnej liczby znanych celów RanGTP w dzielącej się komórce (Tabela 1).
Większość badań proteomicznych mających na celu identyfikację nowych SAF skupiła się na importynach α1 i β1 (Nachury i in., 2001; Wiese i in., 2001; Yokoyama i in., 2008), które są dwiema najobficiej występującymi importynami w ekstraktach z jaj Xenopus (Bernis i in., 2014; Wuhr i in., 2014). Istnieje jednak pięć dodatkowych α-importyn i osiem dodatkowych β-importyn u ludzi (Cautain i in., 2015).
Choć wciąż skąpe, niektóre dane wskazują, że rzeczywiście inne importyny również odgrywają rolę podczas podziału komórki. Wykazano, że regulacja RanGTP przez NuSAP zależy od importyny-β1 i importyny-7 (Ribbeck i in., 2006), a regulacja przez Mel28, Nup107-160 i Nup98 od importyny-β1 i transportyny/importyny-β2 (Lau i in., 2009). Wykazano również, że transportyna w sposób szczególny negatywnie reguluje składanie wrzeciona oraz reasemblację błony jądrowej i NPC (Bernis i in., 2014). Nie ma jednak opisanych czynników mitotycznych regulowanych wyłącznie przez importynę-7 lub transportynę.
Charakterystyka możliwych celów specyficznych dla transportyny oraz, bardziej ogólnie, dla innych importyn α i β stanowi otwarte pole do eksploracji. Może to być ważne dla zrozumienia regulacji szlaku RanGTP, szczególnie biorąc pod uwagę, że wzorce ekspresji importyn zmieniają się znacząco w różnych etapach rozwoju i tkankach (Hosokawa i in., 2008).
Regulacja systemu RanGTP podczas podziału komórki
Poza specyficznością interakcji NTR-SAF, kilka mechanizmów może bezpośrednio wpływać na szlak RanGTP podczas podziału komórki. Kilka danych sugeruje, że sam RCC1 jest kluczowym elementem podlegającym precyzyjnej regulacji. Komórki ludzkie posiadają trzy izoformy RCC1, które ulegają ekspresji w sposób specyficzny dla danej tkanki (Hood i Clarke, 2007). Izoformy te różnią się na N-końcu, w regionie zaangażowanym w wiązanie importu i regulowanym przez fosforylację, co, jak sugerowano, wpływa na sprzężoną z chromosomem produkcję RanGTP (Hood i Clarke, 2007; Li i in., 2007). Co więcej, poziom ekspresji RCC1 również różni się w różnych komórkach i koreluje ze stromością gradientu RanGTP (Hasegawa i in., 2013). Może to mieć istotne konsekwencje, ponieważ zaproponowano, że stromość gradientu RanGTP determinuje długość prometafazy i metafazy, co z kolei może mieć znaczenie dla wierności segregacji chromosomów (Silkworth i in., 2012; Hasegawa i in., 2013).
Inne mechanizmy, takie jak modyfikacje potranslacyjne i alternatywny splicing są również potencjalnymi strategiami kontroli NLS SAF-ów. Jednak mechanizmy te wpływają raczej na konkretne białko niż na cały szlak RanGTP.
W ostatnim czasie zaproponowano alternatywny mechanizm regulacji SAFs niezależnie od RanGTP. Skierowanie białka Golgiego GM130 do pofragmentowanych błon Golgiego w mitozie może lokalnie konkurować z TPX2 z wiązania importyny α1, sprzyjając w ten sposób składaniu MT w pobliżu fragmentów Golgiego (Wei i in., 2015). Ten mechanizm oparty na konkurencji może być kolejną strategią lokalnej kontroli SAF sekwestrowanych przez importyny.
Rola innych komponentów machiny przemieszczania jądrowo-cytoplazmatycznego podczas mitozy
Wiązanie RanGTP do eksportyn stabilizuje ich interakcję z białkami NES-cargo. Wykazano, że główna eksportyna, CRM1, jest zaangażowana w kierowanie białek NES do kinetochoru lub centrosomów. W kinetochorze CRM1 rekrutuje kompleks RanBP2-RanGAP1-SUMO, który jest wymagany do interakcji pomiędzy MTs a kinetochorem (Arnaoutov i in., 2005). Nadal jednak mechanistycznie niejasne jest, w jaki sposób kompleks ten sprzyja interakcji MT-kinetochor (Forbes i in., 2015). CRM1 promuje również rekrutację RanGAP1-RanBP2 do wrzeciona w sposób zależny od RanGTP (Wu i wsp., 2013) oraz bierze udział w wiązaniu kompleksu Chromosome Passenger Complex do centromeru poprzez bezpośrednią interakcję z survivinem (Knauer i wsp., 2006). Wykazano również, że CRM1 sprzyja rekrutacji BRCA1 i pericentryny do centrosomów mitotycznych, promując w ten sposób aktywność centrosomów w procesie składania MT (Liu i in., 2009; Brodie i Henderson, 2012). Ostatnio stwierdzono, że represor transkrypcyjny Bach1 odgrywa rolę w wyrównywaniu ramion chromosomów podczas mitozy i jest wykluczany z chromosomów podczas metafazy w sposób zależny od CRM1 (Li i in., 2012).
Jednakże znaczenie tych zdarzeń ukierunkowujących nie jest do końca jasne mechanistycznie (Yokoyama i Gruss, 2013). Głównym problemem jest to, że podczas mitozy przypuszczalna rola interakcji pośredniczonych przez eksportynę może być trudna do odróżnienia od interakcji pośredniczonych przez importynę, ponieważ angażują one białka posiadające zarówno NES jak i NLS . Niemniej jednak wydaje się oczywiste, że regulacja RanGTP dla CRM1 ma kilka ról podczas mitozy i interesujące będzie sprawdzenie, czy inne eksportyny są również ważne dla wydarzeń mitotycznych.
Conservation of the RanGTP Pathway in Dividing Cells
W ciągu ostatnich 15 lat ścieżka RanGTP była badana w kilku organizmach i typach komórek. Stwierdzono, że zawiera on różnice w niektórych szczegółach lub w niektórych przypadkach jest niepotrzebny. Rzeczywiście, w niektórych systemach mejotycznych udział szlaku RanGTP wydaje się być nieistotny. Na przykład, spermatocyty Drosophila mogą montować wrzeciono mejozy I przy całkowitym braku chromosomów (Bucciarelli i in., 2003). Wykazano również, że montaż wrzeciona acentrosomalnego mejozy I w oocytach myszy i żab jest tylko częściowo zależny od szlaku RanGTP, chociaż szlak ten jest ściśle niezbędny do montażu wrzeciona podczas mejozy II (Dumont i in., 2007).
Nawet w systemach polegających na RanGTP do montażu wrzeciona istnieją pewne różnice przynajmniej na poziomie maszynerii. Na przykład TPX2, który jest niezbędny u żab i ssaków, nie występuje u Caenorhabditis elegans i Drosophila melanogaster. Chociaż w tych systemach zidentyfikowano białka posiadające pewne cechy TPX2 (Ozlu i in., 2005; Goshima, 2011), to brakuje im istotnych cech TPX2, takich jak NLS, który jest podstawą regulacji RanGTP. Przykład ten wskazuje, że efektory szlaku RanGTP mogą się różnić w zależności od systemu, chociaż główne zasady są prawdopodobnie zachowane i konserwowane.
The RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
Scieżka RanGTP jest przykładem całej ścieżki, która realizuje istotne funkcje w różnych częściach cyklu komórkowego. W interfazie orkiestruje transport jądro-cytoplazma, podczas gdy w mitozie napędza składanie wrzeciona, a później membranę jądrową i ponowne składanie NPC (Ryc. 1B-D). Pojedyncze białka, które pełnią różne funkcje w różnych okresach określa się mianem białek księżycowych (Jeffery, 1999). Szlak RanGTP może być zatem przykładem szlaku moonlighting.
Szlak RanGTP jest szczególnie interesujący, ponieważ pokazuje, jak funkcja białka zależy od jego kontekstu: większość SAF ma funkcje jądrowe i jest utrzymywana w separacji od tubulin i innych białek cytoszkieletu podczas interfazy. Po NEBD, ogólny kontekst się zmienia i SAFs pełnią ważne funkcje związane z MTs.
Niektóre dane wskazują na księżycową funkcję szlaku RanGTP w tworzeniu rzęsek i w transporcie do cilium. Wykazano, że RanGTP kontroluje akumulację Kif17 i retinis pigmentosa 2 do cilioplazmy (Dishinger i in., 2010; Hurd i in., 2011), gdzie RanGTP jest skoncentrowany (Fan i in., 2011). Obecny model roboczy zakłada, że szlak RanGTP orkiestruje transport ładunków niosących sygnał lokalizacji rzęsek przez kompleks porów rzęskowych, który, jak zaproponowano, znajduje się u podstawy rzęsek (Kee i in., 2012; Rysunek 1E). Konieczne są jednak dalsze badania, aby zrozumieć, w jaki sposób gradient RanGTP jest ustanawiany w rzęskach i jakie inne ładunki transportuje do rzęsek.
Interesująco, szlak RanGTP księżyca również w zróżnicowanych neuronach, gdzie wiele SAF również pełni funkcję . Ponadto importyny α i β gromadzą się w dendrytycznej przestrzeni synaptycznej i pełnią rolę w transporcie ładunków z synaps do jądra (Jordan i Kreutz, 2009; Panayotis i in., 2015). Wreszcie wykazano, że mechanizm regulowany przez RanGTP jest w grze w odpowiedzi na urazy nerwu kulszowego (Hanz i in., 2003; Yudin i in., 2008; Figura 1F).
Wnioski
Zidentyfikowanie roli odgrywanej przez szlak RanGTP podczas podziału komórki nastąpiło ponad 15 lat temu. Obecnie wiemy, że szlak RanGTP pełni dodatkowe funkcje i może być uważany za szlak księżycowy kontrolujący różne ważne procesy komórkowe (Rycina 1). Podczas podziału komórki napędza on istotne mechanizmy, które zaczynamy rozumieć dzięki identyfikacji i funkcjonalnej charakterystyce jego bezpośrednich celów. Nadal jednak pozostaje kilka otwartych kwestii do rozwiązania. Całkowita liczba SAF-ów jest trudna do przewidzenia i dlatego nie wiemy, ile z nich pozostaje jeszcze do zidentyfikowania. Ponadto, większość naszej obecnej wiedzy ogranicza się do roli tylko niektórych komponentów maszynerii transportu nukleo-cytoplazmatycznego. Na przykład, bardzo niewiele wiadomo obecnie na temat przypuszczalnej roli w podziale komórkowym różnych importyn obecnych w komórce ludzkiej. Określone importyny mogą regulować aktywność nowych SAF-ów, a ich różne wzorce ekspresji w różnych typach komórek i tkanek mogą stanowić istotny mechanizm kombinatoryczny. Niewiele wiemy również o przypuszczalnej roli komponentów maszynerii eksportowej w tworzeniu wrzeciona i innych nowych funkcjach tego szlaku. Chociaż istnieją dane sugerujące różne punkty regulacji samego szlaku, konsekwencje dla podziałów komórkowych i innych procesów nie są jeszcze jasne, ani jak może on być dostosowany do wymagań różnych typów komórek lub tkanek. Badanie szlaku RanGTP z pewnością dostarczy nowych ekscytujących spostrzeżeń w ciągu najbliższych kilku lat, ujawniając pewne istotne mechanizmy organizacji i funkcjonowania komórek.
Author Contributions
IV i TC napisali manuskrypt, TC przygotował tabelę i rysunek.
Funding
TC był wspierany przez hiszpańskie Ministerstwo Gospodarki i Konkurencyjności (MINECO) poprzez stypendium FPI BES-2010-031355. Prace w laboratorium Vernos były wspierane przez granty hiszpańskiego ministerstwa BFU2009-10202 i BFU2012-37163, współfinansowane przez Europejski Fundusz Rozwoju Regionalnego (ERDF/FEDER). Uznajemy również wsparcie hiszpańskiego Ministerstwa Gospodarki i Konkurencyjności, „Centro de Excelencia Severo Ochoa 2013-2017,” SEV-2012-0208.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Chcemy podziękować członkom laboratorium Vernosa za krytyczne dyskusje na temat różnych aspektów szlaku RanGTP.
Abbreviations
γTuRC, γTubulin Ring Complex; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-associated nonspecific lethal complex; MT, Microtubule; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Nuclear Localization Signal; NPC, Nuclear Pore Complex; NTR, Nuclear Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Role of importin-beta in coupling Ran to downstream targets in microtubule assembly. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar
.