- Perspectiva histórica de la vía de ensamblaje de las MT dependientes de la cromatina
- El transporte núcleo-citoplasmático y la pequeña GTPasa Ran
- La vía de RanGTP durante la división celular
- Comprensión de la vía de RanGTP a través de la identificación y caracterización funcional de sus dianas
- Regulación del sistema RanGTP durante la división celular
- El papel de otros componentes de la maquinaria de traslado núcleo-citoplásmico durante la mitosis
- Conservación de la vía RanGTP en las células en división
- La vía RanGTP: Una vía de luz de luna con un papel en varias funciones celulares
- Conclusiones
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
- Abreviaturas
Perspectiva histórica de la vía de ensamblaje de las MT dependientes de la cromatina
Los primeros indicios de la existencia de un mecanismo de ensamblaje de las MT dependientes del cromosoma en la célula en división se obtuvieron en la década de 1970-1980, cuando varios grupos informaron de que la nucleación de las MT se producía cerca o en los cinetocoros (McGill y Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) y que se formaba una estructura similar a un huso alrededor del ADN lambda inyectado en huevos de Xenopus detenidos en metafase (Karsenti et al., 1984). En 1996, se demostró que las perlas recubiertas de ADN desencadenaban la formación del huso bipolar cuando se incubaban en extractos de huevos de Xenopus (Heald et al., 1996), proporcionando más apoyo a la idea de que la cromatina lleva toda la información necesaria para dirigir el ensamblaje y la organización de los MT en el citoplasma de la fase M. Poco después, la identificación de la pequeña GTPasa Ran como conductora del ensamblaje de las MT dependientes de la cromatina en el citoplasma de la fase M supuso un gran avance para entender el mecanismo subyacente (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde y Zheng, 1999; Zhang et al., 1999). Hoy en día, sabemos que los cromosomas impulsan el ensamblaje y la organización de los MT en un huso bipolar de una manera dependiente de RanGTP en la mayoría de las células (Karsenti y Vernos, 2001; Rieder, 2005).
En esta mini-revisión describiremos brevemente cómo el sistema RanGTP regula el desplazamiento núcleo-citoplasmático de los componentes en interfase y, después de NEBD, la actividad y/o localización de factores específicos para impulsar el ensamblaje del huso. Revisaremos brevemente nuestros conocimientos actuales sobre la identidad y función de los factores regulados por RanGTP y los recientes avances en la comprensión de nuevos mecanismos regulados por RanGTP. Por último, ofreceremos una visión general de la regulación de la propia vía RanGTP durante la mitosis, su conservación en diferentes organismos y tipos celulares, y su papel en otras funciones celulares. Para información adicional remitimos al lector a excelentes revisiones (Ciciarello et al., 2007; O’Connell y Khodjakov, 2007; Clarke y Zhang, 2008; Kalab y Heald, 2008; Roscioli et al., 2010; Forbes et al., 2015).
El transporte núcleo-citoplasmático y la pequeña GTPasa Ran
Las células eucariotas están compartimentadas y cuentan con sistemas de transporte específicos para la comunicación entre el citoplasma y los diferentes orgánulos unidos a la membrana. El sistema de transporte núcleo-citoplasma es esencial para conectar funcionalmente la transcripción del genoma que ocurre dentro del núcleo, con la traducción de proteínas que tiene lugar en el citoplasma (Figuras 1A,B). El transporte de moléculas dentro y fuera del núcleo se produce a través del complejo de poros nucleares (NPC), un gran complejo proteico de ~60 MDa insertado en la membrana nuclear (Sorokin et al., 2007). Las cargas pequeñas (< 40 kDa) se difunden rápidamente a través del CNP. En cambio, las proteínas de más de 40 kDa requieren un transporte activo a través del CNP que involucra a los receptores de transporte nuclear solubles (NTRs) que pertenecen a la familia de proteínas karyopherin-β. Los NTR que facilitan el transporte de proteínas de carga al núcleo se denominan importinas e interactúan con su carga a través de una señal de localización nuclear (NLS) rica en residuos básicos. Las NTR que facilitan la exportación de proteínas fuera del núcleo se denominan exportinas e interactúan con su carga a través de una señal de exportación nuclear (NES) rica en residuos hidrofóbicos como la leucina. La importina β de carioferina suele interactuar con la carga a través de un adaptador de la familia de importinas α (Sorokin et al., 2007). La importina α se une directamente al NLS de la proteína de carga y a la importina β1 a través de un dominio IBB (importin β binding domain), dando lugar a la formación de un complejo trimérico.
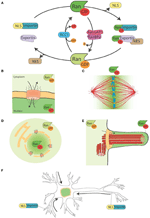
Figura 1. El sistema Ran y sus funciones de luz de luna. (A) Representación esquemática del sistema Ran para el control espacial de las proteínas portadoras de NLS y NES. En las células, Ran se encuentra en dos formas, RanGTP (verde) y RanGDP (verde claro). RCC1 (azul claro) promueve el intercambio de GDP a GTP, mientras que RanGAP1-RanBP2 (en rosa y morado) promueven la hidrólisis de GTP en GDP. RanGTP se une a las importinas (verde turquesa) y a las exportinas (púrpura claro). Las exportinas en complejo con RanGTP pueden asociarse a las proteínas NES (en marrón). Por otro lado, la unión de RanGTP a las importinas desencadena su disociación de las proteínas NLS (en amarillo). (B) Durante la interfase, el sistema Ran controla el desplazamiento nucleo-citoplasmático de las proteínas, ya que RanGTP predomina en el nucleoplasma y RanGDP en el citoplasma (Sorokin et al., 2007). (C) Durante la mitosis la asociación de RCC1, el RanGEF, con los cromosomas define un gradiente de concentraciones de RanGTP que promueve la liberación de SAFs y la nucleación de MTs alrededor de la cromatina. El sistema Ran se convierte en una vía para el ensamblaje y organización de las MT que es esencial para el ensamblaje del huso mitótico. La vía RanGTP depende del establecimiento de un gradiente de concentración de RanGTP que alcanza su máximo alrededor de los cromosomas (Kalab et al., 2002; Caudron et al., 2005). (D) Al final de la mitosis, el sistema Ran también regula el reensamblaje de la membrana nuclear y del CNP controlando la fusión de la membrana y liberando los componentes del CNP (Walther et al., 2003; Harel et al., 2003). (E) En las células ciliadas RanGTP se acumula en el cilioplasma y promueve el transporte y la acumulación de Kif17 y retinis pigmentosa 2 al cilioplasma (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) En las neuronas muchos SAFs tienen una función. Además, las importinas se localizan en el espacio sináptico dendrítico y participan en el transporte de cargas al núcleo (Jordan y Kreutz, 2009; Panayotis et al., 2015). El sistema Ran también está activo en el axón del nervio ciático, donde tras la lesión las importinas promueven el transporte de cargas hacia el cuerpo celular de la neurona (Hanz et al., 2003; Yudin et al., 2008).
Las NTRs se asocian con la pequeña GTPasa Ran que actúa como un interruptor molecular. En su forma unida a GTP, Ran (RanGTP) interactúa con las proteínas karyopherin-β con alta afinidad, mientras que se disocia en su forma unida a GDP (RanGDP). La unión de RanGTP a importinas y exportinas tiene consecuencias muy diferentes: estabiliza la interacción exportina-carga mientras que desestabiliza la interacción importina-carga (Figura 1A).
El RanGEF (factor de intercambio de nucleótidos de guanina) RCC1 se asocia con la cromatina dentro del núcleo, mientras que RanGAP (proteína activadora de GTPasas) es citoplásmica. En consecuencia, la forma predominante de Ran en el núcleo está unida a GTP, mientras que en el citoplasma está unida a GDP. De este modo, las proteínas NLS transportadas al núcleo por las importinas son liberadas y se acumulan en el nucleoplasma, mientras que las proteínas NES en complejo con la exportina-RanGTP son transportadas fuera del núcleo (Figuras 1A,B).
Aunque el transporte núcleo-citoplasma ya no es necesario cuando una célula entra en mitosis, su compleja maquinaria molecular se recicla para promover el ensamblaje de MT alrededor de la cromatina y para dirigir la organización del huso bipolar (Clarke y Zhang, 2008).
La vía de RanGTP durante la división celular
Como RCC1 permanece asociado a la cromatina después de NEBD, RanGTP está altamente enriquecido en la proximidad de los cromosomas. A medida que el RanGTP se aleja de la cromatina, el RanGAP del citoplasma lo convierte en RanGDP (Figura 1C). El gradiente resultante se ha visualizado directamente en células y extractos de huevos de Xenopus (Kalab et al., 2002, 2006) y se han probado y modelado sus propiedades en la nucleación y estabilización de MT (Caudron et al., 2005). Al igual que en interfase, este sistema proporciona un control espacial sobre la estabilidad de los complejos NTRs-carga. Las cargas son proteínas que contienen NLS y/o NES con funciones específicas relacionadas con el ensamblaje y la función del huso. Las proteínas NLS que desempeñan un papel en el ensamblaje del huso han sido denominadas SAFs (Spindle Assembly Factors).
El descubrimiento y la caracterización de la vía del RanGTP impulsó una reexaminación del modelo de Búsqueda y Captura para el ensamblaje del huso propuesto en 1986 (Kirschner y Mitchison, 1986). Este modelo postula que los MTs centrosómicos crecen y se encogen explorando el espacio citoplasmático hasta que un encuentro estocástico con un cinetocoro promueve su captura y fijación. Sin embargo, ahora se ha establecido claramente que las células animales privadas experimentalmente de sus centrosomas sí ensamblan un huso mitótico funcional (Debec et al., 1995; Khodjakov et al., 2000). Además, las simulaciones matemáticas sugirieron que el mecanismo de Búsqueda y Captura no podía explicar el corto tiempo de división observado en la mayoría de las células animales (Wollman et al., 2005). Al promover la nucleación y estabilización de los MT en la proximidad de los cromosomas, la vía del RanGTP favorece sin duda la captura de los MT por los cinetocoros, aumentando la eficiencia del mecanismo de Búsqueda y Captura. Sin embargo, el papel de la vía de RanGTP debe ir más allá de la captura de MT por los cinetocoros y la formación de fibras de cinetocoro (fibras K), ya que también promueve la organización de MT en ausencia de cromosomas, cinetocoros y fibras K (Carazo-Salas et al., 1999). La identificación de las dianas directas e indirectas de RanGTP en el citoplasma de la fase M es, por tanto, un paso esencial para comprender plenamente las diversas funciones que cumple esta vía durante la división celular.
Comprensión de la vía de RanGTP a través de la identificación y caracterización funcional de sus dianas
Se obtuvo una lectura directa del papel de RanGTP en el citoplasma de la fase M en extractos de huevos de Xenopus desprovistos de cromatina y centrosomas. La adición de RanGTP a estos extractos es, en efecto, suficiente para desencadenar la nucleación de MT, promover la estabilización de MT e inducir la organización de ensamblajes de MT denominados minihilos (Carazo-Salas et al., 1999, 2001). Por lo tanto, uno o más SAFs pueden estar involucrados en estos diferentes eventos.
Desde la identificación de los primeros SAFs en 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al, 2001; Clarke y Zhang, 2008; Meunier y Vernos, 2012), el número de proteínas controladas por RanGTP en mitosis ha ido creciendo lentamente y recientemente se han identificado varios SAFs novedosos (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier y Vernos, 2011; Samwer et al., 2013; Wilbur y Heald, 2013). Actualmente, 22 proteínas han sido validadas como SAFs (Tabla 1). Además, varias proteínas con funciones establecidas en varios aspectos del ensamblaje del huso son nucleares y, por lo tanto, podrían ser objetivos de la regulación de RanGTP (es decir, Kif4a/Klp1, Ino80, Reptin), pero otros estudios deben abordar esta posibilidad.

Tabla 1. Factores de ensamblaje del huso.
Interesantemente, la caracterización funcional de algunos de los SAFs está proporcionando conocimientos mecanísticos sobre las funciones de la vía de RanGTP en la célula en división. El mecanismo por el cual RanGTP promueve la nucleación de MT de novo en el citoplasma de la fase M fue descrito recientemente (Scrofani et al., 2015). Al liberar TPX2 de las importinas, RanGTP promueve su interacción con Aurora A y con un complejo RHAMM-NEDD1-γTURC (γTubulin Ring Complex). En este nuevo complejo la Aurora A activada fosforila a NEDD1, un requisito esencial para la nucleación de MT. Se demostró que otro SAF, Mel28, interactúa con el γTuRC y se propuso que desempeña un papel en la nucleación de MT dependiente de RanGTP (Yokoyama et al., 2014). Queda por establecer la posible cooperación de Mel28 con la vía dependiente de TPX2 descrita anteriormente.
La vía de RanGTP también contribuye a la maduración del centrosoma y a su actividad de ensamblaje de MT (Carazo-Salas et al., 2001). De hecho, se ha demostrado que dos SAFs, CDK11 y Mel28, favorecen el ensamblaje de MT en el centrosoma (Yokoyama et al., 2008, 2014).
La identificación y caracterización de otro SAF, MCRS1, ha revelado un mecanismo novedoso e importante para la regulación de la dinámica del extremo negativo de MT de la fibra K (Meunier y Vernos, 2011) y nuevos conocimientos sobre las funciones de la vía RanGTP en el ensamblaje del huso y la división celular (Meunier y Vernos, 2012). MCRS1, en complejo con miembros del complejo letal no específico modificador de la cromatina KAT8 (KANSL) (Meunier et al., 2015), se dirige al extremo negativo de las MT dependientes de RanGTP protegiéndolas de la despolimerización. Dentro del huso, MCRS1 también se asocia específicamente con los extremos negativos de las MT de la fibra K y regula su tasa de despolimerización, desempeñando un papel esencial en la dinámica de la fibra K y la alineación del cromosoma (Meunier y Vernos, 2011; Meunier et al., 2015). La asociación específica de MCRS1 con los MTs nucleados por la vía dependiente de RanGTP también sugiere que estos MTs tienen características específicas que los distinguen de los MTs nucleados por los centrosomas. Si esto resulta ser cierto, las MTs cromosómicas no serían simplemente un suministro local de MTs que favorecen un mecanismo eficiente de Búsqueda y Captura, sino que podrían proporcionar funcionalidades únicas esenciales requeridas para el ensamblaje y la función del huso bipolar (Meunier et al., 2015).
Recientemente se demostró que la kinesina despolimerizadora de MTs Kif2a está regulada por RanGTP en la mitosis, revelando un importante mecanismo para el escalamiento del huso al tamaño celular durante el desarrollo temprano de los embriones de Xenopus (Wilbur y Heald, 2013). Kif2a se mantiene inactiva por la importina α hasta el estadio 8 del desarrollo embrionario. A medida que la concentración soluble de importina α disminuye, Kif2a se libera y funciona como una despolimerasa de MT promoviendo el acortamiento del huso.
Aunque, la mayoría de los SAFs identificados hasta ahora se encontró que juegan un papel en las fases tempranas de la división celular, una serie de informes recientes indican que la vía de RanGTP tiene otras funciones esenciales no relacionadas directamente con el montaje del huso. De hecho, la caracterización del SAF ISWI sugiere funciones para la vía RanGTP durante la anafase (Yokoyama et al., 2009).
Múltiples líneas de investigación también indican que juega un papel en el posicionamiento del huso. De hecho, antes de la entrada en anafase, el gradiente de RanGTP restringe la localización del complejo LGN-NuMa a las zonas de la corteza celular más alejadas de los cromosomas, contribuyendo al control de la posición y orientación del huso (Kiyomitsu y Cheeseman, 2012).
Además, RanGTP también regula objetivos no relacionados con el MT. De hecho, controla la localización de Anillin y desencadena la elongación asimétrica de la membrana durante la anafase, definiendo el posicionamiento del huso en el centro de la célula en división (Silverman-Gavrila et al., 2008; Kiyomitsu y Cheeseman, 2012). Por último, durante la citocinesis la vía de RanGTP regula la actividad de la quinesina Kif14/Nabkin en el agrupamiento de la actina (Carleton et al., 2006; Samwer et al., 2013) y coordina el reensamblaje de la membrana nuclear y el CNP (Harel et al., 2003; Walther et al., 2003; Ciciarello et al, 2010; Roscioli et al., 2010; Forbes et al., 2015; Figura 1D).
Por lo tanto, está claro que la identificación y caracterización funcional de las dianas mitóticas de RanGTP está proporcionando nuevos conocimientos sobre el mecanismo del ensamblaje del huso y la división celular. Sin embargo, no está claro si quedan muchas o pocas dianas de RanGTP por identificar. Este número podría ser potencialmente alto, ya que el número de proteínas nucleares es del orden de cientos o miles (Dellaire et al., 2003), al menos un orden de magnitud por encima del número actual de dianas RanGTP conocidas en la célula en división (Tabla 1).
La mayoría de los estudios proteómicos destinados a identificar nuevos SAFs se han centrado en las importinas α1 y β1 (Nachury et al., 2001; Wiese et al., 2001; Yokoyama et al., 2008), que son dos de las importinas más abundantes en los extractos de huevos de Xenopus (Bernis et al., 2014; Wuhr et al., 2014). Sin embargo, existen otras cinco α-importinas y ocho β-importinas adicionales en humanos (Cautain et al., 2015).
Aunque todavía son escasos, algunos datos indican que, efectivamente, otras importinas también desempeñan un papel durante la división celular. Se demostró que la regulación por RanGTP de NuSAP depende de la importina-β1 y la importina-7 (Ribbeck et al., 2006) y la de Mel28, Nup107-160 y Nup98 de la importina-β1 y la transportina/importina-β2 (Lau et al., 2009). También se demostró que la transportina regula negativamente el ensamblaje del huso y el reensamblaje de la membrana nuclear y el CNP (Bernis et al., 2014). Sin embargo, no se han descrito factores mitóticos regulados exclusivamente por la importina-7 o la transportina.
La caracterización de las posibles dianas específicas de la transportina y, de forma más general, de las otras importinas α y β representa un campo abierto de exploración. Esto podría ser importante para entender la regulación de la vía de RanGTP, especialmente teniendo en cuenta que los patrones de expresión de las importinas cambian significativamente en diferentes etapas de desarrollo y tejidos (Hosokawa et al., 2008).
Regulación del sistema RanGTP durante la división celular
Además de las especificidades de las interacciones NTR-SAF, varios mecanismos pueden incidir directamente en la vía de RanGTP durante la división celular. Varios datos sugieren que el propio RCC1 es un componente clave bajo regulación fina. Las células humanas tienen tres isoformas de RCC1, que se expresan de forma específica para cada tejido (Hood y Clarke, 2007). Las isoformas difieren en su N-terminal, una región implicada en la unión de la importina y regulada por fosforilación, que se propuso que influye en la producción de RanGTP acoplada al cromosoma (Hood y Clarke, 2007; Li et al., 2007). Además, el nivel de expresión de RCC1 también varía en diferentes células y se correlaciona con la inclinación del gradiente de RanGTP (Hasegawa et al., 2013). Esto puede tener consecuencias importantes, ya que se propuso que la inclinación del gradiente de RanGTP determina la duración de la prometafase y la metafase, lo que a su vez puede ser relevante para la fidelidad de la segregación cromosómica (Silkworth et al., 2012; Hasegawa et al., 2013).
Otros mecanismos, como las modificaciones postraduccionales y el splicing alternativo también son estrategias potenciales para controlar el NLS de los SAF. Sin embargo, estos mecanismos afectarían más bien a una proteína concreta que a toda la vía de RanGTP.
Recientemente, se propuso un mecanismo alternativo para la regulación de los SAFs independientemente de RanGTP. La orientación de la proteína de Golgi GM130 a las membranas de Golgi fragmentadas en mitosis puede competir localmente con TPX2 de la unión de importina α1, favoreciendo así el ensamblaje de MT en las proximidades de los fragmentos de Golgi (Wei et al., 2015). Este mecanismo basado en la competencia podría ser otra estrategia para controlar localmente los SAFs secuestrados por las importinas.
El papel de otros componentes de la maquinaria de traslado núcleo-citoplásmico durante la mitosis
La unión de RanGTP a las exportinas estabiliza su interacción con las proteínas de carga NES. Se ha demostrado que la principal exportina, CRM1, está implicada en la orientación de las proteínas NES hacia el cinetocoro o los centrosomas. En el cinetocoro, CRM1 recluta el complejo RanBP2-RanGAP1-SUMO que es necesario para la interacción entre los MT y el cinetocoro (Arnaoutov et al., 2005). Sin embargo, todavía no está mecánicamente claro cómo este complejo favorece la interacción MT-cinetocoro (Forbes et al., 2015). CRM1 también promueve el reclutamiento de RanGAP1-RanBP2 al huso de una manera dependiente de RanGTP (Wu et al., 2013) y está involucrado en la fijación del Complejo Pasajero del Cromosoma al centrómero a través de su interacción directa con survivina (Knauer et al., 2006). También se ha demostrado que CRM1 promueve el reclutamiento de BRCA1 y pericentrina a los centrosomas mitóticos, promoviendo así la actividad de ensamblaje de MT de los centrosomas (Liu et al., 2009; Brodie y Henderson, 2012). Recientemente, se ha descubierto que el represor transcripcional Bach1 desempeña un papel en la alineación del brazo cromosómico durante la mitosis y que se excluye de los cromosomas durante la metafase de forma dependiente de CRM1 (Li et al., 2012).
Sin embargo, la importancia de estos eventos de orientación no está del todo clara desde el punto de vista mecánico (Yokoyama y Gruss, 2013). Un problema importante es que durante la mitosis el papel putativo de las interacciones mediadas por la exportina puede ser difícil de desenredar del de las interacciones mediadas por la importina, ya que implican proteínas que tienen tanto NES como NLS . No obstante, parece evidente que la regulación por RanGTP de CRM1 tiene varias funciones durante la mitosis y será interesante comprobar si otras exportinas son también importantes para los eventos mitóticos.
Conservación de la vía RanGTP en las células en división
En los últimos 15 años se ha estudiado la vía RanGTP en varios organismos y tipos celulares. Se ha encontrado que presenta variaciones en algunos detalles o que en algunos casos es innecesaria. De hecho, en algunos sistemas meióticos la contribución de la vía RanGTP parece no ser esencial. Por ejemplo, los espermatocitos de Drosophila pueden ensamblar el huso de la meiosis I en ausencia total de cromosomas (Bucciarelli et al., 2003). También se demostró que el ensamblaje del huso acentrosomal de la meiosis I en ovocitos de ratón y rana sólo depende parcialmente de la vía de RanGTP, aunque la vía es estrictamente esencial para el ensamblaje del huso durante la meiosis II (Dumont et al., 2007).
Incluso en los sistemas que dependen de RanGTP para el ensamblaje del huso hay algunas variaciones al menos a nivel de la maquinaria. Por ejemplo, TPX2, que es esencial en ranas y mamíferos, no está presente en Caenorhabditis elegans y Drosophila melanogaster. Aunque se han identificado proteínas con algunas de las características de TPX2 en estos sistemas (Ozlu et al., 2005; Goshima, 2011), carecen de características esenciales de TPX2, como un NLS que está en la base de la regulación de RanGTP. Este ejemplo indica que los efectores de la vía RanGTP podrían variar de un sistema a otro, aunque los principios principales probablemente se mantienen y conservan.
La vía RanGTP: Una vía de luz de luna con un papel en varias funciones celulares
La vía RanGTP es un ejemplo de una vía completa que cumple funciones esenciales en diferentes partes del ciclo celular. En interfase, orquesta el transporte núcleo-citoplásmico, mientras que en mitosis impulsa el ensamblaje del huso y, posteriormente, el reensamblaje de la membrana nuclear y el CNP (Figuras 1B-D). Las proteínas individuales que tienen diferentes funciones en diferentes momentos se definen como proteínas pluriempleadas (Jeffery, 1999). La vía de RanGTP podría ser, por tanto, un ejemplo de vía de pluriempleo.
La vía de RanGTP es particularmente interesante, porque muestra cómo la función de una proteína depende de su contexto: la mayoría de las SAFs tienen funciones nucleares y se mantienen separadas de las tubulinas y otras proteínas del citoesqueleto durante la interfase. Tras la NEBD, el contexto general cambia y las SAFs ejercen importantes funciones relacionadas con las MTs.
Algunos datos apuntan a una función de pluriempleo de la vía de RanGTP en la formación de los cilios y en el transporte al interior del cilio. Se ha demostrado que RanGTP controla la acumulación de Kif17 y retinis pigmentosa 2 hacia el cilioplasma (Dishinger et al., 2010; Hurd et al., 2011), donde se concentra RanGTP (Fan et al., 2011). El modelo de trabajo actual es que la vía de RanGTP orquesta el transporte de cargas que llevan una señal de localización de los cilios a través del complejo de poros de los cilios, que se ha propuesto que esté localizado en la base del cilio (Kee et al., 2012; Figura 1E). Sin embargo, se necesitan más estudios para entender cómo se establece el gradiente de RanGTP en los cilios y qué otras cargas transporta a los cilios.
Interesantemente, la vía de RanGTP luna también en las neuronas diferenciadas, donde muchos SAFs también tienen una función . Además, las importinas α y β se acumulan en el espacio sináptico dendrítico y tienen un papel en el transporte de cargas desde las sinapsis hasta el núcleo (Jordan y Kreutz, 2009; Panayotis et al., 2015). Por último, se ha demostrado que un mecanismo regulado por RanGTP está en juego en respuesta a las lesiones del nervio ciático (Hanz et al., 2003; Yudin et al., 2008; Figura 1F).
Conclusiones
La identificación del papel desempeñado por la vía RanGTP durante la división celular se produjo hace más de 15 años. Ahora sabemos que la vía de RanGTP tiene funciones adicionales y podría considerarse una vía pluriempleada que controla varios procesos celulares importantes (Figura 1). Durante la división celular impulsa mecanismos esenciales que empezamos a comprender gracias a la identificación y caracterización funcional de sus dianas directas. Sin embargo, aún quedan varias cuestiones abiertas por resolver. El número total de FAE es difícil de prever y, por tanto, no sabemos cuántos quedan por identificar. Además, la mayor parte de nuestros conocimientos actuales se limitan al papel de sólo algunos componentes de la maquinaria de transporte nucleo-citoplasmático. Por ejemplo, actualmente se sabe muy poco sobre el papel putativo en la división celular de las diferentes importinas presentes en la célula humana. Las importinas específicas pueden regular la actividad de nuevos SAF y sus diferentes patrones de expresión en distintos tipos de células y tejidos pueden proporcionar un mecanismo combinatorio relevante. También sabemos poco sobre el papel putativo de los componentes de la maquinaria de exportación en el ensamblaje del huso y en las demás funciones novedosas de la vía. Aunque hay datos que sugieren varios puntos de regulación de la propia vía, aún no están claras las consecuencias sobre la división celular y otros procesos, ni cómo puede adaptarse a los requisitos de los distintos tipos de células o tejidos. El estudio de la vía de RanGTP proporcionará, sin duda, nuevos e interesantes conocimientos en los próximos años, revelando algunos mecanismos esenciales para la organización y la función celular.
Contribuciones de los autores
IV y TC escribieron el manuscrito, TC preparó la tabla y la figura.
Financiación
TC fue apoyado por el Ministerio de Economía y Competitividad (MINECO) a través de la beca FPI BES-2010-031355. El trabajo en el laboratorio de Vernos fue apoyado por las becas del ministerio español BFU2009-10202 y BFU2012-37163, cofinanciadas por el Fondo Europeo de Desarrollo Regional (FEDER/FEDER). También reconocemos el apoyo del Ministerio de Economía y Competitividad español, «Centro de Excelencia Severo Ochoa 2013-2017», SEV-2012-0208.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Queremos agradecer a los miembros del laboratorio Vernos por las discusiones críticas sobre los diversos aspectos de la vía de RanGTP.
Abreviaturas
γTuRC, complejo de anillos de γTubulina; K-Fiber, fibra de cinetocoro; KANLS, complejo letal inespecífico asociado a KAT8; MT, microtúbulos; NEBD, rotura de la envoltura nuclear; NES, señal de exportación nuclear; NLS, señal de localización nuclear; NPC, complejo de poros nucleares; NTR, receptor de transporte nuclear; RanGAP, proteína activadora de la GTPasa Ran; RanGEF, factor de intercambio de nucleótidos de guanina Ran; SAF, factor de ensamblaje del huso.
Wiese, C. (2001). Papel de la importina-beta en el acoplamiento de Ran a las dianas descendentes en el ensamblaje de los microtúbulos. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar