- Perspectiva Histórica sobre a Estrada de Montagem do MT Dependente da Cromatina
- O Transporte Nucleo-citoplasmático e o Pequeno Ran de GTPase GTPase
- O caminho RanGTP durante a divisão celular
- O entendimento do caminho RanGTP através da Identificação e Caracterização Funcional de seus Alvos
- Regulação do sistema RanGTP durante a divisão celular
- O papel dos Outros Componentes da Máquina de Corte Núcleo Citoplasmático durante a Mitose
- Conservação do caminho de RanGTP em Células Divididas
- A via RanGTP: Um caminho de iluminação da lua com um papel em várias funções celulares
- Conclusões
- Contribuições dos autores
- Funding
- Conflict of Interest Statement
- Confirmações de reconhecimento
- A abreviações
Perspectiva Histórica sobre a Estrada de Montagem do MT Dependente da Cromatina
As primeiras dicas da existência de um mecanismo de montagem do MT dependente do cromossoma na célula divisora foram obtidas nos anos 1970-1980, quando vários grupos relataram que a nucleação do MT ocorreu perto ou nos cine-tochores (McGill e Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) e uma estrutura semelhante a um fuso formado em torno de ADN lambda injectado em metafase prendeu ovos de Xenopus (Karsenti et al., 1984). Em 1996, foi demonstrado que contas revestidas de DNA desencadeavam a formação do fuso bipolar quando incubadas em extratos de ovos de Xenopus (Heald et al., 1996), fornecendo mais apoio à idéia de que a cromatina carrega toda a informação necessária para direcionar a montagem e organização do MT no citoplasma da fase M. Pouco tempo depois, a identificação do pequeno Ran GTPase como condutor da montagem da MT dependente da cromatina no citoplasma da fase M proporcionou um grande avanço para compreender o mecanismo subjacente (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde e Zheng, 1999; Zhang et al., 1999). Hoje, sabemos que os cromossomas conduzem a montagem e organização do MT em um fuso bipolar de forma dependente de RanGTP na maioria das células (Karsenti e Vernos, 2001; Rieder, 2005).
Nesta mini-revista descreveremos brevemente como o sistema RanGTP regula o fechamento nucleo-citoplasmático de componentes em interfase e, após o NEBD, a atividade e/ou localização de fatores específicos para conduzir a montagem do fuso. Vamos rever brevemente o nosso conhecimento actual sobre a identidade e função dos factores regulados por RanGTP e os recentes avanços na compreensão dos novos mecanismos regulados por RanGTP. Finalmente, daremos uma visão geral da regulação do próprio caminho do RanGTP durante a mitose, sua conservação em diferentes organismos e tipos de células, e seu papel em outras funções celulares. Para informações adicionais, remetemos o leitor a excelentes revisões (Ciciarello et al., 2007; O’Connell e Khodjakov, 2007; Clarke e Zhang, 2008; Kalab e Heald, 2008; Roscioli et al., 2010; Forbes et al, 2015).
O Transporte Nucleo-citoplasmático e o Pequeno Ran de GTPase GTPase
Células eucarióticas são compartimentadas e possuem sistemas de transporte específicos para a comunicação entre o citoplasma e as diferentes organelas ligadas à membrana. O sistema de transporte nucleo-citoplasmático é essencial para conectar funcionalmente a transcrição do genoma que ocorre dentro do núcleo, com a tradução proteica que ocorre no citoplasma (Figuras 1A,B). O transporte das moléculas dentro e fora do núcleo ocorre através do complexo de poros nucleares (NPC), um grande complexo proteico de ~60 MDa inserido na membrana nuclear (Sorokin et al., 2007). Pequenas cargas (< 40 kDa) se difundem rapidamente através do NPC. Ao invés disso, proteínas maiores que 40 kDa requerem um transporte ativo através do NPC que envolve receptores solúveis de transporte nuclear (NTRs) que pertencem à família de proteínas carioferina-β. Os NTRs que facilitam o transporte de proteínas de carga para o núcleo são chamados de importins e interagem com sua carga através de um sinal de localização nuclear (NLS) rico em resíduos básicos. NTRs que facilitam a exportação de proteínas para fora do núcleo são chamadas de exportins e interagem com sua carga através de um sinal de exportação nuclear (NES) rico em resíduos hidrofóbicos, como a leucina. A importação de karyopherin-β β1 frequentemente interage com a carga através de um adaptador da família de importação α (Sorokin et al., 2007). A importin α liga-se diretamente ao NLS da proteína da carga e à importin β1 através de um domínio IBB (importin β binding domain), levando à formação de um complexo trimérico.
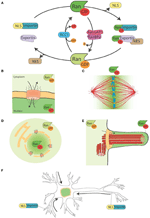
Figura 1. O sistema Ran e as suas funções de iluminação da lua. (A) Representação esquemática do sistema Ran para o controle espacial de NLS e NES carregando proteínas. Nas células Ran é encontrado em duas formas, RanGTP (verde), e RanGDP (verde claro). RCC1 (azul claro) promove a troca do PIB para GTP, enquanto RanGAP1-RanBP2 (em rosa e roxo) promove a hidrólise do GTP para o PIB. RanGTP liga-se às importações (verde turquesa) e exportações (púrpura claro). As exportinas em complexo com RanGTP podem associar-se às proteínas NES (em castanho). Por outro lado, a ligação de RanGTP às importadoras desencadeia a sua dissociação das proteínas NLS (amarelo). (B) Durante a interfase, o sistema Ran controla o fechamento nucleo-citoplasmático das proteínas, pois RanGTP é predominante no nucleo-plasma e RanGDP é predominante no citoplasma (Sorokin et al., 2007). (C) Durante a mitose a associação do RCC1, o RanGEF, com os cromossomos, define um gradiente de concentrações de RanGTP que promove a liberação de SAFs e nucleação de MT ao redor da cromatina. O sistema RanGEF é convertido em um caminho para a montagem e organização do MT que é essencial para a montagem do fuso mitótico. A via RanGTP depende do estabelecimento de um gradiente de concentração de RanGTP que atinge o pico ao redor dos cromossomos (Kalab et al., 2002; Caudron et al., 2005). (D) No final da mitose, o sistema Ran também regula a membrana nuclear e a remontagem do NPC, controlando a fusão da membrana e liberando os componentes do NPC (Walther et al., 2003; Harel et al., 2003). (E) Em células ciliadas, RanGTP se acumula no ciliioplasma e promove o transporte e acúmulo de Kif17 e retinis pigmentosa 2 para o ciliioplasma (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) Nos neurónios muitos SAFs têm uma função. Além disso, os SAFs localizam-se no espaço sináptico dendrítico e estão envolvidos no transporte de cargas para o núcleo (Jordan e Kreutz, 2009; Panayotis et al., 2015). O sistema Ran também é ativo no axônio do nervo ciático, onde, quando há lesão, as importâncias promovem o transporte de cargas em direção ao corpo celular do neurônio (Hanz et al., 2003; Yudin et al., 2008).
NTRs associam-se com o pequeno GTPase Ran que atua como um interruptor molecular. Na sua forma ligada ao GTP, Ran (RanGTP) interage com as proteínas karyopherin-β com alta afinidade, enquanto que se dissocia na sua forma ligada ao PIB (RanGDP). A ligação de RanGTP a importins e exportins tem conseqüências muito diferentes: estabiliza a interação exportin-cargo enquanto desestabiliza a interação importin-cargo (Figura 1A).
O RanGEF (fator de troca de nucleotídeos da guanina) RCC1 associa-se com a cromatina dentro do núcleo, enquanto RanGAP (proteína ativadora da GTPase) é citoplasmática. Como consequência, a forma predominante de Ran no núcleo é ligada ao GTP, enquanto que no citoplasma é ligada ao PIB. Assim, as proteínas NLS transportadas para o núcleo por importâncias são liberadas e se acumulam no nucleoplasma, enquanto as proteínas NES em complexo com exportin-RanGTP são transportadas para fora do núcleo (Figuras 1A,B).
Embora o transporte citoplasmático do núcleo não seja mais necessário quando uma célula entra em mitose, sua complexa maquinaria molecular é reciclada para promover a montagem da MT ao redor da cromatina e para direcionar a organização do fuso bipolar (Clarke e Zhang, 2008).
O caminho RanGTP durante a divisão celular
Como o RCC1 permanece associado à cromatina após o NEBD, o RanGTP é altamente enriquecido na proximidade dos cromossomos. Como RanGTP se afasta da cromatina, RanGAP no citoplasma o converte em RanGDP (Figura 1C). O gradiente resultante foi visualizado diretamente em células e extratos de óvulos de Xenopus (Kalab et al., 2002, 2006) e suas propriedades na nucleação e estabilização da MT testadas e modeladas (Caudron et al., 2005). Como na interfase, este sistema proporciona um controle espacial sobre a estabilidade dos complexos de NTRs-carga. As cargas são NLS e/ou NES contendo proteínas com funções específicas relacionadas com a montagem e função do fuso. As proteínas NLS com um papel na montagem do fuso foram nomeadas SAFs (Spindle Assembly Factors).
A descoberta e caracterização da via RanGTP levou a um re-exame do modelo de Busca e Captura para montagem do fuso proposto em 1986 (Kirschner e Mitchison, 1986). Este modelo postula que as MTs centrosomais crescem e encolhem explorando o espaço citoplasmático até que um encontro estocástico com um cinétoco promove sua captura e fixação. No entanto, está agora claramente estabelecido que células animais experimentalmente privadas de seus centrosomas montam um fuso mitótico funcional (Debec et al., 1995; Khodjakov et al., 2000). Além disso, simulações matemáticas sugeriram que o mecanismo de Busca e Captura não poderia explicar o curto tempo de divisão observado na maioria das células animais (Wollman et al., 2005). Ao promover a nucleação e estabilização do MT na proximidade dos cromossomos, o caminho do RanGTP certamente favorece a captura do MT pelos cinetócitos, aumentando a eficiência do mecanismo de Busca e Captura. Entretanto, o papel da via RanGTP deve ir além da captura da MT pelos cinétochores e da formação da fibra K, uma vez que também promove a organização da MT na ausência de cromossomos, cinétochores e fibras K (Carazo-Salas et al., 1999). A identificação dos alvos diretos e indiretos do RanGTP no citoplasma da fase M é, portanto, um passo essencial para compreender plenamente os diversos papéis que este caminho cumpre durante a divisão celular.
O entendimento do caminho RanGTP através da Identificação e Caracterização Funcional de seus Alvos
Uma leitura direta do papel do RanGTP no citoplasma da fase M foi obtida em extratos de ovos de Xenopus desprovidos de cromatina e centrosomas. A adição de RanGTP a esses extratos é de fato suficiente para desencadear a nucleação do MT, promover a estabilização do MT e induzir a organização de montagens de MT denominadas mini-esferas (Carazo-Salas et al., 1999, 2001). Portanto, um ou mais SAFs podem estar envolvidos nesses diferentes eventos.
Desde a identificação dos primeiros SAFs em 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al., 2001; Clarke e Zhang, 2008; Meunier e Vernos, 2012), o número de proteínas controladas por RanGTP na mitose tem crescido lentamente e vários novos SAFs foram identificados recentemente (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier e Vernos, 2011; Samwer et al., 2013; Wilbur e Heald, 2013). Atualmente, 22 proteínas foram validadas como SAFs (Tabela 1). Além disso, várias proteínas com papéis estabelecidos em vários aspectos da montagem de fusos são nucleares e, portanto, poderiam ser alvos para a regulação de RanGTP (isto é, Kif4a/Klp1, Ino80, Reptin), mas estudos adicionais devem abordar esta possibilidade.

Tabela 1. Fatores de montagem do fuso.
Interessantemente, a caracterização funcional de alguns dos SAFs está fornecendo insights mecanicistas sobre as funções do caminho de RanGTP na célula divisora. O mecanismo pelo qual RanGTP promove a nucleação de MT de novo no citoplasma da fase M foi recentemente descrito (Scrofani et al., 2015). Ao liberar TPX2 de importins, RanGTP promove sua interação com Aurora A e com um complexo RHAMM-NEDD1-γTURC (γTubulin Ring Complex). Neste novo complexo o Aurora A ativado fosforilatos NEDD1, um requisito essencial para a nucleação de MT. Outro SAF, Mel28, foi mostrado para interagir com o γTuRC e foi proposto para desempenhar um papel na nucleação de MT dependente de RanGTP (Yokoyama et al., 2014). A potencial cooperação do Mel28 com a via dependente do TPX2 descrita acima ainda não foi estabelecida.
A via do RanGTP também contribui para a maturação do centrooma e sua atividade de montagem da MT (Carazo-Salas et al., 2001). De fato, dois SAFs, CDK11 e Mel28 foram mostrados para favorecer a montagem do MT no centrossoma (Yokoyama et al., 2008, 2014).
A identificação e caracterização de outro SAF, MCRS1, revelou um novo e importante mecanismo para a regulação da dinâmica do MT menos-fibra K (Meunier e Vernos, 2011) e novos insights sobre os papéis da via RanGTP na montagem do fuso e divisão celular (Meunier e Vernos, 2012). MCRS1, em complexo com membros do modificador de cromatina KAT8 associado ao complexo não específico letal (KANSL) (Meunier et al., 2015), é direcionado para a extremidade negativa das MTs dependentes de RanGTP, protegendo-as da despolimerização. Dentro do fuso MCRS1 também se associa especificamente às MTs não dependentes de fibra K e regula sua taxa de despolimerização desempenhando um papel essencial na dinâmica da fibra K e no alinhamento cromossômico (Meunier e Vernos, 2011; Meunier et al., 2015). A associação específica de MCRS1 com as MTs nucleadas pela via dependente de RanGTP também sugere que estas MTs têm características específicas que as distinguem das MTs nucleadas pelos centrosomas. Se isto se verificar, as MTs cromossômicas não seriam apenas uma fonte local de MTs favorecendo um mecanismo eficiente de Busca e Captura, mas poderiam fornecer funcionalidades únicas essenciais necessárias para a montagem e função do fuso bipolar (Meunier et al, 2015).
Recentemente o MT despolimerizante da kinesina Kif2a mostrou ser regulado por RanGTP em mitose, revelando um mecanismo importante para a escala do fuso ao tamanho celular durante o desenvolvimento precoce dos embriões Xenopus (Wilbur e Heald, 2013). O Kif2a é mantido inativo pela importin α até o estágio 8 do desenvolvimento embrionário. Como a concentração solúvel da importina α diminui, o Kif2a é liberado e funciona como uma despolimerase MT promovendo o encurtamento do fuso.
Embora, a maioria dos SAFs identificados até agora tenham desempenhado um papel nas fases iniciais da divisão celular, vários relatórios recentes indicam que a via RanGTP tem outros papéis essenciais não diretamente relacionados à montagem do fuso. De fato, a caracterização do SAF ISWI sugere funções para o caminho RanGTP durante a anáfase (Yokoyama et al., 2009).
Múltiplas linhas de pesquisa também indicam que ele desempenha um papel no posicionamento do fuso. De fato, antes da entrada na anáfase, o gradiente RanGTP restringe a localização do complexo LGN-NuMa a áreas de córtex celular mais afastadas dos cromossomos, contribuindo para o controle da posição e orientação do fuso (Kiyomitsu e Cheeseman, 2012).
Além disso, RanGTP também regula alvos não relacionados ao TM. De fato, ele controla a localização de Anillin e aciona o alongamento assimétrico da membrana durante a anáfase, definindo o posicionamento do fuso no centro da célula divisora (Silverman-Gavrila et al., 2008; Kiyomitsu e Cheeseman, 2012). Finalmente, durante a citocinese, a via RanGTP regula a atividade do kinesin Kif14/Nabkin no agrupamento de actin (Carleton et al., 2006; Samwer et al., 2013) e coordena a membrana nuclear e a remontagem do NPC (Harel et al., 2003; Walther et al., 2003; Ciciarello et al, 2010; Roscioli et al., 2010; Forbes et al., 2015; Figura 1D).
Está, portanto, claro que a identificação e caracterização funcional dos alvos mitóticos RanGTP está fornecendo novos insights sobre o mecanismo de montagem do fuso e divisão celular. Entretanto, não está claro se muitos ou apenas alguns alvos de RanGTP ainda não foram identificados. Este número poderia ser potencialmente alto, pois o número de proteínas nucleares é da ordem de centenas ou milhares (Dellaire et al., 2003), pelo menos uma ordem de magnitude acima do número atual de alvos RanGTP conhecidos na célula divisora (Tabela 1).
A maior parte dos estudos proteômicos destinados à identificação de novos SAFs tem se concentrado em importins α1 e β1 (Nachury et al, 2001; Wiese et al., 2001; Yokoyama et al., 2008), que são duas das importâncias mais abundantes em extratos de ovos de Xenopus (Bernis et al., 2014; Wuhr et al., 2014). Entretanto, há cinco importâncias adicionais α-importins e oito adicionais β-importins in humans (Cautain et al., 2015).
Embora ainda sejam escassos, alguns dados indicam que de fato outras importins também desempenham um papel durante a divisão celular. O regulamento RanGTP do NuSAP mostrou depender de importina-β1 e importina-7 (Ribbeck et al., 2006) e o de Mel28, Nup107-160 e Nup98 sobre importina-β1 e transportin/importina-β2 (Lau et al., 2009). Transportin também foi especificamente mostrado para regular negativamente a montagem do fuso e membrana nuclear e a remontagem do NPC (Bernis et al., 2014). Entretanto, não há fatores mitóticos descritos exclusivamente regulados por importin-7 ou transportin.
A caracterização de possíveis alvos específicos de transporte e, mais genericamente, dos outros importins α e β representa um campo aberto para exploração. Isto pode ser importante para compreender a regulação do caminho RanGTP, especialmente considerando que os padrões de expressão das importações mudam significativamente em diferentes estágios de desenvolvimento e tecidos (Hosokawa et al., 2008).
Regulação do sistema RanGTP durante a divisão celular
Além das especificidades das interações NTR-SAF, vários mecanismos podem afetar diretamente o caminho RanGTP durante a divisão celular. Vários dados sugerem que o próprio RCC1 é um componente chave sob regulação fina. As células humanas têm três isoformas de RCC1, que são expressas de uma forma específica do tecido (Hood e Clarke, 2007). As isoformas diferem no seu termo N, uma região envolvida na ligação das importações e regulada pela fosforilação, que foi proposta para influenciar a produção de RanGTP cromossomática (Hood e Clarke, 2007; Li et al., 2007). Além disso, o nível de expressão do RCC1 também varia em diferentes células e se correlaciona com a inclinação do gradiente RanGTP (Hasegawa et al., 2013). Isto pode ter consequências importantes, pois foi proposto que a inclinação do gradiente RanGTP determina o comprimento da prometafase e metafase que, por sua vez, pode ser relevante para a fidelidade da segregação cromossômica (Silkworth et al., 2012; Hasegawa et al., 2013).
Outros mecanismos, tais como modificações pós-tradução e emendas alternativas também são estratégias potenciais para controlar o NLS dos SAFs. No entanto, estes mecanismos preferem afetar uma determinada proteína do que todo o caminho de RanGTP.
Recentemente, um mecanismo alternativo para a regulação dos SAFs independentemente de RanGTP foi proposto. O direcionamento da proteína Golgi GM130 para membranas Golgi fragmentadas em mitose pode competir localmente TPX2 a partir da ligação de importação α1, favorecendo assim a montagem de MT na vizinhança de fragmentos Golgi (Wei et al., 2015). Este mecanismo baseado na competição poderia ser outra estratégia para controlar localmente os SAFs sequestrados por importins.
O papel dos Outros Componentes da Máquina de Corte Núcleo Citoplasmático durante a Mitose
A ligação de RanGTP para exportação de proteínas estabiliza sua interação com as proteínas de NES-carga. A principal exportina, CRM1, demonstrou estar envolvida no direcionamento das proteínas NES para o cinétocoleo ou para os centrosomas. No kinetochore, CRM1 recruta o complexo RanBP2-RanGAP1-SUMO que é necessário para a interação entre as MTs e o kinetochore (Arnaoutov et al., 2005). Entretanto, ainda não está mecanisticamente claro como este complexo favorece a interação MT-kinetochore (Forbes et al., 2015). O CRM1 também promove o recrutamento do RanGAP1-RanBP2 para o fuso de forma dependente do RanGTP (Wu et al., 2013) e está envolvido em amarrar o Complexo Cromossômico de Passageiros ao centrômero através de sua interação direta com os sobreviventes (Knauer et al., 2006). O CRM1 também tem demonstrado promover o recrutamento de BRCA1 e pericentrina para os centrossomas mitóticos, promovendo assim a atividade de montagem de MT dos centromas (Liu et al., 2009; Brodie e Henderson, 2012). Recentemente, descobriu-se que o repressor transcripcional Bach1 desempenhou um papel no alinhamento dos braços cromossômicos durante a mitose e foi excluído dos cromossomos durante a metáfase de forma dependente do CRM1 (Li et al., 2012).
No entanto, o significado desses eventos de direcionamento não é totalmente claro mecanisticamente (Yokoyama e Gruss, 2013). Um grande problema é que durante a mitose o papel putativo das interações mediadas de exportação pode ser difícil de desvincular das interações mediadas de importação, já que elas envolvem proteínas que têm tanto NES quanto NLS . Entretanto, parece evidente que a regulação de RanGTP do CRM1 tem vários papéis durante a mitose e será interessante testar se outras exportinas também são importantes para eventos mitóticos.
Conservação do caminho de RanGTP em Células Divididas
Nos últimos 15 anos o caminho de RanGTP tem sido estudado em vários organismos e tipos de células. Verificou-se que apresenta variações em alguns detalhes ou, em alguns casos, é desnecessário. De fato, em alguns sistemas meióticos a contribuição do caminho de RanGTP parece não ser essencial. Por exemplo, os espermatócitos de Drosophila podem montar o fuso da meiose I na ausência completa de cromossomos (Bucciarelli et al., 2003). A montagem do fuso acentrossomal da meiose I em camundongos e rãs oócitos também foi mostrado como sendo apenas parcialmente dependente da via RanGTP, embora a via seja estritamente essencial para a montagem do fuso durante a meiose II (Dumont et al., 2007).
Even em sistemas que dependem de RanGTP para a montagem do fuso existem algumas variações pelo menos ao nível da maquinaria. Por exemplo, o TPX2, que é essencial em rãs e mamíferos, não está presente em Caenorhabditis elegans e Drosophila melanogaster. Embora tenham sido identificadas proteínas com algumas das características do TPX2 nestes sistemas (Ozlu et al., 2005; Goshima, 2011), faltam-lhes características essenciais do TPX2, como um NLS que está na base da regulação de RanGTP. Este exemplo indica que os efetores da via RanGTP podem variar de sistema para sistema, embora os princípios principais sejam provavelmente mantidos e conservados.
A via RanGTP: Um caminho de iluminação da lua com um papel em várias funções celulares
O caminho RanGTP é um exemplo de um caminho inteiro que realiza funções essenciais em diferentes partes do ciclo da célula. Na interfase, ele orquestra o transporte nucleo-citoplasmático, enquanto na mitose ele aciona a montagem do fuso e posteriormente a remontagem da membrana nuclear e do NPC (Figuras 1B-D). As proteínas individuais que têm diferentes funções em diferentes momentos são definidas como proteínas do luar (Jeffery, 1999). A via RanGTP poderia, portanto, ser um exemplo de uma via de iluminação da lua.
A via RanGTP é particularmente interessante, porque mostra como a função de uma proteína depende do seu contexto: a maioria dos SAFs tem funções nucleares e são mantidos separados de tubulinas e outras proteínas do citoesqueleto durante a interfase. No NEBD, o contexto geral muda e os SAFs exercem funções importantes relacionadas ao MTs.
Alguns dados apontam para uma função de luar da via RanGTP na formação de cílios e no transporte para o cílio. RanGTP demonstrou controlar o acúmulo de Kif17 e retinis pigmentosa 2 no ciloplasma (Dishinger et al., 2010; Hurd et al., 2011), onde se concentra RanGTP (Fan et al., 2011). O modelo de trabalho atual é que a via RanGTP orquestra o transporte de cargas portadoras de um sinal de localização de cílios através do complexo de poros cílios, que foi proposto para ser localizado na base do cilo (Kee et al., 2012; Figura 1E). Entretanto, estudos adicionais são necessários para entender como o gradiente de RanGTP é estabelecido em cílios e que outras cargas ele transporta para os cílios.
Interessantemente, o caminho de RanGTP também é feito por luzes da lua em neurônios diferenciados, onde muitos SAFs também têm uma função . Além disso, os importins α e β acumulam no espaço sináptico dendrítico e têm um papel no transporte de cargas das sinapses para o núcleo (Jordan e Kreutz, 2009; Panayotis et al., 2015). Finalmente, um mecanismo regulado por RanGTP demonstrou estar em jogo em resposta às lesões do nervo ciático (Hanz et al., 2003; Yudin et al., 2008; Figura 1F).
Conclusões
A identificação do papel desempenhado pela via RanGTP durante a divisão celular ocorreu há mais de 15 anos. Sabemos agora que o caminho de RanGTP tem funções adicionais e pode ser considerado um caminho de luar controlando vários processos celulares importantes (Figura 1). Durante a divisão das células, ele dirige mecanismos essenciais que começamos a entender graças à identificação e caracterização funcional de seus alvos diretos. Entretanto, várias questões em aberto ainda precisam ser abordadas. O número total de SAFs é difícil de prever e, portanto, não sabemos quantos ainda restam a serem identificados. Além disso, a maior parte dos nossos conhecimentos actuais limita-se ao papel de apenas alguns componentes das máquinas de transporte do núcleo citoplasmático. Por exemplo, muito pouco se sabe actualmente sobre o papel putativo na divisão celular das diferentes importâncias presentes na célula humana. Importâncias específicas podem regular a atividade dos novos SAFs e seus diferentes padrões de expressão em diferentes tipos celulares e tecidos podem fornecer um mecanismo combinatório relevante. Também sabemos pouco sobre o papel putativo dos componentes das máquinas de exportação na montagem do fuso e nas outras novas funções do caminho. Embora existam dados que sugerem vários pontos de regulação do próprio caminho, as consequências sobre a divisão celular e outros processos ainda não são claras, nem como ele pode ser adaptado às exigências dos diferentes tipos de células ou tecidos. O estudo do caminho do RanGTP certamente fornecerá novas e excitantes perspectivas nos próximos anos, revelando alguns mecanismos essenciais para a organização e função celular.
Contribuições dos autores
IV e TC escreveu o manuscrito, TC preparou a tabela e figura.
Funding
TC foi apoiado pelo Ministério da Economia e Competitividade da Espanha (MINECO) através da bolsa FPI BES-2010-031355. O trabalho no laboratório de Vernos foi apoiado pelo Ministério espanhol BFU2009-10202 e BFU2012-37163, co-financiado pelo Fundo Europeu de Desenvolvimento Regional (FEDER/FEDER). Também reconhecemos o apoio do Ministério da Economia e Competitividade espanhol, “Centro de Excelencia Severo Ochoa 2013-2017”, SEV-2012-0208.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Confirmações de reconhecimento
Queremos agradecer aos membros do laboratório de Vernos pelas discussões críticas sobre os vários aspectos do caminho do RanGTP.
A abreviações
γTuRC, γTubulin Complexo de Anel; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-complexo letal não específico; MT, Microtubo; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Sinal de Localização Nuclear; NPC, Complexo de Poros Nucleares; NTR, Receptor de Transporte Nuclear; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine Nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Papel da importação-beta no acoplamento Ran a alvos a jusante na montagem de microtubos. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar