- Historical Perspective on the Chromatin Dependent MT Assembly Pathway
- Transportul nucleo-citoplasmatic și mica GTPază Ran
- Calea RanGTP în timpul diviziunii celulare
- Înțelegerea căii RanGTP prin identificarea și caracterizarea funcțională a țintelor sale
- Reglarea sistemului RanGTP în timpul diviziunii celulare
- Rolul altor componente ale mașinăriei de navetă nucleo-citoplasmatică în timpul mitozei
- Conservarea căii RanGTP în celulele în diviziune
- The RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
- Concluzii
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
- Recunoștințe
- Abbreviații
Historical Perspective on the Chromatin Dependent MT Assembly Pathway
Primul indiciu al existenței unui mecanism de asamblare a MT dependent de cromozom în celula în diviziune a fost obținut în anii 1970-1980, când mai multe grupuri au raportat că nuclearea MT are loc în apropierea sau la kinetocore (McGill și Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) și o structură asemănătoare unui fus s-a format în jurul ADN lambda injectat în ouăle de Xenopus arestate în metafază (Karsenti et al., 1984). În 1996, s-a demonstrat că bilele acoperite cu ADN declanșează formarea fusului bipolar atunci când sunt incubate în extracte de ouă de Xenopus (Heald et al., 1996), oferind un sprijin suplimentar ideii că cromatina poartă toate informațiile necesare pentru a direcționa asamblarea și organizarea MT în citoplasma din faza M. La scurt timp după aceea, identificarea micii GTPaze Ran ca motor al asamblării MT dependente de cromatină în citoplasma fazei M a reprezentat o descoperire majoră pentru înțelegerea mecanismului de bază (Carazo-Salas și colab., 1999; Kalab și colab., 1999; Ohba și colab., 1999; Wilde și Zheng, 1999; Zhang și colab., 1999). Astăzi, știm că cromozomii conduc asamblarea și organizarea MT într-un fus bipolar într-o manieră dependentă de RanGTP în majoritatea celulelor (Karsenti și Vernos, 2001; Rieder, 2005).
În această mini-revizuire vom descrie pe scurt modul în care sistemul RanGTP reglează naveta nucleo-citoplasmatică a componentelor în interfază și, după NEBD, activitatea și/sau localizarea unor factori specifici pentru a conduce asamblarea fusului. Vom trece în revistă pe scurt cunoștințele noastre actuale privind identitatea și funcția factorilor reglați de RanGTP și progresele recente în înțelegerea mecanismelor noi reglementate de RanGTP. În cele din urmă, vom oferi o prezentare generală a reglementării căii RanGTP în sine în timpul mitozei, a conservării sale în diferite organisme și tipuri de celule și a rolului său în alte funcții celulare. Pentru informații suplimentare, trimitem cititorul la recenzii excelente (Ciciarello și colab., 2007; O’Connell și Khodjakov, 2007; Clarke și Zhang, 2008; Kalab și Heald, 2008; Roscioli și colab., 2010; Forbes și colab, 2015).
Transportul nucleo-citoplasmatic și mica GTPază Ran
Celele eucariote sunt compartimentate și au sisteme de transport specifice pentru comunicarea între citoplasmă și diferitele organite legate de membrană. Sistemul de transport nucleo-citoplasmatic este esențial pentru a conecta funcțional transcripția genomului, care are loc în nucleu, cu traducerea proteinelor care are loc în citoplasmă (figurile 1A,B). Transportul de molecule în și din nucleu are loc prin intermediul complexului porului nuclear (NPC), un complex proteic mare de ~60 MDa inserat în membrana nucleară (Sorokin et al., 2007). Sarcinile mici (< 40 kDa) difuzează rapid prin NPC. În schimb, proteinele mai mari de 40 kDa necesită un transport activ prin NPC care implică receptori solubili de transport nuclear (NTR) care aparțin familiei de proteine carioferină-β. NTR care facilitează transportul proteinelor încărcătură în nucleu se numesc importine și interacționează cu încărcătura lor prin intermediul unui semnal de localizare nucleară (NLS) bogat în reziduuri bazice. NTR care facilitează exportul de proteine din nucleu se numesc exportine și interacționează cu încărcătura lor printr-un semnal de export nuclear (NES) bogat în reziduuri hidrofobe, cum ar fi leucina. Importina β1 a carioferinei-β interacționează adesea cu încărcătura prin intermediul unui adaptor din familia importinei α (Sorokin et al., 2007). Importina α se leagă direct de NLS al proteinei cargo și de importina β1 prin intermediul unui domeniu IBB (domeniul de legare a importinei β), ceea ce duce la formarea unui complex trimeric.
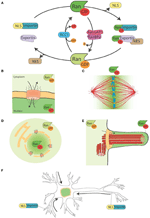
Figura 1. Sistemul Ran și funcțiile sale moonlighting. (A) Reprezentare schematică a sistemului Ran pentru controlul spațial al proteinelor purtătoare de NLS și NES. În celule, Ran se găsește în două forme, RanGTP (verde) și RanGDP (verde deschis). RCC1 (albastru deschis) promovează schimbul de GDP în GTP, în timp ce RanGAP1-RanBP2 (în roz și violet) promovează hidroliza GTP în GDP. RanGTP se leagă de importine (verde turcoaz) și de exportine (violet deschis). Exportinele în complex cu RanGTP se pot asocia cu proteinele NES (în maro). Pe de altă parte, legarea RanGTP la importine declanșează disocierea acestora de proteinele NLS (galben). (B) În timpul interfazei, sistemul Ran controlează naveta nucleo-citoplasmatică a proteinelor, deoarece RanGTP este predominant în nucleoplasmă, iar RanGDP este predominant în citoplasmă (Sorokin et al., 2007). (C) În timpul mitozei, asocierea lui RCC1, RanGEF, cu cromozomii definește un gradient de concentrații de RanGTP care promovează eliberarea SAF-urilor și nuclearea MT în jurul cromatinei. Sistemul Ran se transformă într-o cale de asamblare și organizare a MT care este esențială pentru asamblarea fusului mitotic. Calea RanGTP depinde de stabilirea unui gradient de concentrație de RanGTP care atinge un vârf în jurul cromozomilor (Kalab et al., 2002; Caudron et al., 2005). (D) La sfârșitul mitozei, sistemul Ran reglează, de asemenea, reasamblarea membranei nucleare și a NPC prin controlul fuziunii membranare și eliberarea componentelor NPC (Walther et al., 2003; Harel et al., 2003). (E) În celulele ciliate, RanGTP se acumulează în cilioplasmă și promovează transportul și acumularea de Kif17 și retinis pigmentosa 2 în cilioplasmă (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) În neuroni, multe SAF-uri au o funcție. Mai mult, importinele se localizează în spațiul sinaptic dendritic și sunt implicate în transportul de sarcini către nucleu (Jordan și Kreutz, 2009; Panayotis et al., 2015). Sistemul Ran este, de asemenea, activ în axonul nervului sciatic, unde, în urma unei leziuni, importinele promovează transportul încărcăturilor către corpul celular al neuronului (Hanz et al., 2003; Yudin et al., 2008).
NTR-urile se asociază cu mica GTPază Ran care acționează ca un comutator molecular. În forma sa legată de GTP, Ran (RanGTP) interacționează cu proteinele carioferin-β cu mare afinitate, în timp ce se disociază în forma sa legată de GDP (RanGDP). Legarea RanGTP la importine și exportine are consecințe foarte diferite: stabilizează interacțiunea exportină-cargo, în timp ce destabilizează interacțiunea importină-cargo (figura 1A).
Factorul RanGEF (guanine nucleotide exchange factor) RCC1 se asociază cu cromatina în interiorul nucleului, în timp ce RanGAP (GTPase activating protein) este citoplasmatic. Ca urmare, forma predominantă a Ran în nucleu este legată de GTP, în timp ce în citoplasmă este legată de GDP. Astfel, proteinele NLS transportate în nucleu de către importine sunt eliberate și se acumulează în nucleoplasmă, în timp ce proteinele NES în complex cu exportina-RanGTP sunt transportate în afara nucleului (figurile 1A,B).
Deși transportul nucleo-citoplasmatic nu mai este necesar atunci când o celulă intră în mitoză, mașinăria sa moleculară complexă este reciclată pentru a promova asamblarea MT în jurul cromatinei și pentru a dirija organizarea fusului bipolar (Clarke și Zhang, 2008).
Calea RanGTP în timpul diviziunii celulare
Cum RCC1 rămâne asociat cu cromatina după NEBD, RanGTP este foarte îmbogățit în apropierea cromozomilor. Pe măsură ce RanGTP difuzează departe de cromatină, RanGAP din citoplasmă îl transformă în RanGDP (figura 1C). Gradientul rezultat a fost vizualizat direct în celule și în extractele de ouă Xenopus (Kalab et al., 2002, 2006), iar proprietățile sale în nuclearea și stabilizarea MT au fost testate și modelate (Caudron et al., 2005). La fel ca în interfază, acest sistem asigură un control spațial asupra stabilității complexelor NTRs-cargo. Sarcinile sunt proteine care conțin NLS și/sau NES cu funcții specifice legate de asamblarea și funcționarea fusului. Proteinele NLS cu rol în asamblarea fusului au fost denumite SAFs (Spindle Assembly Factors).
Descoperirea și caracterizarea căii RanGTP a determinat o reexaminare a modelului de căutare și capturare pentru asamblarea fusului propus în 1986 (Kirschner și Mitchison, 1986). Acest model postulează că MT-urile centrosomale cresc și se micșorează explorând spațiul citoplasmatic până când o întâlnire stocastică cu un kinetocoroid promovează capturarea și atașarea lor. Cu toate acestea, s-a stabilit acum în mod clar că celulele animale private în mod experimental de centrosomii lor asamblează un fus mitotic funcțional (Debec et al., 1995; Khodjakov et al., 2000). Mai mult, simulările matematice au sugerat că mecanismul de căutare și capturare nu poate explica timpul scurt de diviziune observat la majoritatea celulelor animale (Wollman et al., 2005). Prin promovarea nucleării și stabilizării MT în apropierea cromozomilor, calea RanGTP favorizează, cu siguranță, capturarea MT de către kinetocore, sporind eficiența mecanismului de căutare și capturare. Cu toate acestea, rolul căii RanGTP trebuie să meargă dincolo de captarea MT de către kinetocore și de formarea fibrelor de kinetocore (K-fibre), deoarece promovează, de asemenea, organizarea MT în absența cromozomilor, a kinetocorelor și a fibrelor K (Carazo-Salas et al., 1999). Identificarea țintelor directe și indirecte ale RanGTP în citoplasma din faza M este, prin urmare, un pas esențial pentru a înțelege pe deplin cele mai multe roluri pe care această cale le îndeplinește în timpul diviziunii celulare.
Înțelegerea căii RanGTP prin identificarea și caracterizarea funcțională a țintelor sale
O citire directă a rolului RanGTP în citoplasma din faza M a fost obținută în extractele de ovule Xenopus lipsite de cromatină și centrosomi. Adăugarea de RanGTP în aceste extracte este într-adevăr suficientă pentru a declanșa nuclearea MT, pentru a promova stabilizarea MT și pentru a induce organizarea de ansambluri de MT numite mini-spindle (Carazo-Salas et al., 1999, 2001). Prin urmare, unul sau mai multe SAF-uri pot fi implicate în aceste evenimente diferite.
De la identificarea primelor SAF-uri în 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al, 2001; Clarke și Zhang, 2008; Meunier și Vernos, 2012), numărul proteinelor controlate de RanGTP în mitoză a crescut încet și mai multe SAF-uri noi au fost identificate recent (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier și Vernos, 2011; Samwer et al., 2013; Wilbur și Heald, 2013). În prezent, 22 de proteine au fost validate ca SAF-uri (tabelul 1). În plus, o serie de proteine cu roluri stabilite în diferite aspecte ale asamblării fusului sunt nucleare și, prin urmare, ar putea fi ținte pentru reglarea RanGTP (de exemplu, Kif4a/Klp1, Ino80, Reptin), dar studii suplimentare ar trebui să abordeze această posibilitate.

Tabel 1. Factori de asamblare a fusului.
În mod interesant, caracterizarea funcțională a unora dintre SAFs oferă informații mecaniciste despre funcțiile căii RanGTP în celula în diviziune. Mecanismul prin care RanGTP promovează nuclearea MT de novo în citoplasma fazei M a fost descris recent (Scrofani et al., 2015). Prin eliberarea TPX2 de la importine, RanGTP promovează interacțiunea acesteia cu Aurora A și cu un complex RHAMM-NEDD1-γTURC (complexul inelar de γTubulină). În acest nou complex, Aurora A activat fosforilează NEDD1, o cerință esențială pentru nuclearea MT. S-a demonstrat că un alt SAF, Mel28, interacționează cu γTuRC și s-a propus ca acesta să joace un rol în nuclearea MT dependentă de RanGTP (Yokoyama et al., 2014). Posibila cooperare a Mel28 cu calea dependentă de TPX2 descrisă mai sus rămâne de stabilit.
Calea RanGTP contribuie, de asemenea, la maturarea centrosomului și la activitatea sa de asamblare a MT (Carazo-Salas et al., 2001). De fapt, s-a demonstrat că două SAF, CDK11 și Mel28, favorizează asamblarea MT la nivelul centrosomului (Yokoyama et al., 2008, 2014).
Identificarea și caracterizarea unei alte SAF, MCRS1, a dezvăluit un mecanism nou și important pentru reglarea dinamicii capătului minus al MT din fibra K (Meunier și Vernos, 2011) și noi perspective asupra rolurilor căii RanGTP în asamblarea fusului și diviziunea celulară (Meunier și Vernos, 2012). MCRS1, în complex cu membri ai complexului modificator de cromatină KAT8-asociat letal nespecific (KANSL) (Meunier et al., 2015), este direcționat către capătul minus al MT dependente de RanGTP, protejându-le de depolimerizare. În cadrul fusului, MCRS1 se asociază, de asemenea, în mod specific cu capetele minus ale MT-urilor din fibrele K și reglează rata de depolimerizare a acestora, jucând un rol esențial în dinamica fibrelor K și în alinierea cromozomilor (Meunier și Vernos, 2011; Meunier et al., 2015). Asocierea specifică a MCRS1 cu MT-urile nucleate prin calea dependentă de RanGTP sugerează, de asemenea, că aceste MT-uri au caracteristici specifice care le disting de MT-urile nucleate de centrosomi. Dacă acest lucru se dovedește a fi adevărat, MT-urile cromozomiale nu ar fi doar o simplă sursă locală de MT-uri care favorizează un mecanism eficient de căutare și capturare, ci ar putea oferi funcționalități unice esențiale necesare pentru asamblarea și funcționarea fusului bipolar (Meunier et al., 2015).
Recent, s-a demonstrat că kineina Kif2a, care depolimerizează MT, este reglată de RanGTP în mitoză, dezvăluind un mecanism important pentru scalarea fusului la dimensiunea celulei în timpul dezvoltării timpurii a embrionilor Xenopus (Wilbur și Heald, 2013). Kif2a este menținută inactivă de importina α până în stadiul 8 al dezvoltării embrionare. Pe măsură ce concentrația solubilă a importinei α scade, Kif2a este eliberată și funcționează ca o depolimerază MT care promovează scurtarea fusului.
Deși, deși, majoritatea SAF-urilor identificate până în prezent s-au dovedit a juca un rol în fazele timpurii ale diviziunii celulare, o serie de rapoarte recente indică faptul că calea RanGTP are alte roluri esențiale care nu sunt direct legate de asamblarea fusului. Într-adevăr, caracterizarea SAF ISWI sugerează funcții pentru calea RanGTP în timpul anafazei (Yokoyama et al., 2009).
Multe linii de cercetare indică, de asemenea, că aceasta joacă un rol în poziționarea fusului. Într-adevăr, înainte de intrarea în anafază, gradientul RanGTP restricționează localizarea complexului LGN-NuMa în zonele cortexului celular mai îndepărtate de cromozomi, contribuind la controlul poziției și orientării fusului (Kiyomitsu și Cheeseman, 2012).
În plus, RanGTP reglează, de asemenea, ținte care nu sunt legate de MT. Într-adevăr, acesta controlează localizarea Anillinei și declanșează alungirea asimetrică a membranei în timpul anafazei, definind poziționarea fusului în centrul celulei în diviziune (Silverman-Gavrila et al., 2008; Kiyomitsu și Cheeseman, 2012). În cele din urmă, în timpul citocinezei, calea RanGTP reglează activitatea kineinei Kif14/Nabkin în formarea pachetelor de actină (Carleton et al., 2006; Samwer et al., 2013) și coordonează reasamblarea membranei nucleare și a NPC (Harel et al., 2003; Walther et al., 2003; Ciciarello et al, 2010; Roscioli et al., 2010; Forbes et al., 2015; Figura 1D).
Este, prin urmare, clar că identificarea și caracterizarea funcțională a țintelor mitotice RanGTP oferă noi perspective asupra mecanismului de asamblare a fusului și a diviziunii celulare. Cu toate acestea, nu este clar dacă mai rămân de identificat multe sau doar câteva ținte RanGTP. Acest număr ar putea fi potențial ridicat, deoarece numărul de proteine nucleare este de ordinul sutelor sau miilor (Dellaire et al., 2003), cu cel puțin un ordin de mărime peste numărul actual de ținte RanGTP cunoscute în celula în diviziune (tabelul 1).
Cele mai multe dintre studiile proteomice care au avut ca scop identificarea de noi SAF-uri s-au concentrat pe importinele α1 și β1 (Nachury et al., 2001; Wiese et al., 2001; Yokoyama et al., 2008), care sunt două dintre cele mai abundente importine în extractele de ouă Xenopus (Bernis et al., 2014; Wuhr et al., 2014). Cu toate acestea, există alte cinci α-importine și alte opt β-importine la om (Cautain et al., 2015).
Deși sunt încă puține, unele date indică faptul că, într-adevăr, și alte importine joacă un rol în timpul diviziunii celulare. S-a demonstrat că reglarea RanGTP a NuSAP depinde de importin-β1 și importin-7 (Ribbeck et al., 2006), iar cea a Mel28, Nup107-160 și Nup98 de importin-β1 și transportin/importin-β2 (Lau et al., 2009). De asemenea, s-a demonstrat în mod specific că transportina reglează în mod negativ asamblarea fusului și reasamblarea membranei nucleare și a NPC (Bernis et al., 2014). Cu toate acestea, nu sunt descriși factori mitotici reglementați exclusiv de importina-7 sau de transportină.
Caracterizarea posibilelor ținte specifice ale transportinei și, mai general, ale celorlalte importine α și β reprezintă un câmp deschis pentru explorare. Acest lucru ar putea fi important pentru a înțelege reglarea căii RanGTP, mai ales având în vedere că modelele de expresie ale importinelor se schimbă semnificativ în diferite stadii de dezvoltare și țesuturi (Hosokawa et al., 2008).
Reglarea sistemului RanGTP în timpul diviziunii celulare
Pe lângă specificitățile interacțiunilor NTR-SAF, mai multe mecanisme pot avea o influență directă asupra căii RanGTP în timpul diviziunii celulare. Mai multe date sugerează că RCC1 însuși este o componentă cheie supusă unei reglementări fine. Celulele umane au trei izoforme de RCC1, care sunt exprimate într-o manieră specifică țesutului (Hood și Clarke, 2007). Izoformele diferă la extremitatea N-terminală, o regiune implicată în legarea importinei și reglementată prin fosforilare, care a fost propusă pentru a influența producția de RanGTP cuplată cu cromozomul (Hood și Clarke, 2007; Li et al., 2007). Mai mult, nivelul de expresie al RCC1 variază, de asemenea, în diferite celule și se corelează cu abruptul gradientului RanGTP (Hasegawa et al., 2013). Acest lucru poate avea consecințe importante, deoarece s-a propus că abruptul gradientului RanGTP determină durata prometafazei și a metafazei, care, la rândul său, poate fi relevantă pentru fidelitatea segregării cromozomilor (Silkworth et al., 2012; Hasegawa et al., 2013).
Alte mecanisme, cum ar fi modificările posttraducționale și splicingul alternativ sunt, de asemenea, strategii potențiale pentru a controla NLS-ul SAF-urilor. Cu toate acestea, aceste mecanisme ar afecta mai degrabă o anumită proteină decât întreaga cale RanGTP.
Recent, a fost propus un mecanism alternativ pentru reglarea SAF-urilor independent de RanGTP. Direcționarea proteinei Golgi GM130 către membranele Golgi fragmentate în mitoză poate concura local TPX2 de la legarea importinei α1, favorizând astfel asamblarea MT în vecinătatea fragmentelor Golgi (Wei et al., 2015). Acest mecanism bazat pe competiție ar putea fi o altă strategie de control local al SAF-urilor sechestrate de importine.
Legăturarea RanGTP la exportine stabilizează interacțiunea sa cu proteinele NES-cargo. S-a demonstrat că principala exportină, CRM1, este implicată în direcționarea proteinelor NES către kinetocoro sau centrosomi. La nivelul kinetocorului, CRM1 recrutează complexul RanBP2-RanGAP1-SUMO care este necesar pentru interacțiunea dintre MT și kinetocoru (Arnaoutov et al., 2005). Cu toate acestea, este încă neclar din punct de vedere mecanic modul în care acest complex favorizează interacțiunea MT-kinetochore (Forbes et al., 2015). CRM1 promovează, de asemenea, recrutarea lui RanGAP1-RanBP2 la fus într-o manieră dependentă de RanGTP (Wu et al., 2013) și este implicat în legarea Complexului Pasager al Cromosomului la centromer prin interacțiunea sa directă cu survivina (Knauer et al., 2006). S-a demonstrat, de asemenea, că CRM1 promovează recrutarea lui BRCA1 și a pericentrinei la centrosomii mitotici, promovând astfel activitatea de asamblare MT a centrosomilor (Liu et al., 2009; Brodie și Henderson, 2012). Recent, s-a constatat că represorul transcripțional Bach1 joacă un rol în alinierea brațelor cromozomiale în timpul mitozei și că este exclus din cromozomi în timpul metafazei într-un mod dependent de CRM1 (Li et al., 2012).
Cu toate acestea, semnificația acestor evenimente de direcționare nu este în întregime clară din punct de vedere mecanic (Yokoyama și Gruss, 2013). O problemă majoră este că, în timpul mitozei, rolul putativ al interacțiunilor mediate de exportină poate fi dificil de deslușit de cel al interacțiunilor mediate de importină, deoarece acestea implică proteine care au atât NES, cât și NLS . Cu toate acestea, pare evident că reglarea RanGTP a CRM1 are mai multe roluri în timpul mitozei și va fi interesant de testat dacă și alte exportine sunt importante pentru evenimentele mitotice.
Conservarea căii RanGTP în celulele în diviziune
În ultimii 15 ani, calea RanGTP a fost studiată în mai multe organisme și tipuri de celule. S-a constatat că aceasta prezintă variații la unele detalii sau, în unele cazuri, că nu este necesară. Într-adevăr, în unele sisteme meiotice, contribuția căii RanGTP pare a fi neesențială. De exemplu, spermatozoizii Drosophila pot asambla fusul de meioză I în absența completă a cromozomilor (Bucciarelli et al., 2003). S-a demonstrat, de asemenea, că asamblarea fusului acentrosomal al meiozei I în ovocitele de șoarece și de broască este doar parțial dependentă de calea RanGTP, deși calea este strict esențială pentru asamblarea fusului în timpul meiozei II (Dumont et al., 2007).
Inclusiv în sistemele care se bazează pe RanGTP pentru asamblarea fusului există unele variații cel puțin la nivelul mașinăriei. De exemplu, TPX2, care este esențial la broaște și mamifere, nu este prezent în Caenorhabditis elegans și Drosophila melanogaster. Deși în aceste sisteme au fost identificate proteine cu unele dintre caracteristicile TPX2 (Ozlu et al., 2005; Goshima, 2011), acestora le lipsesc caracteristicile esențiale ale TPX2, cum ar fi un NLS care stă la baza reglării RanGTP. Acest exemplu indică faptul că efectorii căii RanGTP ar putea varia de la un sistem la altul, deși principiile principale sunt probabil menținute și conservate.
The RanGTP Pathway: A Moonlighting Pathway with a Role in Several Cellular Functions
Calea RanGTP este un exemplu de cale întreagă care îndeplinește funcții esențiale în diferite părți ale ciclului celular. În interfază, aceasta orchestrează transportul nucleo-citoplasmatic, în timp ce în mitoză conduce asamblarea fusului și, ulterior, reasamblarea membranei nucleare și a NPC (figurile 1B-D). Proteinele individuale care au funcții diferite în momente diferite sunt definite ca proteine moonlighting (Jeffery, 1999). Calea RanGTP ar putea fi, prin urmare, un exemplu de cale moonlighting.
Calea RanGTP este deosebit de interesantă, deoarece arată modul în care funcția unei proteine depinde de contextul său: majoritatea SAF-urilor au funcții nucleare și sunt ținute separate de tubuline și de alte proteine ale citoscheletului în timpul interfazei. La NEBD, contextul general se schimbă și SAFs exercită funcții importante legate de MTs.
Câteva date indică o funcție de „moonlighting” a căii RanGTP în formarea ciliilor și în transportul în ciliu. S-a demonstrat că RanGTP controlează acumularea de Kif17 și retinis pigmentosa 2 în cilioplasmă (Dishinger et al., 2010; Hurd et al., 2011), unde RanGTP este concentrat (Fan et al., 2011). Modelul de lucru actual este că calea RanGTP orchestrează transportul încărcăturilor care poartă un semnal de localizare a ciliilor prin complexul porilor ciliilor, care a fost propus a fi localizat la baza ciliului (Kee et al., 2012; Figura 1E). Cu toate acestea, sunt necesare studii suplimentare pentru a înțelege cum se stabilește gradientul RanGTP în cili și ce alte încărcături transportă în cili.
În mod interesant, calea RanGTP face lumina lunii și în neuronii diferențiați, unde multe SAF-uri au, de asemenea, o funcție . Mai mult, importinele α și β se acumulează în spațiul sinaptic dendritic și au un rol în transportul încărcăturilor de la sinapse la nucleu (Jordan și Kreutz, 2009; Panayotis et al., 2015). În cele din urmă, s-a demonstrat că un mecanism reglementat de RanGTP este în joc ca răspuns la leziunile nervului sciatic (Hanz et al., 2003; Yudin et al., 2008; Figura 1F).
Concluzii
Identificarea rolului jucat de calea RanGTP în timpul diviziunii celulare a avut loc cu mai mult de 15 ani în urmă. Știm acum că calea RanGTP are funcții suplimentare și ar putea fi considerată o cale moonlighting care controlează diverse procese celulare importante (Figura 1). În timpul diviziunii celulare, aceasta conduce mecanisme esențiale pe care începem să le înțelegem datorită identificării și caracterizării funcționale a țintelor sale directe. Cu toate acestea, mai multe întrebări deschise trebuie să fie încă abordate. Numărul total de SAF-uri este dificil de anticipat și, prin urmare, nu știm câte mai sunt de identificat. În plus, cea mai mare parte a cunoștințelor noastre actuale se limitează la rolul doar al unor componente ale mașinăriei de transport nucleo-citoplasmatic. De exemplu, în prezent se cunosc foarte puține lucruri despre rolul presupus în diviziunea celulară al diferitelor importine prezente în celula umană. Importinele specifice pot reglementa activitatea unor noi SAF-uri, iar diferitele lor modele de exprimare în diferite tipuri de celule și țesuturi pot oferi un mecanism combinatoriu relevant. De asemenea, știm puține lucruri despre rolul presupus al componentelor mașinăriei de export în asamblarea fusului și în alte funcții noi ale căii. Deși există date care sugerează diverse puncte de reglare a căii în sine, consecințele asupra diviziunii celulare și a altor procese nu sunt încă clare și nici modul în care aceasta poate fi adaptată la cerințele diferitelor tipuri de celule sau țesuturi. Studiul căii RanGTP va oferi cu siguranță noi perspective interesante în următorii ani, dezvăluind unele mecanisme esențiale pentru organizarea și funcționarea celulelor.
Contribuții ale autorilor
IV și TC au scris manuscrisul, TC a pregătit tabelul și figura.
Finanțare
TC a fost sprijinit de Ministerul spaniol al Economiei și Competitivității (MINECO) prin intermediul bursei FPI BES-2010-031355. Lucrările din laboratorul Vernos au fost sprijinite de granturile ministerului spaniol BFU2009-10202 și BFU2012-37163, cofinanțate de Fondul European de Dezvoltare Regională (FEDR/FEDER). Recunoaștem, de asemenea, sprijinul Ministerului spaniol al Economiei și Competitivității, „Centro de Excelencia Severo Ochoa 2013-2017”, SEV-2012-0208.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Vrem să mulțumim membrilor laboratorului Vernos pentru discuțiile critice privind diferitele aspecte ale căii RanGTP.
Abbreviații
γTuRC, Complexul inelar de γTubulină; K-Fiber, Kinetochore-Fiber; KANLS, Complex letal nespecific asociat cu KAT8; MT, Microtubuli; NEBD, Descompunerea Învelișului Nuclear; NES, Semnal de Export Nuclear; NLS, Nuclear Localization Signal (semnal de localizare nucleară); NPC, Nuclear Pore Complex (complexul porului nuclear); NTR, Nuclear Transport Receptor (receptor de transport nuclear); RanGAP, Ran GTPase Activating Protein (proteină de activare a Ran GTPase); RanGEF, Ran Guanine nucleotide Exchange Factor (factor de schimb de nucleotide de guanină); SAF, Spindle Assembly Factor (factor de asamblare a fusului).
Wiese, C. (2001). Rolul importinei-beta în cuplarea Ran la țintele din aval în asamblarea microtubulilor. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar
.