- Historical Perspective on the Chromatin Dependent MT Assembly Pathway
- Nukleosytoplasminen kuljetus ja pieni GTPaasi Ran
- RanGTP:n kulkureitti solun jakaantumisen aikana
- RanGTP:n reitin ymmärtäminen sen kohteiden tunnistamisen ja funktionaalisen karakterisoinnin avulla
- RanGTP-järjestelmän säätely solunjakautumisen aikana
- Nukleosytoplasmisen sukkulointikoneiston muiden komponenttien rooli mitoosin aikana
- RanGTP-reitin säilyminen jakautuvissa soluissa
- RanGTP-reitti: A Moonlighting Pathway with a Role in Several Cellular Functions
- Tulokset
- Tekijöiden panos
- Rahoitus
- Conflict of Interest Statement
- Kiitokset
- Lyhenteet
Historical Perspective on the Chromatin Dependent MT Assembly Pathway
Ensimmäiset vihjeet kromosomista riippuvaisen MT:n kokoonpanomekanismin olemassaolosta jakautuvassa solussa saatiin 1970-1980-luvuilla, kun useat ryhmät raportoivat MT:n ytimen muodostumisen tapahtuvan kinetokorien läheisyydessä tai niiden kohdalla (McGill ym., McGill ja Brinkley, 1975; Telzer ym., 1975; Witt ym., 1980; De Brabander ym., 1981) ja karan kaltainen rakenne muodostui lambda-DNA:n ympärille, joka ruiskutettiin metafaasissa pysähtyneisiin Xenopuksen muniin (Karsenti ym., 1984). Vuonna 1996 DNA:lla päällystettyjen helmien osoitettiin käynnistävän bipolaarisen karan muodostumisen, kun niitä inkuboitiin Xenopuksen munauutoksissa (Heald ym., 1996), mikä antoi lisätukea ajatukselle, että kromatiini kantaa kaiken tarvittavan informaation MT:n kokoonpanon ja järjestäytymisen ohjaamiseksi M-vaiheen sytoplasmassa. Pian tämän jälkeen pienen Ran GTPaasin tunnistaminen kromatiinista riippuvaisen MT-kokoonpanon ohjaajaksi M-vaiheen sytoplasmassa oli merkittävä läpimurto taustalla olevan mekanismin ymmärtämisessä (Carazo-Salas ym., 1999; Kalab ym., 1999; Ohba ym., 1999; Wilde ja Zheng, 1999; Zhang ym., 1999). Nykyään tiedämme, että kromosomit ohjaavat MT:n kokoonpanoa ja järjestäytymistä kaksinapaiseksi karaksi RanGTP-riippuvaisella tavalla useimmissa soluissa (Karsenti ja Vernos, 2001; Rieder, 2005).
Tässä minikatsauksessa kuvaamme lyhyesti, miten RanGTP-järjestelmä säätelee komponenttien nukleosytoplasmista sukkulointia interfaasivaiheessa ja NEBD:n jälkeen spesifisten tekijöiden aktiivisuutta ja/tai lokalisaatioita, jotka ohjaavat karan kokoonpanoa. Käymme lyhyesti läpi nykyiset tietomme RanGTP:n säätelemien tekijöiden identiteetistä ja toiminnasta sekä viimeaikaiset edistysaskeleet RanGTP:n säätelemien uusien mekanismien ymmärtämisessä. Lopuksi annamme yleiskatsauksen itse RanGTP-reitin säätelystä mitoosin aikana, sen säilymisestä eri organismeissa ja solutyypeissä sekä sen roolista muissa solutoiminnoissa. Lisätietoa löytyy erinomaisista katsauksista (Ciciarello ym., 2007; O’Connell ja Khodjakov, 2007; Clarke ja Zhang, 2008; Kalab ja Heald, 2008; Roscioli ym., 2010; Forbes ym, 2015).
Nukleosytoplasminen kuljetus ja pieni GTPaasi Ran
Eukaryoottisolut ovat lokeroituneita ja niillä on erityisiä kuljetusjärjestelmiä sytoplasman ja eri kalvoon sidottujen organellien väliseen viestintään. Ytimen ja sytoplasman välinen kuljetusjärjestelmä on välttämätön, jotta ytimessä tapahtuva genomin transkriptio ja sytoplasmassa tapahtuva proteiinien translaatio voidaan yhdistää toiminnallisesti (kuvat 1A,B). Molekyylien kuljetus tumaan ja tumasta ulos tapahtuu ydinhuokoskompleksin (Nuclear Pore Complex, NPC) kautta, joka on suuri, ~60 MDa:n kokoinen proteiinikompleksi, joka on sijoitettu ydinkalvoon (Sorokin ym., 2007). Pienet lastit (< 40 kDa) diffundoituvat nopeasti NPC:n läpi. Sen sijaan yli 40 kDa:n proteiinit vaativat aktiivista kuljetusta NPC:n läpi, johon osallistuvat liukoiset ydinkuljetusreseptorit (NTR), jotka kuuluvat karyopherin-β-proteiiniperheeseen. NTR:iä, jotka helpottavat lastiproteiinien kuljettamista ytimeen, kutsutaan importiineiksi, ja ne ovat vuorovaikutuksessa lastinsa kanssa runsaasti emäksisiä jäämiä sisältävän ydinalueen lokalisointisignaalin (NLS) kautta. NTR:iä, jotka helpottavat proteiinien vientiä ulos ytimestä, kutsutaan exportiineiksi, ja ne ovat vuorovaikutuksessa lastinsa kanssa ydinviennin signaalin (NES) kautta, joka sisältää runsaasti hydrofobisia jäämiä, kuten leusiinia. Karyopheriini-β-importtiini β1 on usein vuorovaikutuksessa lastin kanssa importin α-perheeseen kuuluvan adaptorin kautta (Sorokin ym., 2007). Importin α sitoutuu suoraan lastiproteiinin NLS:ään ja importin β1:een IBB-domeenin (importin β binding domain) kautta, mikä johtaa trimeerisen kompleksin muodostumiseen.
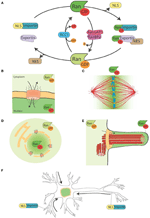
KUVIO 1. Importin β1:n sitoutuminen lastiproteiiniin. Ran-järjestelmä ja sen kuutamotoiminnot. (A) Kaavamainen esitys Ran-järjestelmästä NLS- ja NES-kantajaproteiinien spatiaalista kontrollia varten. Soluissa Ran esiintyy kahdessa muodossa, RanGTP (vihreä) ja RanGDP (vaaleanvihreä). RCC1 (vaaleansininen) edistää GDP:n vaihtumista GTP:ksi, kun taas RanGAP1-RanBP2 (vaaleanpunainen ja violetti) edistää GTP:n hydrolyysiä GDP:ksi. RanGTP sitoutuu importiineihin (turkoosinvihreä) ja exportiineihin (vaaleanvioletti). RanGTP:n kanssa kompleksissa olevat exportiinit voivat assosioitua NES-proteiineihin (ruskealla). Toisaalta RanGTP:n sitoutuminen importiineihin käynnistää niiden dissosioitumisen NLS-proteiineista (keltainen). (B) Interfaasin aikana Ran-järjestelmä kontrolloi proteiinien nukleosytoplasmista sukkulointia, koska RanGTP on vallitsevana nukleoplasmassa ja RanGDP vallitsevana sytoplasmassa (Sorokin ym., 2007). (C) Mitoosin aikana RanGEF:n RCC1:n assosiaatio kromosomien kanssa määrittelee RanGTP-pitoisuuksien gradientin, joka edistää SAF:ien vapautumista ja MT:n ydintymistä kromatiinin ympärille. Ran-järjestelmä muuntuu MT:n kokoonpanon ja organisoitumisen väyläksi, joka on välttämätön mitoottisen karan kokoonpanon kannalta. RanGTP-reitti on riippuvainen RanGTP:n konsentraatiogradientin muodostumisesta, joka saavuttaa huippunsa kromosomien ympärillä (Kalab et al., 2002; Caudron et al., 2005). (D) Mitoosin lopussa Ran-järjestelmä säätelee myös ydinmembraanin ja NPC:n uudelleen kokoamista ohjaamalla membraanifuusiota ja vapauttamalla NPC:n komponentteja (Walther ym., 2003; Harel ym., 2003). (E) Sädesoluissa RanGTP kertyy sädeplasmaan ja edistää Kif17:n ja retinis pigmentosa 2:n kuljetusta ja kertymistä sädeplasmaan (Dishinger ym., 2010; Fan ym., 2011; Hurd ym., 2011). (F) Neuroneissa monilla SAF:illa on jokin tehtävä. Lisäksi importiinit lokalisoituvat dendriittiseen synaptiseen tilaan ja osallistuvat rahdin kuljettamiseen ytimeen (Jordan ja Kreutz, 2009; Panayotis et al., 2015). Ran-järjestelmä on aktiivinen myös iskiashermon aksonissa, jossa vamman sattuessa importiinit edistävät cargojen kulkeutumista kohti hermosolun solurunkoa (Hanz ym., 2003; Yudin ym., 2008).
NTR:t assosioituvat pienen GTPaasi Ranin kanssa, joka toimii molekyylikytkimenä. GTP:hen sitoutuneessa muodossaan Ran (RanGTP) vuorovaikuttaa karyopherin-β-proteiinien kanssa suurella affiniteetilla, kun taas GDP:hen sitoutuneessa muodossaan (RanGDP) se dissosioituu. RanGTP:n sitoutumisella importiineihin ja exportiineihin on hyvin erilaiset seuraukset: se stabiloi exportiinin ja lastin vuorovaikutusta, kun taas se destabiloi importiinin ja lastin vuorovaikutusta (kuva 1A).
RanGEF (guaniininukleotidinvaihtotekijä) RCC1 assosioituu kromatiiniin tuman sisällä, kun taas RanGAP (GTPaasia aktivoiva proteiini) on sytoplasmisessa tilassa. Tämän seurauksena Ranin vallitseva muoto tuman sisällä on sitoutunut GTP:hen, kun taas sytoplasmassa se on sitoutunut GDP:hen. Tällöin importiinien tumaan kuljettamat NLS-proteiinit vapautuvat ja kerääntyvät tumaan, kun taas NES-proteiinit, jotka ovat kompleksissa exportin-RanGTP:n kanssa, kulkeutuvat tuman ulkopuolelle (kuvat 1A, B).
Vaikka tuma-sytoplasma-kuljetusta ei enää tarvita, kun solu siirtyy mitoosiin, sen monimutkainen molekyylikoneisto kierrätetään edistämään MT:n kasaantumista kromatiinin ympärille ja ohjaamaan bipolaarisen karan järjestäytymistä (Clarke ja Zhang, 2008).
RanGTP:n kulkureitti solun jakaantumisen aikana
Koska RCC1 säilyy assosioituneena kromatiiniin NEBD:n jälkeen, RanGTP:n rikastuminen on voimakasta kromosomien läheisyydessä. Kun RanGTP diffundoituu pois kromatiinista, sytoplasmassa oleva RanGAP muuttaa sen RanGDP:ksi (kuva 1C). Tuloksena syntyvä gradientti on visualisoitu suoraan soluissa ja Xenopuksen munauutoksissa (Kalab ym., 2002, 2006) ja sen ominaisuuksia MT:n ydintymisessä ja stabiloinnissa on testattu ja mallinnettu (Caudron ym., 2005). Kuten interfaasissa, tämä järjestelmä mahdollistaa NTR-kuljetuskompleksien stabiliteetin spatiaalisen kontrollin. Lastit ovat NLS- ja/tai NES-pitoisia proteiineja, joilla on spindelin kokoamiseen ja toimintaan liittyviä erityistehtäviä. NLS-proteiinit, joilla on rooli karan kokoonpanossa, on nimetty SAF:eiksi (Spindle Assembly Factors, karan kokoonpanotekijät).
RanGTP-reitin löytäminen ja karakterisointi saivat aikaan sen, että vuonna 1986 ehdotettua karan kokoonpanon etsintä- ja kaappausmallia alettiin tarkastella uudelleen (Kirschner ja Mitchison, 1986). Tämän mallin mukaan sentrosomaaliset MT:t kasvavat ja kutistuvat tutkiessaan sytoplasmatilaa, kunnes stokastinen kohtaaminen kinetokorin kanssa edistää niiden kiinnittymistä ja kiinnittymistä. Nyt on kuitenkin selvästi osoitettu, että eläinsolut, joilta on kokeellisesti poistettu sentrosomit, kokoavat toimivan mitoottisen karan (Debec ym., 1995; Khodjakov ym., 2000). Lisäksi matemaattiset simulaatiot viittasivat siihen, että Search and Capture -mekanismi ei voi selittää useimmissa eläinsoluissa havaittua lyhyttä jakautumisaikaa (Wollman ym., 2005). Edistämällä MT:n ydintymistä ja stabiloitumista kromosomien läheisyydessä RanGTP-reitti varmasti suosii MT:n kiinnittymistä kinetokoreihin, mikä lisää Search and Capture -mekanismin tehokkuutta. RanGTP-reitin roolin on kuitenkin mentävä kinetokorien MT-kiinniottoa ja kinetokori-kuitujen (K-kuitujen) muodostumista pidemmälle, sillä se edistää MT:n järjestäytymistä myös ilman kromosomeja, kinetokoreja ja K-kuituja (Carazo-Salas ym., 1999). RanGTP:n suorien ja epäsuorien kohteiden tunnistaminen M-vaiheen sytoplasmassa on siksi olennainen askel, jotta voidaan täysin ymmärtää niitä useita rooleja, joita tämä reitti täyttää solunjakautumisen aikana.
RanGTP:n reitin ymmärtäminen sen kohteiden tunnistamisen ja funktionaalisen karakterisoinnin avulla
Suoraa tietoa RanGTP:n roolista M-vaiheen sytoplasmassa saatiin kromatiini- ja sentrosomittomista Xenopusin munauutoksista. RanGTP:n lisääminen näihin uutteisiin riittää todellakin käynnistämään MT:n ydintymisen, edistämään MT:n stabiloitumista ja indusoimaan minispindeleiksi kutsuttujen MT-kokoonpanojen organisoitumisen (Carazo-Salas ym., 1999, 2001). Yksi tai useampi SAF saattaa siis olla osallisena näissä eri tapahtumissa.
Sen jälkeen, kun ensimmäiset SAF:t tunnistettiin vuonna 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al., 2001; Clarke ja Zhang, 2008; Meunier ja Vernos, 2012), RanGTP:n säätelemien proteiinien määrä mitoosissa on hitaasti kasvanut, ja viime aikoina on tunnistettu useita uusia SAFeja (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila ym, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier ja Vernos, 2011; Samwer et al., 2013; Wilbur ja Heald, 2013). Tällä hetkellä 22 proteiinia on validoitu SAF:iksi (taulukko 1). Lisäksi useat proteiinit, joilla on vakiintuneita rooleja karan kokoonpanon eri osa-alueilla, ovat nukleaarisia ja voisivat siten olla RanGTP:n säätelyn kohteita (esim. Kif4a/Klp1, Ino80, Reptin), mutta jatkotutkimuksissa olisi tarkasteltava tätä mahdollisuutta.

TAULUKKO 1. Spindelin kokoonpanotekijät.
Interenkiintoista on, että joidenkin SAF:ien toiminnallinen karakterisointi antaa mekanistista tietoa RanGTP-reitin toiminnoista jakautuvassa solussa. Mekanismi, jolla RanGTP edistää MT:n ydintymistä de novo M-vaiheen sytoplasmassa, kuvattiin äskettäin (Scrofani ym., 2015). Vapauttamalla TPX2:n importiineista RanGTP edistää sen vuorovaikutusta Aurora A:n ja RHAMM-NEDD1-γTURC (γTubulin Ring Complex) -kompleksin kanssa. Tässä uudessa kompleksissa aktivoitunut Aurora A fosforyloi NEDD1:n, joka on välttämätön edellytys MT:n ydintymiselle. Toisen SAF:n, Mel28:n, osoitettiin olevan vuorovaikutuksessa γTuRC:n kanssa, ja sillä ehdotettiin olevan rooli RanGTP-riippuvaisessa MT-ytimenmuodostuksessa (Yokoyama ym., 2014). Mel28:n mahdollinen yhteistyö edellä kuvatun TPX2-riippuvaisen reitin kanssa on vielä selvittämättä.
RanGTP-reitti vaikuttaa myös sentrosomin kypsymiseen ja sen MT-kokoonpanotoimintaan (Carazo-Salas ym., 2001). Itse asiassa kahden SAF:n, CDK11:n ja Mel28:n, osoitettiin suosivan MT:n kokoonpanoa sentrosomissa (Yokoyama ym., 2008, 2014).
Toisen SAF:n, MCRS1:n, tunnistaminen ja karakterisointi on paljastanut uudenlaisen ja tärkeän mekanismin K-kuitujen MT:n miinuspään dynamiikan säätelylle (Meunier ja Vernos, 2011) ja uusia oivalluksia siitä, millaisia rooleja RanGTP-reitillä on selkärangan kokoonpanossa ja solun jakautumisessa (Meunier ja Vernos, 2012). MCRS1, kompleksissa kromatiinin muokkaajan KAT8-assosioituneen epäspesifisen tappavan (KANSL) kompleksin jäsenten kanssa (Meunier ym., 2015), kohdistuu RanGTP-riippuvaisten MT:iden miinuspäähän suojaten niitä depolymerisaatiolta. Karan sisällä MCRS1 assosioituu myös spesifisesti K-kuitujen MT:iden miinuspäätteisiin ja säätelee niiden depolymerisaationopeutta, millä on olennainen rooli K-kuitujen dynamiikassa ja kromosomien kohdentumisessa (Meunier ja Vernos, 2011; Meunier ym., 2015). MCRS1:n spesifinen assosiaatio RanGTP-riippuvaisen reitin avulla ydintyvien MT:iden kanssa viittaa myös siihen, että näillä MT:illä on erityisominaisuuksia, jotka erottavat ne sentrosomien ydintyvistä MT:istä. Jos tämä osoittautuu todeksi, kromosomaaliset MT:t eivät olisi pelkkä paikallinen MT:iden tarjonta, joka suosii tehokasta Search and Capture -mekanismia, vaan ne voisivat tarjota olennaisia ainutlaatuisia toiminnallisuuksia, joita tarvitaan bipolaarisen karan kokoonpanossa ja toiminnassa (Meunier et al., 2015).
Viime aikoina MT:tä depolymerisoivan kinesiinin Kif2a:n osoitettiin olevan RanGTP:n säätelemä mitoosissa, mikä paljasti tärkeän mekanismin karan skaalautumiselle solun koon mukaan Xenopus-alkioiden varhaiskehityksen aikana (Wilbur ja Heald, 2013). Kif2a säilyy inaktiivisena importin α:n avulla alkionkehityksen vaiheeseen 8 asti. Kun importin α:n liukoisen konsentraatio pienenee, Kif2a vapautuu ja toimii MT-depolymeraasina edistäen karan lyhenemistä.
Vaikka suurimmalla osalla tähän mennessä tunnistetuista SAF:ista on todettu olevan rooli solunjakautumisen varhaisissa vaiheissa, useat viimeaikaiset raportit viittaavat siihen, että RanGTP-reitillä on muitakin olennaisia rooleja, jotka eivät suoranaisesti liity karan kokoamiseen. SAF ISWI:n karakterisointi viittaa nimittäin siihen, että RanGTP-reitillä on tehtäviä anafaasin aikana (Yokoyama ym., 2009).
Monet tutkimussuuntaukset viittaavat myös siihen, että SAF:lla on rooli karan asemoinnissa. Itse asiassa ennen anafaasiin siirtymistä RanGTP-gradientti rajoittaa LGN-NuMa-kompleksin lokalisaatiota kromosomeista kauempana oleville solukuorialueille, mikä osaltaan kontrolloi karan asentoa ja orientaatiota (Kiyomitsu ja Cheeseman, 2012).
Lisäksi RanGTP säätelee myös muita kuin MT:hen liittyviä kohteita. Se nimittäin kontrolloi Anillinin lokalisaatiota ja käynnistää epäsymmetrisen membraanin venymisen anafaasin aikana, mikä määrittelee karan sijainnin jakautuvan solun keskellä (Silverman-Gavrila ym., 2008; Kiyomitsu ja Cheeseman, 2012). Lopuksi sytokinesiksen aikana RanGTP-reitti säätelee kinesiini Kif14/Nabkinin aktiivisuutta aktiinin niputtamisessa (Carleton ym., 2006; Samwer ym., 2013) ja koordinoi ydinkalvon ja NPC:n uudelleenkokoamista (Harel ym., 2003; Walther ym., 2003; Ciciarello ym., 2003), 2010; Roscioli et al., 2010; Forbes et al., 2015; kuva 1D).
On siis selvää, että RanGTP:n mitoosikohteiden tunnistaminen ja toiminnallinen karakterisointi tarjoaa uusia näkemyksiä karan kokoonpanon ja solunjakautumisen mekanismista. On kuitenkin epäselvää, onko vielä tunnistamatta monia vai vain muutamia RanGTP-kohteita. Määrä voi olla potentiaalisesti suuri, sillä ydinproteiinien määrä on satojen tai tuhansien luokkaa (Dellaire ym., 2003), mikä on ainakin kertaluokkaa suurempi kuin nykyisin tiedossa olevien RanGTP-kohteiden määrä jakautuvassa solussa (taulukko 1).
Uusien SAF-kohteiden tunnistamiseen tähtäävissä proteomitutkimuksissa on keskitytty enimmäkseen importiineihin α1 ja β1 (Nachury ym., 2003), 2001; Wiese et al., 2001; Yokoyama et al., 2008), jotka ovat kaksi runsaimmin esiintyvää importiinia Xenopuksen munauutoksissa (Bernis et al., 2014; Wuhr et al., 2014). Ihmisillä on kuitenkin vielä viisi muuta α-importiinia ja kahdeksan muuta β-importiinia (Cautain ym., 2015).
Vaikka vielä niukasti, jotkin tiedot viittaavat siihen, että todellakin myös muilla importiineilla on rooli solunjakautumisen aikana. NuSAP:n RanGTP-säätelyn osoitettiin riippuvan importin-β1:stä ja importin-7:stä (Ribbeck ym., 2006) ja Mel28:n, Nup107-160:n ja Nup98:n säätelyn importin-β1:stä ja transportin/importin-β2:sta (Lau ym., 2009). Transportinin osoitettiin myös erityisesti säätelevän negatiivisesti karan kokoonpanoa ja ydinkalvon ja NPC:n uudelleen kokoamista (Bernis ym., 2014). Mitoottisia tekijöitä, joita yksinomaan importin-7 tai transportin säätelisi, ei kuitenkaan ole kuvattu.
Mahdollisten transportinispesifisten kohteiden ja yleisemmin muidenkin importiinien α ja β karakterisointi edustaa avointa tutkimuskenttää. Tämä voisi olla tärkeää RanGTP-reitin säätelyn ymmärtämiseksi, etenkin kun otetaan huomioon, että importiinien ilmentymismallit muuttuvat merkittävästi eri kehitysvaiheissa ja kudoksissa (Hosokawa ym., 2008).
RanGTP-järjestelmän säätely solunjakautumisen aikana
NTR-SAF-vuorovaikutusten spesifisyyksien lisäksi useat mekanismit voivat vaikuttaa suoraan RanGTP-reittiin solunjakautumisen aikana. Useat tiedot viittaavat siihen, että RCC1 itsessään on keskeinen komponentti hienosäädön alaisena. Ihmissoluissa on kolme RCC1:n isoformia, jotka ilmentyvät kudosspesifisesti (Hood ja Clarke, 2007). Isomuodot eroavat toisistaan N-terminaalissa, joka on alue, joka osallistuu importiinin sitoutumiseen ja jota säädellään fosforylaatiolla ja jonka on ehdotettu vaikuttavan kromosomiin kytkettyyn RanGTP-tuotantoon (Hood ja Clarke, 2007; Li ym., 2007). Lisäksi RCC1:n ilmentymistaso vaihtelee myös eri soluissa ja korreloi RanGTP-gradientin jyrkkyyden kanssa (Hasegawa ym., 2013). Tällä voi olla tärkeitä seurauksia, sillä on ehdotettu, että RanGTP-gradientin jyrkkyys määrittää prometafaasin ja metafaasin pituuden, jolla puolestaan voi olla merkitystä kromosomien segregaation uskollisuuden kannalta (Silkworth ym., 2012; Hasegawa ym., 2013).
Muutkin mekanismit, kuten posttranslationaaliset modifikaatiot ja vaihtoehtoinen splikointi, ovat mahdollisia strategioita, joilla voidaan kontrolloida SAF:ien NLS:ää. Nämä mekanismit vaikuttaisivat kuitenkin pikemminkin tiettyyn proteiiniin kuin koko RanGTP-reittiin.
Viime aikoina ehdotettiin vaihtoehtoista mekanismia SAF:ien säätelyyn RanGTP:stä riippumatta. Golgin proteiinin GM130 kohdistuminen fragmentoituneisiin Golgin kalvoihin mitoosissa saattaa kilpailla paikallisesti TPX2:n kanssa importin α1:n sitoutumisesta ja siten suosia MT:n kokoonpanoa Golgin fragmenttien läheisyydessä (Wei ym., 2015). Tämä kilpailuun perustuva mekanismi voisi olla toinen strategia, jolla voidaan paikallisesti kontrolloida importiinien sekventoimia SAF:eja.
Nukleosytoplasmisen sukkulointikoneiston muiden komponenttien rooli mitoosin aikana
RanGTP:n sitoutuminen exportiineihin stabiloi sen vuorovaikutusta NES-kuljetusproteiinien kanssa. Tärkeimmän exportiinin, CRM1:n, osoitettiin osallistuvan NES-proteiinien kohdistamiseen kinetokoriin tai sentrosomeihin. Kinetokorissa CRM1 rekrytoi RanBP2-RanGAP1-SUMO-kompleksin, jota tarvitaan MT:n ja kinetokorin vuorovaikutukseen (Arnaoutov ym., 2005). Mekanistisesti on kuitenkin vielä epäselvää, miten tämä kompleksi suosii MT:n ja kinetokorin vuorovaikutusta (Forbes ym., 2015). CRM1 edistää myös RanGAP1-RanBP2:n rekrytoitumista karalle RanGTP-riippuvaisella tavalla (Wu ym., 2013), ja se osallistuu kromosomimatkustajakompleksin sitomiseen sentromeeriin suoran vuorovaikutuksensa kautta surviviinin kanssa (Knauer ym., 2006). CRM1:n on myös osoitettu edistävän BRCA1:n ja perisentriinin rekrytoitumista mitoottisiin sentrosomeihin, mikä edistää sentrosomien MT-kokoonpanotoimintaa (Liu ym., 2009; Brodie ja Henderson, 2012). Hiljattain havaittiin, että transkriptionaalisella repressorilla Bach1:llä on rooli kromosomivarsien kohdentumisessa mitoosin aikana ja että se poistuu kromosomeista metafaasin aikana CRM1:stä riippuvaisella tavalla (Li ym., 2012).
Mekanistisesti näiden kohdentumistapahtumien merkitys ei kuitenkaan ole täysin selvä (Yokoyama ja Gruss, 2013). Merkittävä ongelma on se, että mitoosin aikana exportiinivälitteisten vuorovaikutusten oletettua roolia voi olla vaikea erottaa importiinivälitteisten vuorovaikutusten roolista, koska niihin liittyy proteiineja, joilla on sekä NES että NLS . Näyttää kuitenkin ilmeiseltä, että CRM1:n RanGTP-säätelyllä on useita rooleja mitoosin aikana, ja on mielenkiintoista testata, ovatko myös muut exportiinit tärkeitä mitoosin tapahtumissa.
RanGTP-reitin säilyminen jakautuvissa soluissa
Viimeisten 15 vuoden aikana RanGTP-reittiä on tutkittu useissa organismeissa ja solutyypeissä. Sen on todettu esittävän vaihtelua joissakin yksityiskohdissa tai joissakin tapauksissa olevan tarpeeton. Joissakin meioottisissa järjestelmissä RanGTP-reitin osuus näyttääkin olevan epäolennainen. Esimerkiksi Drosophilan spermatosyytit voivat koota meioosi I:n karan täysin ilman kromosomeja (Bucciarelli et al., 2003). Myös meioosi I:n akentrosomaalisen karan kokoaminen hiirten ja sammakoiden munasoluissa osoitettiin olevan vain osittain riippuvainen RanGTP-reitistä, vaikka reitti on ehdottoman välttämätön karan kokoamiselle meioosi II:n aikana (Dumont ym., 2007).
Jopa järjestelmissä, jotka luottavat RanGTP:hen karan kokoamisessa, on jonkin verran vaihtelua ainakin koneiston tasolla. Esimerkiksi TPX2:ta, joka on välttämätön sammakoilla ja nisäkkäillä, ei ole Caenorhabditis elegansissa ja Drosophila melanogasterissa. Vaikka näissä järjestelmissä on tunnistettu proteiineja, joilla on joitakin TPX2:n ominaisuuksia (Ozlu ym., 2005; Goshima, 2011), niiltä puuttuvat TPX2:n olennaiset ominaisuudet, kuten NLS, joka on RanGTP:n säätelyn perustana. Tämä esimerkki osoittaa, että RanGTP-reitin vaikuttajat saattavat vaihdella järjestelmästä toiseen, vaikka pääperiaatteet todennäköisesti säilyvät ja konservoituvat.
RanGTP-reitti: A Moonlighting Pathway with a Role in Several Cellular Functions
RanGTP-reitti on esimerkki kokonaisesta reitistä, joka toteuttaa olennaisia toimintoja solusyklin eri osissa. Interfaasissa se orkestroi tuman ja sytoplasman välistä kuljetusta, kun taas mitoosissa se ohjaa karan kokoamista ja myöhemmin ydinkalvon ja NPC:n uudelleen kokoamista (kuvat 1B-D). Yksittäisiä proteiineja, joilla on eri aikoina eri tehtäviä, kutsutaan moonlighting-proteiineiksi (Jeffery, 1999). RanGTP-reitti voisi siis olla esimerkki moonlighting-reitistä.
RanGTP-reitti on erityisen mielenkiintoinen, koska se osoittaa, miten proteiinin funktio riippuu sen kontekstista: useimmilla SAF:illa on ydintoimintoja ja ne pidetään erillään tubuliineista ja muista sytoskelettiproteiineista interfaasin aikana. NEBD:n yhteydessä yleinen konteksti muuttuu ja SAF:t harjoittavat tärkeitä MT:hen liittyviä toimintoja.
Jotkin tiedot viittaavat siihen, että RanGTP-reitillä on kuutamofunktio värekarvojen muodostumisessa ja kuljetuksessa värekarvoihin. RanGTP:n on osoitettu kontrolloivan Kif17:n ja retinis pigmentosa 2:n kertymistä cilioplasmaan (Dishinger ym., 2010; Hurd ym., 2011), jossa RanGTP on keskittynyt (Fan ym., 2011). Nykyinen työskentelymalli on, että RanGTP-reitti orkestroi säikeiden lokalisointisignaalia kantavien lastien kuljettamista säikeiden huokoskompleksin läpi, jonka on ehdotettu sijaitsevan säikeen tyvessä (Kee et al., 2012; kuva 1E). Tarvitaan kuitenkin lisätutkimuksia, jotta ymmärretään, miten RanGTP-gradientti muodostuu värekarvoihin ja mitä muita cargoja se kuljettaa värekarvoihin.
Interenkiintoista on, että RanGTP-reitti kuukkeloi myös erilaistuneissa neuroneissa, joissa monilla SAF:illa on myös tehtävä . Lisäksi importiinit α ja β kerääntyvät dendriittiseen synaptiseen tilaan ja niillä on rooli cargojen kuljettamisessa synapseista ytimeen (Jordan ja Kreutz, 2009; Panayotis ym., 2015). Lopuksi on osoitettu, että RanGTP:n säätelemä mekanismi vaikuttaa vasteena iskiashermon vammoihin (Hanz ym., 2003; Yudin ym., 2008; kuva 1F).
Tulokset
RanGTP-reitin roolin tunnistaminen solun jakautumisen aikana tapahtui yli 15 vuotta sitten. Nyt tiedämme, että RanGTP-reitillä on muitakin toimintoja, ja sitä voidaan pitää kuutamoreittinä, joka ohjaa useita tärkeitä soluprosesseja (kuva 1). Solunjakautumisen aikana se ohjaa olennaisia mekanismeja, joita alamme ymmärtää sen suorien kohteiden tunnistamisen ja toiminnallisen karakterisoinnin ansiosta. Useita avoimia kysymyksiä on kuitenkin vielä ratkaisematta. SAF:ien kokonaismäärää on vaikea ennakoida, joten emme tiedä, kuinka monta niistä on vielä tunnistamatta. Lisäksi suurin osa nykyisistä tiedoistamme rajoittuu vain joidenkin ydin-sytoplasman kuljetuskoneiston komponenttien rooliin. Esimerkiksi ihmissolussa esiintyvien eri importiinien oletetusta roolista solunjakautumisessa tiedetään tällä hetkellä hyvin vähän. Tietyt imortiinit voivat säädellä uusien SAF:ien toimintaa, ja niiden erilaiset ilmentymismallit eri solutyypeissä ja kudoksissa voivat tarjota asianmukaisen yhdistelmämekanismin. Tiedämme myös vain vähän vientikoneiston komponenttien oletetusta roolista karan kokoonpanossa ja muissa reitin uusissa toiminnoissa. Vaikka on olemassa tietoja, jotka viittaavat itse reitin eri säätelykohtiin, sen seuraukset solunjakautumiselle ja muille prosesseille eivät ole vielä selvillä, kuten ei myöskään se, miten sitä voidaan mukauttaa eri solutyyppien tai kudosten vaatimuksiin. RanGTP-reitin tutkimus tarjoaa varmasti jännittäviä uusia oivalluksia lähivuosina ja paljastaa joitakin solujen järjestäytymisen ja toiminnan kannalta olennaisia mekanismeja.
Tekijöiden panos
IV ja TC kirjoittivat käsikirjoituksen, TC laati taulukon ja kuvion.
Rahoitus
TC:tä on tukenut Espanjan talous- ja kilpailukykyministeriö (MINECO) FPI:n apurahan BES-2010-031355 kautta. Vernosin laboratoriossa tehtävää työtä on tuettu Espanjan ministeriön apurahoilla BFU2009-10202 ja BFU2012-37163, joita on yhteisrahoitettu Euroopan aluekehitysrahastosta (EAKR/FEDER). Kiitämme myös Espanjan talous- ja kilpailukykyministeriön tuesta, ”Centro de Excelencia Severo Ochoa 2013-2017”, SEV-2012-0208.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Haluamme kiittää Vernosin laboratorion jäseniä kriittisistä keskusteluista RanGTP-reitin eri näkökohdista.
Lyhenteet
γTuRC, γTubuliinirengaskompleksi; K-Fiber, kinetokori-kuori; KANLS, KAT8-assosioitunut epäspesifinen tappava kompleksi (KAT8-associated nonspecific lethal complex); MT, mikrotubuli; NEBD, ydinkuoren hajoaminen (Nuclear Envelope Breakdown); NES, ydinvoiman vientisignaali; NLS, Nuclear Localization Signal; NPC, Nuclear Pore Complex; NTR, Nuclear Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Importin-beta:n rooli Ranin kytkemisessä alavirran kohteisiin mikrotubulusten kokoonpanossa. Science 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar