- Historical Perspective on the Chromatin Dependent MT Assembly Pathway
- Il trasporto nucleocitoplasmatico e la piccola GTPasi Ran
- Il percorso di RanGTP durante la divisione cellulare
- Comprendere il percorso di RanGTP attraverso l’identificazione e la caratterizzazione funzionale dei suoi bersagli
- Regolazione del sistema RanGTP durante la divisione cellulare
- Il ruolo di altri componenti del macchinario di shuttling nucleocitoplasmatico durante la mitosi
- Conservazione del percorso RanGTP nelle cellule che si dividono
- La via di RanGTP: Una via lunare con un ruolo in diverse funzioni cellulari
- Conclusioni
- Contributi degli autori
- Finanziamento
- Conflict of Interest Statement
- Riconoscimenti
- Abbreviazioni
Historical Perspective on the Chromatin Dependent MT Assembly Pathway
I primi accenni all’esistenza di un meccanismo di assemblaggio MT dipendente dal cromosoma nella cellula in divisione furono ottenuti negli anni 1970-1980 quando diversi gruppi riportarono che la nucleazione MT avveniva vicino o ai cinetocori (McGill e Brinkley, 1975; Telzer et al., 1975; Witt et al., 1980; De Brabander et al., 1981) e una struttura simile a un fuso si formava intorno al DNA lambda iniettato in uova di Xenopus arrestate in metafase (Karsenti et al., 1984). Nel 1996, è stato dimostrato che le perline rivestite di DNA innescano la formazione di fusi bipolari quando vengono incubate in estratti di uova di Xenopus (Heald et al., 1996), fornendo ulteriore supporto all’idea che la cromatina porta tutte le informazioni necessarie per dirigere l’assemblaggio e l’organizzazione della MT nel citoplasma della fase M. Poco dopo, l’identificazione della piccola GTPasi Ran come motore dell’assemblaggio MT dipendente dalla cromatina nel citoplasma della fase M ha fornito un importante passo avanti nella comprensione del meccanismo sottostante (Carazo-Salas et al., 1999; Kalab et al., 1999; Ohba et al., 1999; Wilde e Zheng, 1999; Zhang et al., 1999). Oggi sappiamo che i cromosomi guidano l’assemblaggio e l’organizzazione della MT in un fuso bipolare in maniera RanGTP dipendente nella maggior parte delle cellule (Karsenti e Vernos, 2001; Rieder, 2005).
In questa mini-review descriveremo brevemente come il sistema RanGTP regola lo shuttling nucleo-citoplasmatico dei componenti in interfase e, dopo la NEBD, l’attività e/o la localizzazione di fattori specifici per guidare l’assemblaggio del fuso. Rivedremo brevemente le nostre attuali conoscenze sull’identità e la funzione dei fattori regolati da RanGTP e i recenti progressi nella comprensione dei nuovi meccanismi regolati da RanGTP. Infine forniremo una panoramica della regolazione del percorso di RanGTP stesso durante la mitosi, la sua conservazione in diversi organismi e tipi di cellule, e il suo ruolo in altre funzioni cellulari. Per ulteriori informazioni rimandiamo il lettore a eccellenti recensioni (Ciciarello et al., 2007; O’Connell e Khodjakov, 2007; Clarke e Zhang, 2008; Kalab e Heald, 2008; Roscioli et al., 2010; Forbes et al, 2015).
Il trasporto nucleocitoplasmatico e la piccola GTPasi Ran
Le cellule eucariotiche sono compartimentate e hanno sistemi di trasporto specifici per la comunicazione tra il citoplasma e i diversi organelli legati alla membrana. Il sistema di trasporto nucleo-citoplasma è essenziale per collegare funzionalmente la trascrizione del genoma che avviene nel nucleo, con la traduzione delle proteine che avviene nel citoplasma (Figure 1A,B). Il trasporto di molecole dentro e fuori il nucleo avviene attraverso il complesso del poro nucleare (NPC), un grande complesso proteico di ~60 MDa inserito nella membrana nucleare (Sorokin et al., 2007). I piccoli carichi (< 40 kDa) si diffondono rapidamente attraverso l’NPC. Invece, le proteine più grandi di 40 kDa richiedono un trasporto attivo attraverso l’NPC che coinvolge recettori di trasporto nucleare solubili (NTR) che appartengono alla famiglia delle proteine karyopherin-β. Le NTR che facilitano il trasporto di proteine di carico nel nucleo sono chiamate importine e interagiscono con il loro carico attraverso un segnale di localizzazione nucleare (NLS) ricco di residui basici. Le NTR che facilitano l’esportazione di proteine fuori dal nucleo sono chiamate exportine e interagiscono con il loro carico attraverso un segnale di esportazione nucleare (NES) ricco di residui idrofobici come la leucina. L’importina karyopherin-β β1 spesso interagisce con il carico attraverso un adattatore della famiglia importina α (Sorokin et al., 2007). L’importina α si lega direttamente alla NLS della proteina cargo e all’importina β1 attraverso un dominio IBB (importin β binding domain), portando alla formazione di un complesso trimerico.
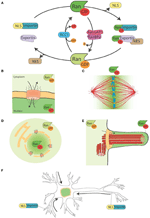
Figura 1. Il sistema Ran e le sue funzioni lunari. (A) Rappresentazione schematica del sistema Ran per il controllo spaziale delle proteine portatrici di NLS e NES. Nelle cellule Ran si trova in due forme, RanGTP (verde) e RanGDP (verde chiaro). RCC1 (azzurro) promuove lo scambio di GDP a GTP, mentre RanGAP1-RanBP2 (in rosa e viola) promuovono l’idrolisi di GTP in GDP. RanGTP si lega alle importine (verde turchese) e alle exportine (viola chiaro). Le exportine in complesso con RanGTP possono associarsi alle proteine NES (in marrone). D’altra parte, il legame di RanGTP alle importine innesca la loro dissociazione dalle proteine NLS (giallo). (B) Durante l’interfase, il sistema Ran controlla lo spostamento nucleo-citoplasma delle proteine, perché RanGTP è predominante nel nucleoplasma e RanGDP è predominante nel citoplasma (Sorokin et al., 2007). (C) Durante la mitosi l’associazione di RCC1, il RanGEF, con i cromosomi definisce un gradiente di concentrazioni di RanGTP che promuove il rilascio di SAF e la nucleazione di MT intorno alla cromatina. Il sistema Ran viene convertito in una via per l’assemblaggio e l’organizzazione di MT che è essenziale per l’assemblaggio del fuso mitotico. Il percorso RanGTP dipende dall’instaurazione di un gradiente di concentrazione di RanGTP che raggiunge i picchi intorno ai cromosomi (Kalab et al., 2002; Caudron et al., 2005). (D) Alla fine della mitosi, il sistema Ran regola anche il riassemblaggio della membrana nucleare e della CPN controllando la fusione della membrana e rilasciando i componenti della CPN (Walther et al., 2003; Harel et al., 2003). (E) Nelle cellule ciliate RanGTP si accumula nel cilioplasma e promuove il trasporto e l’accumulo di Kif17 e retinis pigmentosa 2 nel cilioplasma (Dishinger et al., 2010; Fan et al., 2011; Hurd et al., 2011). (F) Nei neuroni molte SAF hanno una funzione. Inoltre, le importine localizzano nello spazio sinaptico dendritico e sono coinvolte nel trasporto dei carichi al nucleo (Jordan e Kreutz, 2009; Panayotis et al., 2015). Il sistema Ran è attivo anche nell’assone del nervo sciatico, dove al momento della lesione le importine promuovono il trasporto di cargos verso il corpo cellulare del neurone (Hanz et al., 2003; Yudin et al., 2008).
NTRs si associano alla piccola GTPasi Ran che agisce come un interruttore molecolare. Nella sua forma legata al GTP, Ran (RanGTP) interagisce con le proteine karyopherin-β con alta affinità, mentre si dissocia nella sua forma legata al GDP (RanGDP). Il legame di RanGTP con le importine e le esportine ha conseguenze molto diverse: stabilizza l’interazione exportin-cargo mentre destabilizza l’interazione importin-cargo (Figura 1A).
Il RanGEF (guanine nucleotide exchange factor) RCC1 si associa alla cromatina all’interno del nucleo, mentre RanGAP (GTPase activating protein) è citoplasmatico. Di conseguenza, la forma predominante di Ran nel nucleo è legata al GTP, mentre nel citoplasma è legata al GDP. Così le proteine NLS trasportate nel nucleo dalle importine vengono rilasciate e si accumulano nel nucleoplasma, mentre le proteine NES in complesso con exportin-RanGTP vengono trasportate fuori dal nucleo (Figure 1A,B).
Anche se il trasporto nucleo-citoplasmatico non è più necessario quando una cellula entra in mitosi, il suo complesso macchinario molecolare viene riciclato per promuovere l’assemblaggio MT intorno alla cromatina e per dirigere l’organizzazione del fuso bipolare (Clarke e Zhang, 2008).
Il percorso di RanGTP durante la divisione cellulare
Come RCC1 rimane associato alla cromatina dopo la NEBD, RanGTP è altamente arricchito nelle vicinanze dei cromosomi. Quando RanGTP si allontana dalla cromatina, RanGAP nel citoplasma lo converte in RanGDP (Figura 1C). Il gradiente risultante è stato direttamente visualizzato in cellule ed estratti di uova di Xenopus (Kalab et al., 2002, 2006) e le sue proprietà nella nucleazione e stabilizzazione della MT sono state testate e modellate (Caudron et al., 2005). Come nell’interfase, questo sistema fornisce un controllo spaziale sulla stabilità dei complessi NTR-cargo. I cargos sono proteine contenenti NLS e/o NES con funzioni specifiche legate all’assemblaggio e alla funzione del fuso. Le proteine NLS con un ruolo nell’assemblaggio del fuso sono state chiamate SAFs (Spindle Assembly Factors).
La scoperta e la caratterizzazione del percorso di RanGTP ha spinto a riesaminare il modello Search and Capture per l’assemblaggio del fuso proposto nel 1986 (Kirschner e Mitchison, 1986). Questo modello postula che le MT centrosomali crescono e si restringono esplorando lo spazio citoplasmatico fino a quando un incontro stocastico con un cinetocoro promuove la loro cattura e il loro attaccamento. Tuttavia, è stato ormai chiaramente stabilito che le cellule animali private sperimentalmente dei loro centrosomi assemblano un fuso mitotico funzionale (Debec et al., 1995; Khodjakov et al., 2000). Inoltre, simulazioni matematiche hanno suggerito che il meccanismo di ricerca e cattura non potrebbe spiegare il breve tempo di divisione osservato nella maggior parte delle cellule animali (Wollman et al., 2005). Promuovendo la nucleazione e la stabilizzazione della MT in prossimità dei cromosomi, la via del RanGTP favorisce certamente la cattura della MT da parte dei cinetocori, aumentando l’efficienza del meccanismo di ricerca e cattura. Tuttavia, il ruolo del percorso di RanGTP deve andare oltre la cattura della MT da parte dei cinetocori e la formazione delle fibre del cinetocoro (K-fibre) poiché promuove anche l’organizzazione della MT in assenza di cromosomi, cinetocori e fibre K (Carazo-Salas et al., 1999). L’identificazione dei bersagli diretti e indiretti di RanGTP nel citoplasma della fase M è quindi un passo essenziale per comprendere appieno i diversi ruoli che questo percorso svolge durante la divisione cellulare.
Comprendere il percorso di RanGTP attraverso l’identificazione e la caratterizzazione funzionale dei suoi bersagli
Una lettura diretta del ruolo di RanGTP nel citoplasma della fase M è stata ottenuta in estratti di uova di Xenopus privi di cromatina e centrosomi. L’aggiunta di RanGTP a questi estratti è infatti sufficiente per innescare la nucleazione di MT, promuovere la stabilizzazione di MT e indurre l’organizzazione di assemblaggi di MT chiamati mini-fusi (Carazo-Salas et al., 1999, 2001). Pertanto, uno o più SAF potrebbero essere coinvolti in questi diversi eventi.
Dall’identificazione dei primi SAF nel 2001 (Gruss et al., 2001; Nachury et al., 2001; Wiese et al, 2001; Clarke e Zhang, 2008; Meunier e Vernos, 2012), il numero di proteine controllate da RanGTP nella mitosi è cresciuto lentamente e diverse nuove SAF sono state identificate recentemente (CDK11, CHD4, ISWI, Kif14, Kif2a, MCRS1, Mel28, Anillin, APC; Silverman-Gavrila et al, 2008; Yokoyama et al., 2008, 2009, 2014; Dikovskaya et al., 2010; Meunier e Vernos, 2011; Samwer et al., 2013; Wilbur e Heald, 2013). Attualmente, 22 proteine sono state convalidate come SAF (Tabella 1). Inoltre, un certo numero di proteine con ruoli stabiliti in vari aspetti dell’assemblaggio del fuso sono nucleari e potrebbero quindi essere bersagli della regolazione di RanGTP (ad esempio, Kif4a/Klp1, Ino80, Reptin), ma ulteriori studi dovrebbero affrontare questa possibilità.

Tabella 1. Fattori di assemblaggio del fuso.
Interessante, la caratterizzazione funzionale di alcuni dei SAF sta fornendo approfondimenti meccanicistici sulle funzioni del percorso di RanGTP nella cellula in divisione. Il meccanismo con cui RanGTP promuove la nucleazione di MT de novo nel citoplasma della fase M è stato recentemente descritto (Scrofani et al., 2015). Liberando TPX2 dalle importine, RanGTP promuove la sua interazione con Aurora A e con un complesso RHAMM-NEDD1-γTURC (γTubulin Ring Complex). In questo nuovo complesso l’Aurora A attivata fosforila NEDD1, un requisito essenziale per la nucleazione della MT. Un altro SAF, Mel28, ha dimostrato di interagire con il γTuRC ed è stato proposto per svolgere un ruolo nella nucleazione MT dipendente da RanGTP (Yokoyama et al., 2014). La potenziale cooperazione di Mel28 con la via TPX2-dipendente descritta sopra rimane da stabilire.
La via RanGTP contribuisce anche alla maturazione del centrosoma e alla sua attività di assemblaggio MT (Carazo-Salas et al., 2001). Infatti due SAF, CDK11, e Mel28 hanno dimostrato di favorire l’assemblaggio di MT al centrosoma (Yokoyama et al., 2008, 2014).
L’identificazione e la caratterizzazione di un’altra SAF, MCRS1, ha rivelato un nuovo e importante meccanismo per la regolazione della dinamica delle minus-end MT delle fibre K (Meunier e Vernos, 2011) e nuove conoscenze sul ruolo della via RanGTP nell’assemblaggio del fuso e nella divisione cellulare (Meunier e Vernos, 2012). MCRS1, in complesso con i membri del modificatore della cromatina KAT8-associated nonspecific lethal (KANSL) complex (Meunier et al., 2015), è mirato alla minus-end delle MT dipendenti da RanGTP proteggendole dalla depolimerizzazione. All’interno del fuso MCRS1 si associa anche specificamente con le minus-end di K-fiber MTs e regola il loro tasso di depolimerizzazione giocando un ruolo essenziale nella dinamica delle K-fiber e nell’allineamento dei cromosomi (Meunier e Vernos, 2011; Meunier et al., 2015). L’associazione specifica di MCRS1 con le MT nucleate dal percorso RanGTP dipendente suggerisce anche che queste MT abbiano caratteristiche specifiche che le distinguono dalle MT nucleate dai centrosomi. Se questo si rivelasse vero, le MT cromosomiche non sarebbero semplicemente una fornitura locale di MT che favorisce un efficiente meccanismo di Ricerca e Cattura, ma potrebbero fornire funzionalità uniche essenziali richieste per l’assemblaggio e la funzione del fuso bipolare (Meunier et al, 2015).
Recentemente è stato dimostrato che la chinesina depolimerizzante MT Kif2a è regolata da RanGTP in mitosi, rivelando un importante meccanismo per il ridimensionamento del fuso alle dimensioni della cellula durante il primo sviluppo degli embrioni di Xenopus (Wilbur e Heald, 2013). Kif2a è mantenuto inattivo dall’importina α fino allo stadio 8 dello sviluppo embrionale. Quando la concentrazione solubile di importina α diminuisce, Kif2a viene rilasciata e funziona come depolimerasi MT promuovendo l’accorciamento del fuso.
Anche se, la maggior parte delle SAF identificate finora sono state trovate a svolgere un ruolo nelle prime fasi della divisione cellulare, una serie di rapporti recenti indicano che il percorso RanGTP ha altri ruoli essenziali non direttamente legati all’assemblaggio del fuso. Infatti, la caratterizzazione del SAF ISWI suggerisce funzioni per il percorso RanGTP durante l’anafase (Yokoyama et al., 2009).
Molteplici linee di ricerca indicano anche che gioca un ruolo nel posizionamento del fuso. Infatti, prima di entrare in anafase, il gradiente di RanGTP limita la localizzazione del complesso LGN-NuMa ad aree della corteccia cellulare più lontane dai cromosomi, contribuendo al controllo della posizione e dell’orientamento del fuso (Kiyomitsu e Cheeseman, 2012).
Inoltre, RanGTP regola anche obiettivi non correlati al MT. Infatti, controlla la localizzazione di Anillina e innesca l’allungamento asimmetrico della membrana durante l’anafase, definendo il posizionamento del fuso al centro della cellula in divisione (Silverman-Gavrila et al., 2008; Kiyomitsu e Cheeseman, 2012). Infine, durante la citochinesi la via di RanGTP regola l’attività della chinesina Kif14/Nabkin nell’impacchettamento dell’actina (Carleton et al., 2006; Samwer et al., 2013) e coordina il riassemblaggio della membrana nucleare e della PNG (Harel et al., 2003; Walther et al., 2003; Ciciarello et al, 2010; Roscioli et al., 2010; Forbes et al., 2015; Figura 1D).
È quindi chiaro che l’identificazione e la caratterizzazione funzionale dei bersagli mitotici di RanGTP sta fornendo nuove intuizioni sul meccanismo di assemblaggio del fuso e della divisione cellulare. Tuttavia, non è chiaro se restano da identificare molti o pochi altri bersagli di RanGTP. Questo numero potrebbe essere potenzialmente alto dato che il numero di proteine nucleari è dell’ordine di centinaia o migliaia (Dellaire et al., 2003), almeno un ordine di grandezza al di sopra del numero attuale di bersagli conosciuti di RanGTP nella cellula in divisione (Tabella 1).
La maggior parte degli studi proteomici volti a identificare nuovi SAF si sono concentrati sulle importine α1 e β1 (Nachury et al, 2001; Wiese et al., 2001; Yokoyama et al., 2008), che sono due delle importine più abbondanti negli estratti di uova di Xenopus (Bernis et al., 2014; Wuhr et al., 2014). Tuttavia, ci sono cinque ulteriori α-importine e otto ulteriori β-importine nell’uomo (Cautain et al., 2015).
Anche se ancora scarsi, alcuni dati indicano che effettivamente anche altre importine svolgono un ruolo durante la divisione cellulare. È stato dimostrato che la regolazione di RanGTP di NuSAP dipende da importin-β1 e importin-7 (Ribbeck et al., 2006) e quella di Mel28, Nup107-160, e Nup98 da importin-β1 e transportin/importin-β2 (Lau et al., 2009). Transportin ha anche dimostrato specificamente di regolare negativamente l’assemblaggio del fuso e il riassemblaggio della membrana nucleare e delle NPC (Bernis et al., 2014). Tuttavia, non sono stati descritti fattori mitotici regolati esclusivamente dall’importina-7 o dalla trasportina.
La caratterizzazione di possibili target specifici della trasportina e, più in generale, delle altre importine α e β rappresenta un campo aperto di esplorazione. Questo potrebbe essere importante per comprendere la regolazione della via di RanGTP, specialmente considerando che i modelli di espressione delle importine cambiano significativamente in diversi stadi di sviluppo e tessuti (Hosokawa et al., 2008).
Regolazione del sistema RanGTP durante la divisione cellulare
Al di là delle specificità delle interazioni NTR-SAF, diversi meccanismi possono influire direttamente sulla via di RanGTP durante la divisione cellulare. Diversi dati suggeriscono che la stessa RCC1 è un componente chiave sottoposta a una regolazione fine. Le cellule umane hanno tre isoforme di RCC1, che sono espresse in modo specifico per i tessuti (Hood e Clarke, 2007). Le isoforme differiscono nel loro N-terminale, una regione coinvolta nel legame con l’importina e regolata dalla fosforilazione, che è stata proposta per influenzare la produzione di RanGTP accoppiata al cromosoma (Hood e Clarke, 2007; Li et al., 2007). Inoltre, il livello di espressione di RCC1 varia anche in diverse cellule e si correla con la ripidità del gradiente RanGTP (Hasegawa et al., 2013). Questo può avere conseguenze importanti, in quanto è stato proposto che la ripidità del gradiente RanGTP determina la lunghezza della prometafase e della metafase, che a sua volta può essere rilevante per la fedeltà di segregazione dei cromosomi (Silkworth et al., 2012; Hasegawa et al., 2013).
Altri meccanismi, come le modifiche post-traslazionali e lo splicing alternativo sono anche potenziali strategie per controllare la NLS di SAFs. Tuttavia, questi meccanismi influenzerebbero piuttosto una particolare proteina che l’intero percorso di RanGTP.
Recentemente, è stato proposto un meccanismo alternativo per la regolazione delle SAF indipendentemente da RanGTP. Il targeting della proteina del Golgi GM130 alle membrane del Golgi frammentate nella mitosi può competere localmente con TPX2 dal legame dell’importina α1, favorendo così l’assemblaggio di MT nelle vicinanze dei frammenti del Golgi (Wei et al., 2015). Questo meccanismo basato sulla competizione potrebbe essere un’altra strategia per controllare localmente i SAF sequestrati dalle importine.
Il ruolo di altri componenti del macchinario di shuttling nucleocitoplasmatico durante la mitosi
Il legame di RanGTP alle esportine stabilizza la sua interazione con le proteine NES-cargo. È stato dimostrato che la principale exportina, CRM1, è coinvolta nel puntamento delle proteine NES al cinetocoro o ai centrosomi. Al cinetocoro, CRM1 recluta il complesso RanBP2-RanGAP1-SUMO che è richiesto per l’interazione tra MTs e il cinetocoro (Arnaoutov et al., 2005). Tuttavia, non è ancora meccanicamente chiaro come questo complesso favorisca l’interazione MT-cinetocoro (Forbes et al., 2015). CRM1 promuove anche il reclutamento di RanGAP1-RanBP2 al fuso in modo RanGTP dipendente (Wu et al., 2013) ed è coinvolto nel legare il complesso Chromosome Passenger al centromero attraverso la sua interazione diretta con survivin (Knauer et al., 2006). CRM1 ha anche dimostrato di promuovere il reclutamento di BRCA1 e pericentrina ai centrosomi mitotici, promuovendo così l’attività di assemblaggio MT dei centrosomi (Liu et al., 2009; Brodie e Henderson, 2012). Recentemente, il repressore trascrizionale Bach1 è stato trovato a svolgere un ruolo nell’allineamento dei bracci cromosomici durante la mitosi e ad essere escluso dai cromosomi durante la metafase in modo CRM1-dipendente (Li et al., 2012).
Tuttavia, il significato di questi eventi di targeting non è del tutto chiaro dal punto di vista meccanico (Yokoyama e Gruss, 2013). Un problema importante è che durante la mitosi il ruolo putativo delle interazioni mediate dall’exportina può essere difficile da districare da quello delle interazioni mediate dall’importina, poiché esse coinvolgono proteine che hanno sia NES che NLS. Tuttavia, sembra evidente che la regolazione RanGTP di CRM1 ha diversi ruoli durante la mitosi e sarà interessante verificare se anche altre exportine sono importanti per gli eventi mitotici.
Conservazione del percorso RanGTP nelle cellule che si dividono
Negli ultimi 15 anni il percorso RanGTP è stato studiato in diversi organismi e tipi cellulari. Si è scoperto che presenta variazioni su alcuni dettagli o in alcuni casi che non è necessaria. Infatti, in alcuni sistemi meiotici il contributo della via RanGTP sembra essere non essenziale. Per esempio, gli spermatociti di Drosophila possono assemblare il fuso della meiosi I in completa assenza di cromosomi (Bucciarelli et al., 2003). L’assemblaggio del fuso acentrosomale della meiosi I negli ovociti di topi e rane ha anche dimostrato di essere solo parzialmente dipendente dal percorso di RanGTP, sebbene il percorso sia strettamente essenziale per l’assemblaggio del fuso durante la meiosi II (Dumont et al., 2007).
Anche nei sistemi che si basano su RanGTP per l’assemblaggio del fuso ci sono alcune variazioni almeno a livello del macchinario. Per esempio, TPX2, che è essenziale nelle rane e nei mammiferi, non è presente in Caenorhabditis elegans e Drosophila melanogaster. Anche se proteine con alcune delle caratteristiche di TPX2 sono state identificate in questi sistemi (Ozlu et al., 2005; Goshima, 2011), mancano di caratteristiche essenziali di TPX2, come una NLS che è alla base della regolazione di RanGTP. Questo esempio indica che gli effettori della via di RanGTP possono variare da sistema a sistema, anche se i principi principali sono probabilmente mantenuti e conservati.
La via di RanGTP: Una via lunare con un ruolo in diverse funzioni cellulari
La via di RanGTP è un esempio di una via intera che svolge funzioni essenziali in diverse parti del ciclo cellulare. Nell’interfase, orchestra il trasporto nucleo-citoplasmatico, mentre nella mitosi guida l’assemblaggio del fuso e successivamente la membrana nucleare e il riassemblaggio della PNG (figure 1B-D). Le singole proteine che hanno funzioni diverse in momenti diversi sono definite proteine “moonlighting” (Jeffery, 1999). La via di RanGTP potrebbe quindi essere un esempio di una via di moonlighting.
La via di RanGTP è particolarmente interessante, perché mostra come la funzione di una proteina dipende dal suo contesto: la maggior parte delle SAF hanno funzioni nucleari e sono tenute separate dalle tubuline e da altre proteine del citoscheletro durante l’interfase. Dopo la NEBD, il contesto generale cambia e le SAF esercitano importanti funzioni legate alle MT.
Alcuni dati puntano verso una funzione lunare della via di RanGTP nella formazione delle ciglia e nel trasporto nel cilium. È stato dimostrato che RanGTP controlla l’accumulo di Kif17 e retinis pigmentosa 2 nel cilioplasma (Dishinger et al., 2010; Hurd et al., 2011), dove RanGTP è concentrato (Fan et al., 2011). L’attuale modello di lavoro è che il percorso di RanGTP orchestri il trasporto di carichi che trasportano un segnale di localizzazione ciliare attraverso il complesso dei pori ciliari, che è stato proposto per essere situato alla base del cilium (Kee et al., 2012; Figura 1E). Tuttavia, sono necessari ulteriori studi per capire come il gradiente RanGTP è stabilito nelle cilia e quali altri carichi trasporta nelle cilia.
Interessante, il percorso RanGTP si illumina anche nei neuroni differenziati, dove molti SAF hanno anche una funzione. Inoltre le importine α e β si accumulano nello spazio sinaptico dendritico e hanno un ruolo nel trasporto dei carichi dalle sinapsi al nucleo (Jordan e Kreutz, 2009; Panayotis et al., 2015). Infine, è stato dimostrato che un meccanismo regolato da RanGTP è in gioco in risposta alle lesioni del nervo sciatico (Hanz et al., 2003; Yudin et al., 2008; Figura 1F).
Conclusioni
L’identificazione del ruolo svolto dalla via RanGTP durante la divisione cellulare è avvenuta più di 15 anni fa. Ora sappiamo che la via di RanGTP ha ulteriori funzioni e potrebbe essere considerata una via di luna che controlla vari importanti processi cellulari (Figura 1). Durante la divisione cellulare guida meccanismi essenziali che iniziamo a comprendere grazie all’identificazione e alla caratterizzazione funzionale dei suoi bersagli diretti. Tuttavia, diverse questioni aperte devono ancora essere affrontate. Il numero totale di SAF è difficile da prevedere e quindi non sappiamo quanti ne restano ancora da identificare. Inoltre, la maggior parte delle nostre conoscenze attuali è limitata al ruolo di solo alcuni componenti del macchinario di trasporto nucleo-citoplasmatico. Per esempio, molto poco si sa attualmente sul ruolo putativo nella divisione cellulare delle diverse importine presenti nella cellula umana. Importine specifiche possono regolare l’attività di nuove SAF e i loro diversi modelli di espressione in diversi tipi di cellule e tessuti possono fornire un meccanismo combinatorio rilevante. Sappiamo anche poco sul ruolo putativo dei componenti del macchinario di esportazione nell’assemblaggio del fuso e nelle altre nuove funzioni del percorso. Anche se ci sono dati che suggeriscono vari punti di regolazione del percorso stesso, le conseguenze sulla divisione cellulare e altri processi non sono ancora chiare, né come possa essere adattato ai requisiti di diversi tipi di cellule o tessuti. Lo studio del percorso di RanGTP fornirà certamente nuove interessanti intuizioni nei prossimi anni, rivelando alcuni meccanismi essenziali per l’organizzazione e la funzione cellulare.
Contributi degli autori
IV e TC hanno scritto il manoscritto, TC ha preparato la tabella e la figura.
Finanziamento
TC è stato sostenuto dal Ministero spagnolo dell’economia e della competitività (MINECO) attraverso la borsa di studio FPI BES-2010-031355. Il lavoro nel laboratorio Vernos è stato sostenuto dalle sovvenzioni del ministero spagnolo BFU2009-10202 e BFU2012-37163, cofinanziate dal Fondo europeo di sviluppo regionale (FESR/FEDER). Riconosciamo anche il sostegno del Ministero spagnolo dell’economia e della competitività, “Centro de Excelencia Severo Ochoa 2013-2017,” SEV-2012-0208.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Vogliamo ringraziare i membri del laboratorio Vernos per le discussioni critiche sui vari aspetti del percorso di RanGTP.
Abbreviazioni
γTuRC, γTubulin Ring Complex; K-Fiber, Kinetochore-Fiber; KANLS, KAT8-associated nonspecific lethal complex; MT, Microtubule; NEBD, Nuclear Envelope Breakdown; NES, Nuclear Export Signal; NLS, Nuclear Localization Signal; NPC, Nuclear Pore Complex; NTR, Nuclear Transport Receptor; RanGAP, Ran GTPase Activating Protein; RanGEF, Ran Guanine nucleotide Exchange Factor; SAF, Spindle Assembly Factor.
Wiese, C. (2001). Ruolo di importin-beta nell’accoppiamento di Ran a obiettivi a valle nell’assemblaggio del microtubulo. Scienza 291, 653-656. doi: 10.1126/science.1057661
PubMed Abstract | CrossRef Full Text | Google Scholar